1 . SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
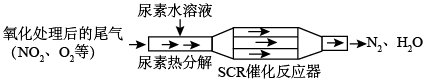
尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________ 。
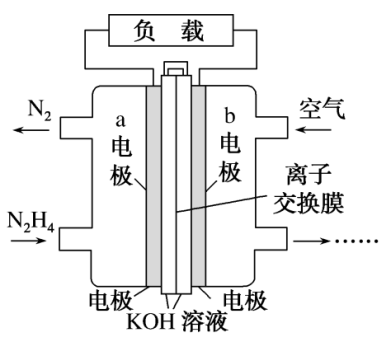
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为___________ ;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=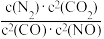 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___________ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol∙L-1∙min-1。
(1)SCR(选择性催化还原)工作原理:

尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为

(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=
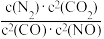 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=
您最近一年使用:0次
2021-11-19更新
|
103次组卷
|
2卷引用:黑龙江省龙东地区四校2021-2022学年高三上学期第一次联考化学试题
名校
2 . 研究表明I-可以作为水溶液中SO2歧化反应的催化剂:3SO2(g)+2H2O (l)=2H2SO4 (aq)+S(s) ΔH<0;该过程一般通过如下步骤来实现:①SO2(g)+4I-(aq)+4H+(aq)= S(s)+ 2I2(g) + 2H2O(l) ΔH>0;②I2(g)+2H2O(l)+SO2(g)=SO (aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
 (aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是A.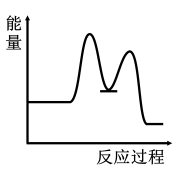 | B.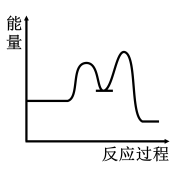 |
C.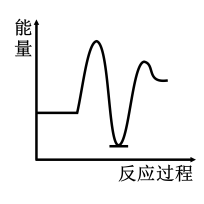 | D.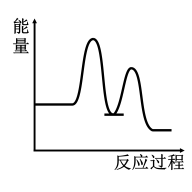 |
您最近一年使用:0次
2021-11-18更新
|
1083次组卷
|
14卷引用:黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题
黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题(已下线)2021年1月浙江高考化学试题变式题21-25黑龙江省哈尔滨市第三十二中学2021-2022学年高三上学期期末考试化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题河北省邯郸市第一中学2021-2022学年上学期高三上学期1月调研化学试题广东省珠海市2021-2022学年高二上学期期末考试化学试题广东省三校联考2022-2023学年高二上学期期中考试化学试题湖北省部分省级示范高中(四校联考)2022-2023学年高二上学期期末测试化学试题湖南省宁乡市2022-2023学年高二上学期期末考试化学试题湖北省宜昌市部分省级示范高中校级联合体2022-2023学年高二下学期期中考试化学试题广东省广州市三校2023—2024学年高二上学期期中联考化学考试广东省佛山市顺德区第一中学2023-2024学年高二上学期11月期中考试化学试题广东省广州市为明学校2023-2024学年高二上学期学情调研考化学试题
名校
解题方法
3 . 化学反应所提供的能量大大促进了社会的发展。请回答下列问题:
(1)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作火箭和导弹表面的耐高温材料: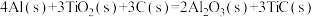
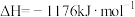 ,该反应过程中,每转移1 mol电子放出的热量为
,该反应过程中,每转移1 mol电子放出的热量为___________ 。
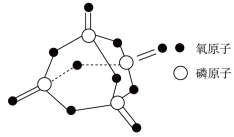
(2)键能可用于估算化学反应的反应热。已知白磷的燃烧热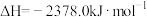 ,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=___________ 。
(3)我国科学家实现了在铜催化条件下将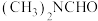 转化为
转化为 。计算机模拟
。计算机模拟单个分子 在铜催化剂表面的反应历程如图所示。
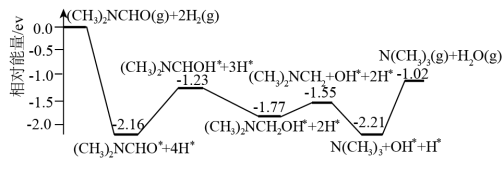
用相对能量 的变化来表示 ,写出该反应的热化学方程式
,写出该反应的热化学方程式___________ 。
(4)处理废水中的 可在微生物的作用下经过两步反应转化为
可在微生物的作用下经过两步反应转化为 ,两步反应的能量变化如图所示:
,两步反应的能量变化如图所示:
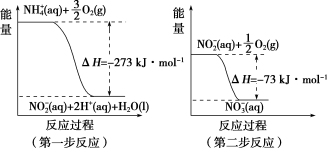
则1 mol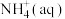 被氧化成
被氧化成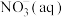 的热化学方程式是
的热化学方程式是___________ 。
(5)已知25℃和101 kPa下:
①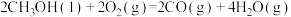
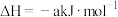
②
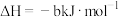
③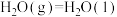

则表示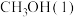 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(1)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作火箭和导弹表面的耐高温材料:
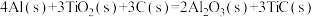
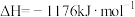 ,该反应过程中,每转移1 mol电子放出的热量为
,该反应过程中,每转移1 mol电子放出的热量为(2)键能可用于估算化学反应的反应热。已知白磷的燃烧热
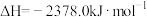 ,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
,白磷完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,其中X=
| 化学键 | P-P | P-O | O=O | P=O |
键能/( ) ) | X | 335 | 498 | 470 |
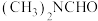 转化为
转化为 。计算机模拟
。计算机模拟
用
 ,写出该反应的热化学方程式
,写出该反应的热化学方程式(4)处理废水中的
 可在微生物的作用下经过两步反应转化为
可在微生物的作用下经过两步反应转化为 ,两步反应的能量变化如图所示:
,两步反应的能量变化如图所示:
则1 mol
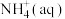 被氧化成
被氧化成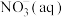 的热化学方程式是
的热化学方程式是(5)已知25℃和101 kPa下:
①
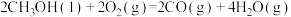
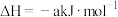
②

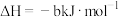
③
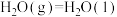

则表示
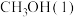 燃烧热的热化学方程式为
燃烧热的热化学方程式为
您最近一年使用:0次
4 . I. 已知:H2O2可看作二元弱酸。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式________________ 。
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:___________ △H <0 快反应
(3)能正确表示I-催化H2O2分解原理的示意图为______ 。

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应
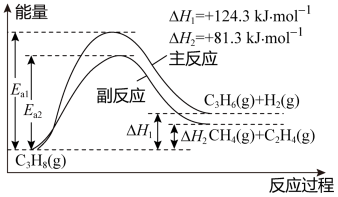
已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =______ kJ·mol-1。
副反应丙烷裂解制乙烯的过程中,其原子利用率为_______ (保留三位有效数字)。
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:
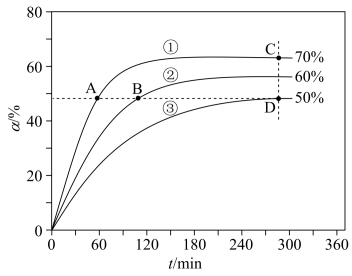
①A、B、D三点中,k正/k逆 值最大的是_________ ,
②A、B、C、D四点中,v逆 最大的是_________ 。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:
(3)能正确表示I-催化H2O2分解原理的示意图为

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应

已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =
| H2 | CH4 | C2H4 | |
| △H /kJ·mol—1 | -285.8 | -890.3 | -1411.0 |
副反应丙烷裂解制乙烯的过程中,其原子利用率为
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:

①A、B、D三点中,k正/k逆 值最大的是
②A、B、C、D四点中,v逆 最大的是
您最近一年使用:0次
2021-10-21更新
|
599次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期第一次月考化学试题
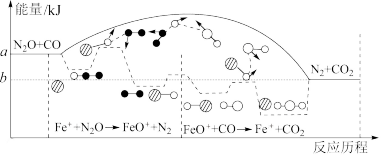
5 . 研究表明 与
与 在
在 存在下发生反应,反应的能量变化与反应进程的关系如图所示,设
存在下发生反应,反应的能量变化与反应进程的关系如图所示,设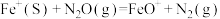
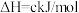 ,下列说法错误的是
,下列说法错误的是
 与
与 在
在 存在下发生反应,反应的能量变化与反应进程的关系如图所示,设
存在下发生反应,反应的能量变化与反应进程的关系如图所示,设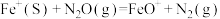
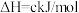 ,下列说法错误的是
,下列说法错误的是
A.  |
B. 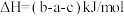 |
C.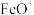 能降低该反应的活化能 能降低该反应的活化能 |
| D.反应物总键能小于生成物总键能 |
您最近一年使用:0次
6 . 大气污染是中国第一大环境污染问题,氮和硫的氧化物排放是造成大气污染的原因之一,研究它们的反应机理,对于消除环境污染有重要意义。
(1)汽车尾气中的 由如下反应产生:
由如下反应产生:

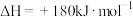
已知:
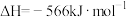
则

___________ 
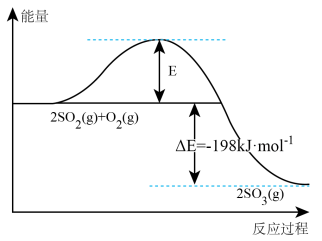
(2) 反应过程中能量变化如图所示。在
反应过程中能量变化如图所示。在 存在时,该反应的机理为:
存在时,该反应的机理为:
第一步: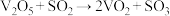 (快) 第二步:
(快) 第二步: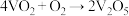 (慢)
(慢)
下列说法正确的是___________(填序号)。
(3) 在一定条件下可发生分解反应:
在一定条件下可发生分解反应: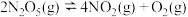 ,某温度下向恒容密闭容器中加入一定量
,某温度下向恒容密闭容器中加入一定量 ,测得
,测得 浓度随时间的变化如表所示:
浓度随时间的变化如表所示:
①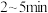 内用
内用 表示的该反应的平均反应速率为
表示的该反应的平均反应速率为___________ 。
②一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是___________ 。
A. 和
和 的浓度比保持不变 B.容器中压强不再变化
的浓度比保持不变 B.容器中压强不再变化
C.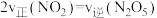 D.气体的密度保持不变
D.气体的密度保持不变
(4)某小组研究某恒容密闭容器中,在不同温度下,氮硫的氧化物之间的转化情况如图所示,已知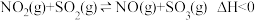 ,实验初始时体系中的
,实验初始时体系中的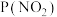 和
和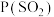 相等、
相等、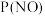 和
和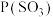 相等,其中P表示各气体的分压。
相等,其中P表示各气体的分压。
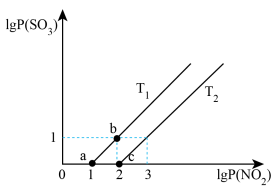
①
___________  (填“>”“<”或者“=”);温度为
(填“>”“<”或者“=”);温度为 时化学平衡常数
时化学平衡常数
___________ 。
②由平衡状态a到b,改变的条件是___________ 。
(1)汽车尾气中的
 由如下反应产生:
由如下反应产生:
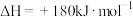
已知:

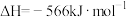
则



(2)
 反应过程中能量变化如图所示。在
反应过程中能量变化如图所示。在 存在时,该反应的机理为:
存在时,该反应的机理为:第一步:
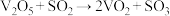 (快) 第二步:
(快) 第二步: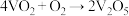 (慢)
(慢)下列说法正确的是___________(填序号)。

| A.反应速率主要取决于第一步 | B. 是该反应的催化剂 是该反应的催化剂 |
C.逆反应的活化能大于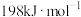 | D.增大 的浓度可显著提高反应速率 的浓度可显著提高反应速率 |
 在一定条件下可发生分解反应:
在一定条件下可发生分解反应: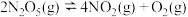 ,某温度下向恒容密闭容器中加入一定量
,某温度下向恒容密闭容器中加入一定量 ,测得
,测得 浓度随时间的变化如表所示:
浓度随时间的变化如表所示: | 0 | 1 | 2 | 3 | 4 | 5 |
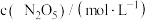 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①
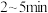 内用
内用 表示的该反应的平均反应速率为
表示的该反应的平均反应速率为②一定温度下,在恒容密闭容器中充入一定量
 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是A.
 和
和 的浓度比保持不变 B.容器中压强不再变化
的浓度比保持不变 B.容器中压强不再变化C.
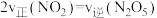 D.气体的密度保持不变
D.气体的密度保持不变(4)某小组研究某恒容密闭容器中,在不同温度下,氮硫的氧化物之间的转化情况如图所示,已知
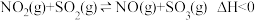 ,实验初始时体系中的
,实验初始时体系中的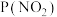 和
和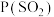 相等、
相等、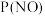 和
和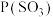 相等,其中P表示各气体的分压。
相等,其中P表示各气体的分压。
①

 (填“>”“<”或者“=”);温度为
(填“>”“<”或者“=”);温度为 时化学平衡常数
时化学平衡常数
②由平衡状态a到b,改变的条件是
您最近一年使用:0次
2021-10-11更新
|
395次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题
名校
7 . CO2储量大,是常见的温室效应气体,其综合利用意义深远。
CO2与H2制CH3OH可能发生如下反应:
(i)CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41.1kJ·mol-1
(ii)CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-162kJ·mol-1
(iii)CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
(iv)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H4
(1)反应(iv)自发进行的条件是:___ 。
(2)科学研究工作者研究了不同外界条件与CH3OH产率或不同产物选择性的关系,如图所示。
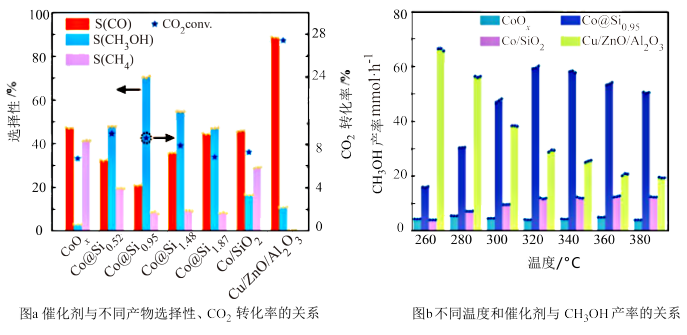
由上述可知,合适的催化剂及其适宜温度分别为___ 、___ 。
(3)以铜基催化剂催化CO2加氢制甲醇可能的反应历程存在如下步骤(*表示催化剂的活性中心,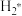 表示H2在催化剂表面的吸附态):
表示H2在催化剂表面的吸附态):
①H2(g)+*→H2*②H2*+*→2H*③CO2(g)+*→CO2*④CO2*+H*→HCO2*⑤HCO2*+H*→H2CO*+O*⑥____⑦H3CO*+H*→CH3OH*+*⑧CH3OH*→CH3OH(g)+*⑨O*+H*→OH*+*⑩OH*+H*→H2O*+*
请写出步骤⑥的化学方程式为___ 。
反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是:
CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是: ___ 。
A.混合气体的密度不变
B.甲醇的体积分数不变
C.相同时间内二氧化碳的消耗速率等于甲醇的生成速率
D.反应体系的温度不再变化
(4)恒温恒压下发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有
CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有___ 。
(5)200℃时,将0.200molCO2和0.400molH2充入压强恒定为P的密闭容器中,发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=
CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=___ 。平衡时,保持压强P恒定不变,再向体系里充入0.200molCO2和0.100mol水蒸气,反应向___ 方向进行。(选填“正反应,逆反应,保持平衡”)
CO2与H2制CH3OH可能发生如下反应:
(i)CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41.1kJ·mol-1
(ii)CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-162kJ·mol-1
(iii)CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
(iv)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H4
(1)反应(iv)自发进行的条件是:
| A.低温自发 | B.高温自发 |
| C.任何条件都能自发 | D.任何条件都不能自发 |

由上述可知,合适的催化剂及其适宜温度分别为
(3)以铜基催化剂催化CO2加氢制甲醇可能的反应历程存在如下步骤(*表示催化剂的活性中心,
 表示H2在催化剂表面的吸附态):
表示H2在催化剂表面的吸附态):①H2(g)+*→H2*②H2*+*→2H*③CO2(g)+*→CO2*④CO2*+H*→HCO2*⑤HCO2*+H*→H2CO*+O*⑥____⑦H3CO*+H*→CH3OH*+*⑧CH3OH*→CH3OH(g)+*⑨O*+H*→OH*+*⑩OH*+H*→H2O*+*
请写出步骤⑥的化学方程式为
反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是:
CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是: A.混合气体的密度不变
B.甲醇的体积分数不变
C.相同时间内二氧化碳的消耗速率等于甲醇的生成速率
D.反应体系的温度不再变化
(4)恒温恒压下发生CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有
CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有| A.向体系中通入CO2 |
| B.移走甲醇 |
| C.移走H2O(g) |
| D.与初始投料等物质的量的通入CO2、H2 |
 CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=
CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
8 . 氯气是一种重要的化工原料。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4.已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+175.4kJ·mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g) ΔH2=-220.9kJ·mol-1;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______ 。结合数据说明 氯化过程中加碳的理由_______ 。
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O2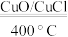 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是_______
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n(HCl):n(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是_______ 。
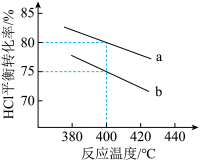
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1_______ 0(填”>”、“=”或“<”)。
②平衡常数K2的表达式为K2=_______ 。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=_______ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol·L-1,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是___。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4.已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+175.4kJ·mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g) ΔH2=-220.9kJ·mol-1;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n(HCl):n(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是

a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1
②平衡常数K2的表达式为K2=
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol·L-1,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是___。
| A.适当提高反应温度 | B.改变催化剂 |
| C.适当降低反应温度 | D.改变反应物浓度 |
您最近一年使用:0次
9 . 丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。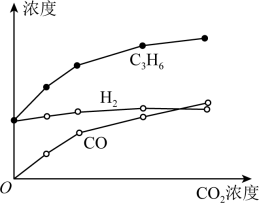
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
| A.C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol |
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O CO+H2O |
| C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大 |
| D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6) |
您最近一年使用:0次
2021-09-03更新
|
7988次组卷
|
24卷引用:黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题
黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题2021年新高考北京化学高考真题山东省实验中学2022届高三第一次诊断考试化学试题山东省潍坊市第四中学2021-2022学年高二上学期10月检测化学试卷2021年北京高考化学试题变式题11-19山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)微专题38 新情景下的综合图象与突破-备战2023年高考化学一轮复习考点微专题(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题河北省昌黎第一中学2023届高三下学期开学考试化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)章末综合评价(七)北京市第一○一中学2023-2024学年高二上学期期中练习化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题(已下线)选择题16-20北京市第一六一中学2023-2024学年高二上学期期中阶段练习化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 (已下线)北京市第四中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期 期中化学试卷2024届河北省部分高中高三下学期三模化学试题
名校
10 . 按要求书写下列方程式:
(1)制备粗硅的化学方程式___________ 。
(2)碱性锌锰干电池的正极反应式___________ 。
(3)用氢氧化钠溶液处理NO2尾气的化学方程式___________ 。
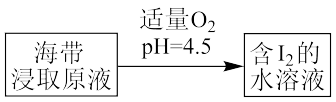
(4)海带提取碘下图所示步骤中反应的离子方程式___________ 。
(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式___________ 。
(1)制备粗硅的化学方程式
(2)碱性锌锰干电池的正极反应式
(3)用氢氧化钠溶液处理NO2尾气的化学方程式
(4)海带提取碘下图所示步骤中反应的离子方程式

(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式
您最近一年使用:0次



