1 . I.钛(Ti)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由金红石(TiO2)制取单质Ti的步骤如下:
TiO2→TiCl4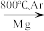 Ti
Ti
已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=_______
(2)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是_______
Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
(3)依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ (结果保留一位小数)。如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的中和热数值将_______ (填“偏大”、“偏小”或“不变”)。
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
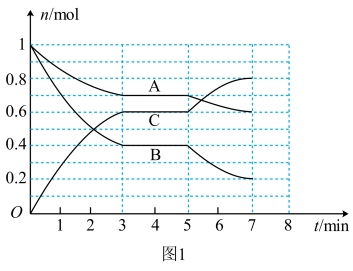
(4)根据图1数据,写出该反应的化学方程式:_______ 。此反应的平衡常数表达式K=_______ 。
(5)在5~7min内,若K不变,则此处曲线变化的原因是_______ 。
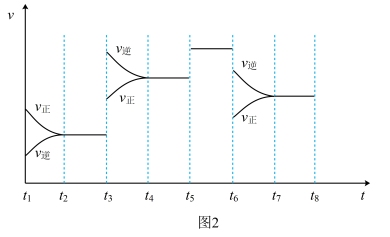
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为_______ (用“>”、“<”或“=”连接)
TiO2→TiCl4
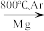 Ti
Ti已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=
(2)反应TiCl4+2Mg
 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

(4)根据图1数据,写出该反应的化学方程式:
(5)在5~7min内,若K不变,则此处曲线变化的原因是
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为

| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
您最近一年使用:0次
解题方法
2 . “绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
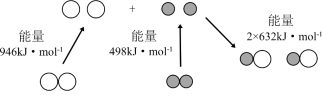
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会_______ (填“吸收”或“放出”)_______ kJ能量。
②一种新型催化剂用于NO和CO的反应:NO+2CO2 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
前2 s内的平均反应速率v(N2)=_______ 。(保留小数点后一位)
③在容积固定的绝热容器中发生反应2NO+2CO 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是_______ (填标号)
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:_______
_______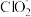 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______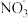 +______________。
+______________。
②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:_______
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。
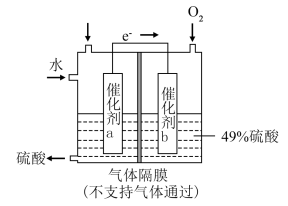
催化剂a表面的电极反应式为_______ 。若得到的硫酸质量分数仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为_______ 。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会

②一种新型催化剂用于NO和CO的反应:NO+2CO2
 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4 mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
| c(CO)/(10-3 mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2 s内的平均反应速率v(N2)=
③在容积固定的绝热容器中发生反应2NO+2CO
 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:
_______
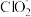 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______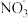 +______________。
+______________。②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。

催化剂a表面的电极反应式为
您最近一年使用:0次



