名校
解题方法
1 . 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。下列说法正确的是
已知:①
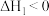
②
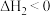
③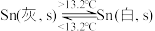
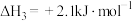
已知:①

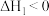
②

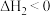
③
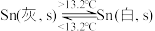
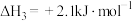
A.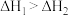 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
D.锡制器皿长期处在低于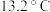 的环境中,会自行毁坏 的环境中,会自行毁坏 |
您最近一年使用:0次
2023-12-18更新
|
84次组卷
|
89卷引用:河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题
河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题河北省张家口市宣化第一中学2020-2021学年高二上学期1月月考化学试题吉林省长春市十一高中2020-2021学年高一下学期第三学程考试化学试题河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题河北省石家庄市第二中学2021-2022学年高一下学期期中考试化学试题河北省石家庄卓越中学2023-2024学年高一下学期期中考试化学试题(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2013-2014黑龙江省哈六中学高一下学期期中考试化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第一节 化学反应与能量变化 (第2课时 热化学方程式 中和热的测定)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.2 热化学方程式-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题内蒙古赤峰市第二中学2021-2022学年高二上学期第一次月考化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题四川省遂宁市射洪中学校2021—2022学年高二上学期第三次(12月)月考化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题广东仲元中学2021-2022学年高二上学期开学检测 化学试题福建省平潭翰英中学2021-2022学年高二上学期第一次月考(选考)化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷(已下线)2014-2015学年广东东莞市第七中学高二上学期第一次月考化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年山东寿光中学高二上10月月考化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷云南省姚安县第一中学2017-2018学年高二10月月考化学试题江西省南康中学2017-2018学年高二上学期第一次月考化学试题浙江省嘉兴市第一中学2017-2018学年高二上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期11月考试化学试题(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】【全国校级联考】浙江省金华市十校2017-2018学年高二下学期期末联考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题浙江省宁波市北仑中学2018-2019学年高二上学期期初返校考试化学试题云南省曲靖市会泽县一中2018-2019学年高二上学期第一次半月考化学试题安徽省芜湖市顶峰美术学校2018-2019学年高二上学期第一次月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题吉林省白城市通榆县第一中学2019-2020学年高二上学期第一次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高二10月月考化学试题福建2020届高三化学总复习专题训练——选修四化学反应原理测试福建省泉州第十六中学2019-2020学年高二10月份月考化学试题湖南省长沙市第一中学2019-2020学年高二上学期第一次月考化学试题四川省乐山市2019-2020学年高二上学期期末教学质量检测化学试题海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题江西省赣州市南康区南康中学2020-2021学年高二上学期第三次大考化学试题江西省九江一中2020-2021学年高二上学期月考化学试题江西省六校2021-2022学年高二上学期期末联考化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题河南省豫西顶级名校2021-2022学年高二下学期4月联考化学试题第二节 反应热的计算 第1课时 盖斯定律(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)1.2 反应热的计算-同步学习必备知识江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题河南省通许县一中2022—2023年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题陕西省安康市2022-2023学年高二上学期11月期中化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题安徽省马鞍山市第二十二中学2022-2023学年高二上学期阶段检测化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题广东华侨中学2022-2023学年高二上学期期中考试化学试题作业(三) 反应热的计算作业(三) 反应焓变的计算河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题广东省广州市越秀区第七中学2023-2024学年高二上学期10月月考化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期开学化学试题山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题黑龙江省方正县高楞高级中学校2023-2024学年高二上学期期中化学试题
名校
解题方法
2 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
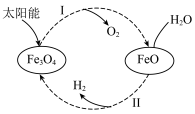
| A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子 |
| B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2023-09-19更新
|
359次组卷
|
25卷引用:河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题
河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题10-2020年北京新高考化学模拟试题(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节综合训练高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式(已下线)章末综合评价(六)
名校
解题方法
3 . 用化学术语回答下列问题:
(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出氢气与氧气反应生成水蒸气的热化学方程式:_______ 。若1mol水蒸气转化成液态水放热44kJ,则反应2H2(g)+O2(g)=2H2O(l)的△H=_______ kJ·mol-1。
(2)电解CuSO4溶液阴极电极反应式(惰性电极)_______ 。
(3)电解NaCl溶液阳极电极反应式(惰性电极)_______ 。
(4)防止铁被腐蚀的防护方法有_______ 。(填字母)
A.铁表层涂沥青 B.隔绝空气 C.制成不锈钢
(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出氢气与氧气反应生成水蒸气的热化学方程式:
(2)电解CuSO4溶液阴极电极反应式(惰性电极)
(3)电解NaCl溶液阳极电极反应式(惰性电极)
(4)防止铁被腐蚀的防护方法有
A.铁表层涂沥青 B.隔绝空气 C.制成不锈钢
您最近一年使用:0次
名校
解题方法
4 . 已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-24.8kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47.19kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-24.8kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47.19kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
| A.-218kJ·mol-1 | B.-109kJ·mol-1 | C.109kJ·mol-1 | D.218kJ·mol-1 |
您最近一年使用:0次
2022-07-22更新
|
907次组卷
|
45卷引用:河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题
河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题2014-2015学年河北省正定中学高一下第三次月考化学试卷广东省揭阳第一中学2016-2017学年高一下学期第二次阶段考试化学科试题湖北省黄冈市黄梅国际育才高级中学2018-2019学年高一下学期5月月考化学试题(已下线)作业02 反应热的计算-2021年高二化学暑假作业(人教版2019)(已下线)1.3 化学反应热的计算-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)1.1.2 反应热的测量与计算-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)安徽省滁州九校2021-2022学年高二上学期期中考试化学试题(已下线)2013届湖北省孝感高中高三9月调研考试化学试卷(已下线)2013-2014学年内蒙古赤峰市元宝山区高二上学期期末化学试卷(已下线)2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学(已下线)2013届湖北省孝感高中高三9月调研考试化学试卷2014-2015学年福建省清流一中高二上学期月考化学理试卷2016届吉林省长春市第十一高中高三上学期期中测试化学试卷2016届湖南长沙市长郡中学三上学期第四次月考化学试卷2016-2017学年湖南省衡阳一中高二上10月月考化学卷2016-2017学年广东佛山一中高二上第一次段考化学卷2016-2017学年山西省大同一中高二12月月考化学试卷甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题内蒙古杭锦后旗奋斗中学2018届高三上学期第二次月考化学试题甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题(已下线)2019年4月8日 《每日一题》三轮复习——反应热的计算与盖斯定律云南省麒麟高中2018-2019学年高二6月考试化学试题黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2018-2019高二12月月考化学试题四川省威远中学2019-2020学年高二上学期第二次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019-2020学年高二10月月考化学试题辽宁省沈阳市辽宁省实验中学2020届高三上学期期中考试化学试题辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 高效手册四川省新津中学2020-2021学年高二10月月考化学试题江西省南昌市八一中学2020-2021学年高二上学期10月考试化学试题四川省叙州区第二中学2020-2021学年高二上第二学月考试化学试题(已下线)第1章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.2.2 化学反应焓变的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)河南省平顶山市名校联盟2022-2023学年高二上学期开学考试化学试题山东省聊城市第二中学2022-2023学年高二上学期开学考试化学试题(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)四川省德阳市第五中学2022-2023学年高二上学期开学考试化学试题湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题湖北省十堰市县区普通高中联合体2022-2023学年高二上学期11月期中联考化学试题河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题
解题方法
5 . 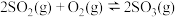 为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:
(1)已知该反应在反应过程中体系温度会升高,且每摩尔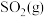 、
、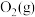 、
、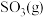 所含化学能分别为
所含化学能分别为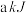 、
、 、
、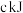 ,则每有
,则每有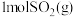 参与反应时,
参与反应时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(2)一定温度下,向体积为2L的刚性密闭容器中充入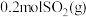 和
和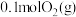 ,发生反应:
,发生反应: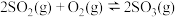 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如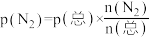 。
。
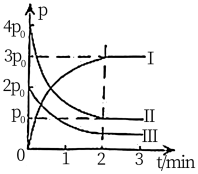
①图中表示 分压变化的曲线为
分压变化的曲线为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”);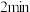 时,
时, 的转化率为
的转化率为_______ 。
② 内,用
内,用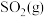 表示该反应的速率为
表示该反应的速率为_______  。
。
③能说明上述反应已达到平衡状态的是_______ (填选项字母)。
a.容器内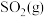 、
、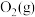 的物质的量浓度之比为
的物质的量浓度之比为
b.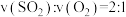
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
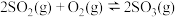 为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:(1)已知该反应在反应过程中体系温度会升高,且每摩尔
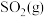 、
、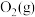 、
、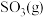 所含化学能分别为
所含化学能分别为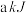 、
、 、
、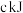 ,则每有
,则每有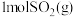 参与反应时,
参与反应时, 。
。(2)一定温度下,向体积为2L的刚性密闭容器中充入
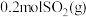 和
和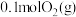 ,发生反应:
,发生反应: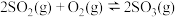 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如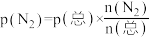 。
。
①图中表示
 分压变化的曲线为
分压变化的曲线为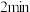 时,
时, 的转化率为
的转化率为②
 内,用
内,用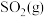 表示该反应的速率为
表示该反应的速率为 。
。③能说明上述反应已达到平衡状态的是
a.容器内
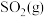 、
、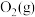 的物质的量浓度之比为
的物质的量浓度之比为
b.
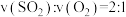
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
您最近一年使用:0次
解题方法
6 .  、
、 、
、 等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)二甲醚( )被誉为“21世纪的清洁燃料”,由
)被誉为“21世纪的清洁燃料”,由 和
和 制备二甲醚的反应原理如下:
制备二甲醚的反应原理如下:
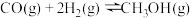

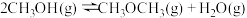
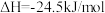
已知: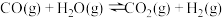
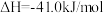
则 的
的
_______ 。
(2)200℃,在2L的密闭容器中充入
 和
和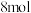
 ,发生反应
,发生反应 (I);
(I); (II),
(II), 达到平衡,平衡时
达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则:
,则:
① 内,反应(Ⅰ)平均反应速率
内,反应(Ⅰ)平均反应速率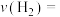
_______ 。
②反应(Ⅱ)中 的转化率
的转化率
_______ 。
(3)利用电化学原理将 、
、 转化为重要化工原料,装置如图所示:
转化为重要化工原料,装置如图所示:

①若A为 ,B为
,B为 ,C为
,C为 ,则通入
,则通入 一极的电极反应式为
一极的电极反应式为_______ 。
②若A为 ,B为
,B为 ,C为
,C为 ,则负极的电极反应式为
,则负极的电极反应式为_______ 。
 、
、 、
、 等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。(1)二甲醚(
 )被誉为“21世纪的清洁燃料”,由
)被誉为“21世纪的清洁燃料”,由 和
和 制备二甲醚的反应原理如下:
制备二甲醚的反应原理如下: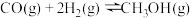

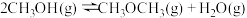
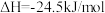
已知:
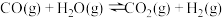
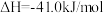
则
 的
的
(2)200℃,在2L的密闭容器中充入

 和
和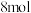
 ,发生反应
,发生反应 (I);
(I); (II),
(II), 达到平衡,平衡时
达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则:
,则:①
 内,反应(Ⅰ)平均反应速率
内,反应(Ⅰ)平均反应速率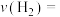
②反应(Ⅱ)中
 的转化率
的转化率
(3)利用电化学原理将
 、
、 转化为重要化工原料,装置如图所示:
转化为重要化工原料,装置如图所示:
①若A为
 ,B为
,B为 ,C为
,C为 ,则通入
,则通入 一极的电极反应式为
一极的电极反应式为②若A为
 ,B为
,B为 ,C为
,C为 ,则负极的电极反应式为
,则负极的电极反应式为
您最近一年使用:0次
解题方法
7 . (1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇
I:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0kJ·mol-1
II:CO(g)+2H2(g) CH3OH(g) ΔH=-129.0kJ·mol-1
CH3OH(g) ΔH=-129.0kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___ 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图1装置实现上述过程:
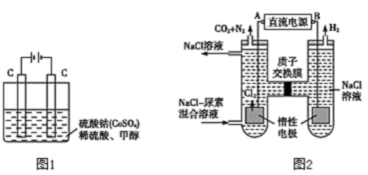
①写出阳极电极反应式___ 。
②写出除去甲醇的离子方程式:___ 。
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素CO(NH2)2,其原理如图2。
①电源的正极为___ (填“A”或“B”)。
②阳极室中发生的反应依次为___ 、___ 。
③电解结束后,阴极室溶液的pH与电解前相比___ (“变大”“变小”或“不变”)。
I:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.0kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0kJ·mol-1II:CO(g)+2H2(g)
 CH3OH(g) ΔH=-129.0kJ·mol-1
CH3OH(g) ΔH=-129.0kJ·mol-1CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图1装置实现上述过程:

①写出阳极电极反应式
②写出除去甲醇的离子方程式:
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素CO(NH2)2,其原理如图2。
①电源的正极为
②阳极室中发生的反应依次为
③电解结束后,阴极室溶液的pH与电解前相比
您最近一年使用:0次
8 . 全球大气CO2浓度升高对人类生活产生了影响,CO2的捕集和资源化利用成为研究热点。
(1)CO2能引起海水酸化,原理为___ (用化学方程式表示),因此CO2过量排放对海洋生态系统会造成严重影响。
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___ 。
A.K2CO3 B.CaO C.NH3. D.NH4Cl
(3)CO2甲烷化是实现其资源化利用的有效方式之一。
I.热化学转化法:工业上常用CO2催化加氢合成CH4。
已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH1=-41kJ·mol-1
H2(g)+CO2(g) ΔH1=-41kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH2=-73kJ·mol-1
CH4(g) ΔH2=-73kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1
反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=___ kJ·mol-1
在该工业生产中,选用了高活性的Ni基催化剂,目的是:___ 。
II.电化学转化法:多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。
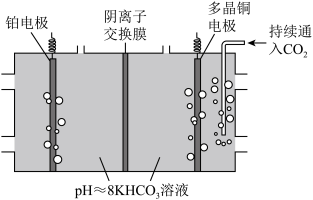
①多晶铜连接电源的___ 极。(填“正”或“负”)
②阳极氧化产物只有O2。电解时实际生成CH4的总最小于由O2理论计算所得CH4的量,结合电极反应式解释原因:___ 。
(1)CO2能引起海水酸化,原理为
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是
A.K2CO3 B.CaO C.NH3. D.NH4Cl
(3)CO2甲烷化是实现其资源化利用的有效方式之一。
I.热化学转化法:工业上常用CO2催化加氢合成CH4。
已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH1=-41kJ·mol-1
H2(g)+CO2(g) ΔH1=-41kJ·mol-1②C(s)+2H2(g)
 CH4(g) ΔH2=-73kJ·mol-1
CH4(g) ΔH2=-73kJ·mol-1③2CO(g)
 C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=在该工业生产中,选用了高活性的Ni基催化剂,目的是:
II.电化学转化法:多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。

①多晶铜连接电源的
②阳极氧化产物只有O2。电解时实际生成CH4的总最小于由O2理论计算所得CH4的量,结合电极反应式解释原因:
您最近一年使用:0次
9 . 已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别是393.5kJ·mol-1、285.8kJ·mol-1和870.3kJ·mol-1(注:CH3COOH的燃烧产物是CO2和H2O,则反应2C(g)+2H2+O2(g)=CH3COOH(l)的ΔH为
| A.-488.3kJ·mol-1 | B.-762.6kJ·mol-1 |
| C.-654.9kJ·mol-1 | D.+191kJ·mol-1 |
您最近一年使用:0次
10 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
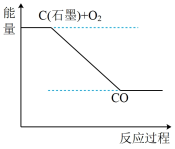 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次



