名校
1 . 单斜硫和正交硫是硫的两种同素异形体,下列说法不正确的是


| A.正交硫比单斜硫稳定 |
| B.S(s,单间) =S(s,正交) △H3=-0.33 kJ/mol |
| C.相同物质的量的正交硫比单斜疏所含的能量高 |
| D.由②可知断裂l molO2和1 mol正交硫中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多296.83 kJ |
您最近一年使用:0次
2 . 为了探究碳酸钠、碳酸氢钠与盐酸反应是吸热反应还是放热反应。某化学兴趣小组同学进行了下列实验(每项实验各做三次平行实验,取平均值)。
(1)NaHCO3固体溶于水是_______ (填“吸热”“放热”)过程;NaHCO3溶液与盐酸反应是_______ (填“吸热”“放热”)反应。
(2)Na2CO3固体溶于水是_______ (填“吸热”“放热”)过程;Na2CO3溶液与盐酸反应是_______ (填“吸热”“放热”)反应。
(3)设计a、b组实验的目的是_______ 。
(4)判断CO (aq)+H+(aq)=HCO
(aq)+H+(aq)=HCO (aq) ∆H
(aq) ∆H_______ 0。
| 序号 | 试剂(35mL) | 固态物质及质量 | 混合前温度/℃ | 混合后温度/℃ |
| a | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| b | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| c | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| d | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
(2)Na2CO3固体溶于水是
(3)设计a、b组实验的目的是
(4)判断CO
 (aq)+H+(aq)=HCO
(aq)+H+(aq)=HCO (aq) ∆H
(aq) ∆H
您最近一年使用:0次
3 . Ⅰ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=__ kJ/mol。
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是___ 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__ 。
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
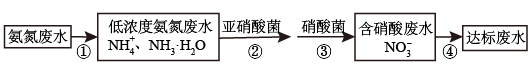
(4)检验某溶液中是否含有NH 的方法
的方法___ (写出所需试剂、操作及现象)。
(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被___ L(标准状况)O2最终氧化成NO 。
。
(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式___ 。

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH
 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
(4)检验某溶液中是否含有NH
 的方法
的方法(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH
 →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被 。
。(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式
您最近一年使用:0次
名校
解题方法
4 . (1)在25 ℃、101 kPa的条件下,
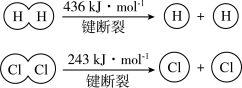
请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________ (填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________ 243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________ kJ。
③有两个反应:a.H2(g)+Cl2(g) 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________ (填“相等”或“不相等”)。
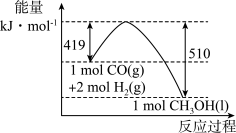
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________ (填“吸收”或“放出”)________ kJ能量。

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是
③有两个反应:a.H2(g)+Cl2(g)
 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)
您最近一年使用:0次
2020-04-15更新
|
761次组卷
|
5卷引用:河北省张家口宣化一中2020-2021学年高一下学期4月月考化学试题
名校
解题方法
5 . 已知:①Zn(s)+ O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+ O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
 O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+ O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )| A.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=+317.3kJ·mol-1 |
| B.Zn+Ag2O=ZnO+2Ag ΔH=+317.3kJ·mol-1 |
| C.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=-379.3kJ·mol-1 |
| D.2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH=-634.6 kJ·mol-1 |
您最近一年使用:0次
2019-12-18更新
|
135次组卷
|
3卷引用:河北省衡水市第十四中学2020-2021学年高一下学期期末考试化学试题
6 . 常温下,已知:铝热反应放热,①4Al(s)+3O2(g)=2Al2O3(s) ∆H1②4Fe(s)+3O2(g)=2Fe2O3(s) ∆H2 下面关于 ∆H1、∆H2 的比较正确的是
| A.∆H1<∆H2 | B.∆H1=∆H2 | C.∆H1>∆H2 | D.无法判断 |
您最近一年使用:0次
2017-12-30更新
|
327次组卷
|
9卷引用:河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题
河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)2014届辽宁省实验中学分校高一下学期阶段性测试化学试卷 (已下线)2012-2013学年福建龙岩一中高二上第一学段模块考试化学试卷(已下线)2014年高中化学人教版选修四第一章 化学反应与能量练习卷2015-2016学年重庆市杨家坪中学高二上学期第一次月考化学试卷2016-2017学年云南省曲靖一中高二上期中化学试卷江西省抚州市临川实验学校2017-2018学年高二上学期第一次月考化学试题河南省南阳市省示范性高中联谊学校2017-2018学年高二上学期第二次月考化学试题内蒙古翁牛特旗乌丹第二中学2019-2020学年高二上学期期中考试化学试题



