1 . NO2和N2O4是氮的两种重要氧化物。回答下列问题:
Ⅰ.已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) △H1=180.5 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) △H3=10.7 kJ·mol-1
(1)写出N2O4(g)转化为NO2(g)的热化学方程式:_______ 。
Ⅱ.298K时,在2 L的恒容绝热密闭容器中发生反应:N2O4(g) 2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
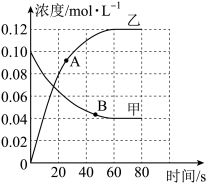
(2)代表NO2气体浓度随时间变化的曲线为_______ (填“甲”或“乙”)。
(3)当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表达该反应的平均速率为_______ 。
(4)A、B两点对应时刻,反应速率大小:vA_______ vB(填“>”“<”或“=”)。
(5)不能说明该反应达到平衡状态的是_______ (填序号)。
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
(6)化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g)+bB(g) pC(g)+qD(g) K=
pC(g)+qD(g) K=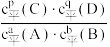 ,计算298K时,反应N2O4(g)
,计算298K时,反应N2O4(g)  2NO2(g)的平衡常数K=
2NO2(g)的平衡常数K=_______ 。
Ⅰ.已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) △H1=180.5 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) △H3=10.7 kJ·mol-1
(1)写出N2O4(g)转化为NO2(g)的热化学方程式:
Ⅱ.298K时,在2 L的恒容绝热密闭容器中发生反应:N2O4(g)
 2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
(2)代表NO2气体浓度随时间变化的曲线为
(3)当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表达该反应的平均速率为
(4)A、B两点对应时刻,反应速率大小:vA
(5)不能说明该反应达到平衡状态的是
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
(6)化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g)+bB(g)
 pC(g)+qD(g) K=
pC(g)+qD(g) K=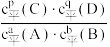 ,计算298K时,反应N2O4(g)
,计算298K时,反应N2O4(g)  2NO2(g)的平衡常数K=
2NO2(g)的平衡常数K=
您最近一年使用:0次
2022-09-14更新
|
425次组卷
|
3卷引用:山东省诸城市2020-2021学年高一下学期期末考试化学试题
2 . 氢气因燃值高、燃烧产物无污染,被公认为清洁能源。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①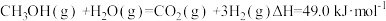
②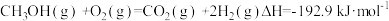
又知:③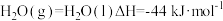
则表示甲醇摩尔燃烧焓的热化学方程式为___________
(3)已知1molH2 完全燃烧生成H2O(g) ,放出 245kJ 能量。根据下列信息,计算a____ 。
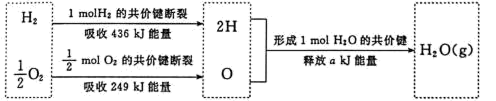
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。
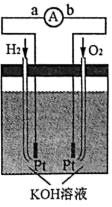
①在导线中电子流动方向为___________ (用 a、b 表示)。
②电极表面镀一层细小的铂粉,其目的是___________ 。
③该电池的负极反应式为H2 2e 2OH 2H2O,请写出正极反应式___________ 。
④假设该电池每发 1 度电(1 度 3.6 106 J )能生成 450g 水蒸气,则该电池的能量转化率为___________ (保留小数点后一位)。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①
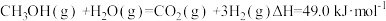
②
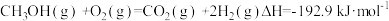
又知:③
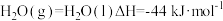
则表示甲醇摩尔燃烧焓的热化学方程式为
(3)已知1molH2 完全燃烧生成H2O(g) ,放出 245kJ 能量。根据下列信息,计算a

(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。

①在导线中电子流动方向为
②电极表面镀一层细小的铂粉,其目的是
③该电池的负极反应式为H2 2e 2OH 2H2O,请写出正极反应式
④假设该电池每发 1 度电(1 度 3.6 106 J )能生成 450g 水蒸气,则该电池的能量转化率为
您最近一年使用:0次
解题方法
3 . 大气中SO2、H2S的资源化利用具有重要意义。回答下列问题:
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为___ 。
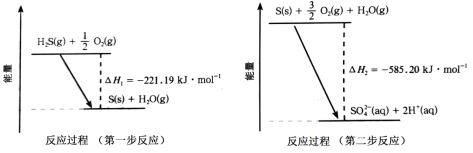
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
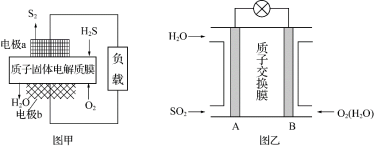
b电极为___ 极(填“正”或“负”),其电极反应式为___ 。
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为___ (填“从A到B”或“从B到A”)。
②负极的电极反应式为___ 。
③用该电池处理32gSO2,理论上需要消耗O2的体积为___ L(标准状况)。
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。

b电极为
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为
②负极的电极反应式为
③用该电池处理32gSO2,理论上需要消耗O2的体积为
您最近一年使用:0次
解题方法
4 . 联氨( )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。
①已知断开(或形成)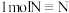 键、
键、 键分别需要吸收(或放出)
键分别需要吸收(或放出)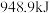 ,
, 的热量,合成
的热量,合成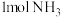 可放出
可放出 的热量,则形成
的热量,则形成 放出的热量为
放出的热量为___________  (保留一位小数)。
(保留一位小数)。
②工业上一种制备联氨的方法为 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是___________ (填写化学式)。制备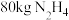 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________  。
。
(2)发射航天器时常以 为燃料,
为燃料, 为推进剂。
为推进剂。
已知
ⅰ.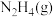 的摩尔燃烧焓为
的摩尔燃烧焓为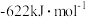 。
。
ⅱ. 与
与 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下:
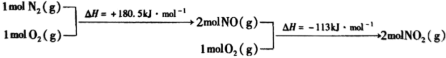
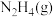 与
与 反应生成
反应生成 和
和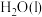 的热化学方程式为
的热化学方程式为___________ 。
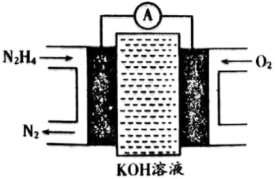
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中 的物质的量浓度
的物质的量浓度___________ (填“增大”“减小”或“不变”),负极反应式为___________ 。
 )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:(1)工业上利用
 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。①已知断开(或形成)
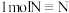 键、
键、 键分别需要吸收(或放出)
键分别需要吸收(或放出)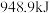 ,
, 的热量,合成
的热量,合成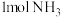 可放出
可放出 的热量,则形成
的热量,则形成 放出的热量为
放出的热量为 (保留一位小数)。
(保留一位小数)。②工业上一种制备联氨的方法为
 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是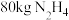 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为 。
。(2)发射航天器时常以
 为燃料,
为燃料, 为推进剂。
为推进剂。已知
ⅰ.
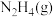 的摩尔燃烧焓为
的摩尔燃烧焓为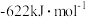 。
。ⅱ.
 与
与 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下: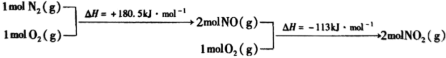
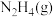 与
与 反应生成
反应生成 和
和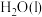 的热化学方程式为
的热化学方程式为(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次
5 . 物质的摩尔燃烧焓是指在一定温度和压强条件下,1mol物质完全氧化为同温下的指定产物时的焓变,其中物质中所含的N元素氧化为N2(g)、H元素氧化为H2O(l)、C元素氧化为CO2(g)。
已知:①几种物质的摩尔燃烧焓:
②298k,101kPa时,部分化学键键能:
③H2O(l)=H2O(g) △H=+44.0kJ/mol
回答下列问题:
(1)计算反应2CO(g)+O2(g)=2CO2(g)的焓变△H1=___________ kJ·mol-1,由此可求CO的化学键C O键能a=
O键能a=___________ kJ·mol-1。
(2)已知相同条件下,石墨比金刚石稳定,则1mol金刚石的燃烧放热___________ 393.5kJ(填“>”、“<”、“=”)。
(3)写出常温下氢气燃烧的热化学方程式___________ ,则反应CO(g)+H2O(g)=CO2(g)+H2(g)的焓变△H2=___________ kJ·mol-1。
已知:①几种物质的摩尔燃烧焓:
| 物质 | 石墨(s) | H2(g) | CO(g) |
| △H/(kJ·mol—1) | -393.5 | -285.8 | -283.0 |
②298k,101kPa时,部分化学键键能:
| 化学键 | C O O | O=O | C=O | C-O |
| E/(kJ·mol-1) | a | 498 | 745 | 351 |
③H2O(l)=H2O(g) △H=+44.0kJ/mol
回答下列问题:
(1)计算反应2CO(g)+O2(g)=2CO2(g)的焓变△H1=
 O键能a=
O键能a=(2)已知相同条件下,石墨比金刚石稳定,则1mol金刚石的燃烧放热
(3)写出常温下氢气燃烧的热化学方程式
您最近一年使用:0次
6 . 能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,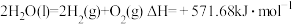 ,
,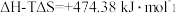 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: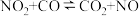
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
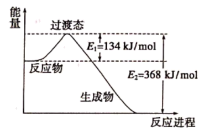
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①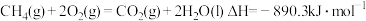
②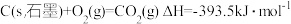
③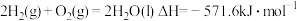
则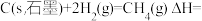
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和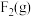 反应生成
反应生成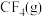 和
和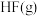 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
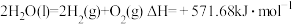 ,
,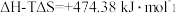 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
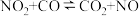
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
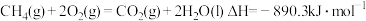
②
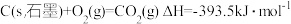
③
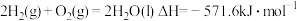
则
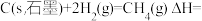
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和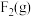 反应生成
反应生成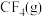 和
和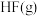 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。回答下列问题:
(1)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ∆H,已知该反应中相关化学键的键能数据如下:
则该反应的∆H=_______ kJ•mol-1。
(2)汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。已知:
①CO(g)+NO2(g)⇌CO2(g)+NO(g) ∆H1=-226kJ•rnol-1
②N2(g)+2O2(g)⇌2NO2(g) ∆H2=+68kJ•mol-1
③N2(g)+O2(g)⇌2NO(g) ∆H3=+183kJ•mol-1
则:CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______ 。
(3)CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
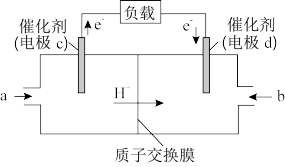
电池总反应为2CH3OH+3O2=2CO2+4H2O。则d电极是_______ (填“正极”或“负极”),c电极的电极反应式为______ 。若线路中转移2mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为_____ L。
(1)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ∆H,已知该反应中相关化学键的键能数据如下:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
则该反应的∆H=
(2)汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。已知:
①CO(g)+NO2(g)⇌CO2(g)+NO(g) ∆H1=-226kJ•rnol-1
②N2(g)+2O2(g)⇌2NO2(g) ∆H2=+68kJ•mol-1
③N2(g)+O2(g)⇌2NO(g) ∆H3=+183kJ•mol-1
则:CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是
(3)CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为2CH3OH+3O2=2CO2+4H2O。则d电极是
您最近一年使用:0次
名校
解题方法
8 . (1)有两个反应:a.H2(g)+Cl2(g)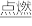 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)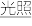 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是___ 能转化为____ 能,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量___ (填“相等”或“不相等”)。
(2)利用反应4HCl+O2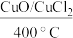 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
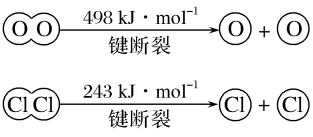
请回答下列有关问题:
①4molHCl被氧化时,放出___ kJ的热量。
②断开1molH—O键与断开1molH—Cl键所需能量相差___ kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)___ 。
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)____ (填“吸收”或“放出”)___ kJ能量。
 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)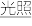 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是(2)利用反应4HCl+O2
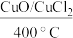 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
请回答下列有关问题:
①4molHCl被氧化时,放出
②断开1molH—O键与断开1molH—Cl键所需能量相差
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)

您最近一年使用:0次
解题方法
9 . Ⅰ.以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
已知:2Al2O3(s)=4Al(g)+3O2(g) ∆H=3351kJ·mol-1
2C(s)+O2(g)=2CO(g) ∆H=-221kJ·mol-1
2Al(g)+N2(g)=2AlN(s) ∆H=-318kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是_______ 。
II.已知化学反应:①AgNO3+NaCl=AgCl↓+NaNO3②2FeCl3+Cu=2FeCl2+CuCl2。
(1)上述两个化学反应中有一个不可用于设计原电池,它是_______ (填序号),理由是_______ 。
(2)另一个可用于设计原电池,若利用该反应设计如下图所示的原电池,请在如图方框中标明电极材料和电解质溶液的名称①_______ ②_______ ③_______ (图中“I”表示电流)。
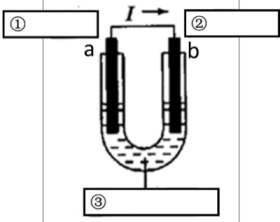
该电池电极a上发生的电极反应式是_______ ,电极b上发生_______ 反应(填“氧化”或“还原”)。
已知:2Al2O3(s)=4Al(g)+3O2(g) ∆H=3351kJ·mol-1
2C(s)+O2(g)=2CO(g) ∆H=-221kJ·mol-1
2Al(g)+N2(g)=2AlN(s) ∆H=-318kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是
II.已知化学反应:①AgNO3+NaCl=AgCl↓+NaNO3②2FeCl3+Cu=2FeCl2+CuCl2。
(1)上述两个化学反应中有一个不可用于设计原电池,它是
(2)另一个可用于设计原电池,若利用该反应设计如下图所示的原电池,请在如图方框中标明电极材料和电解质溶液的名称①

该电池电极a上发生的电极反应式是
您最近一年使用:0次
10 . H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是
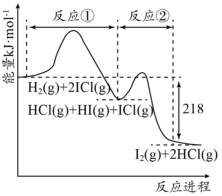

| A.反应①、反应②均为放热反应 |
| B.反应①、反应②均为氧化还原反应 |
| C.H2与ICl的总反应速率快慢取决于反应② |
| D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1 |
您最近一年使用:0次
2021-01-29更新
|
787次组卷
|
3卷引用:山东省日照市莒县2020-2021学年高一下学期期中考试化学试题



