1 . 回答下列问题:
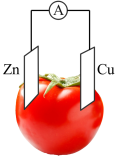
(1)反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。______ 热反应(填“吸”、“放”)。
②在反应体系中加入催化剂,反应速率增大,E3_______ ,E2_______ (填“增大”、“减小”或“不变”)。
③当反应达到平衡时,升高温度,A的转化率_______ ( 填 “增大”、“减小”或“不变” )。
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H1=a kJ•mol﹣1
CO(g)+0.5O2(g)=CO2(g) △H2=b kJ•mol﹣1
H2(g)+0.5O2(g)=H2O(l) △H3=c kJ•mol﹣1
则CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=____________ kJ•mol﹣1 (用a、b、c表示)。
(3)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。______ 0 (填“>”、“<”或“=”) ②p2_____ p1(填“>”、“<”或“=”);
(1)反应A(g)+B(g)
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。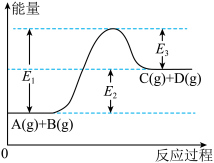
②在反应体系中加入催化剂,反应速率增大,E3
③当反应达到平衡时,升高温度,A的转化率
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H1=a kJ•mol﹣1
CO(g)+0.5O2(g)=CO2(g) △H2=b kJ•mol﹣1
H2(g)+0.5O2(g)=H2O(l) △H3=c kJ•mol﹣1
则CO(g)+2H2(g)
 CH3OH(g) △H=
CH3OH(g) △H=(3)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)
 CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。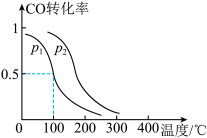
您最近一年使用:0次
解题方法
2 . I.回答下列问题。
(1)下列变化中属于吸热反应的是___________ 。
①铝片与稀盐酸的反应;②将胆矾加热变为白色粉末;③干冰汽化;④甲烷在氧气中的燃烧反应;⑤ 固体溶于水;⑥C与CO2反应生成CO
固体溶于水;⑥C与CO2反应生成CO
(2)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是___________。
(3)过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),断裂1mol H2O2(l)中的O-O键和1mol O2(g)中的O=O键所需的能量依次为142kJ、497.3kJ,断裂H2O2(l)和H2O(l)中1molH-O键所需能量依次为367 kJ、467 kJ,则2 mol H2O2(l)反应生成2 mol H2O(l)和1mol O2(g)___________ (填“吸收"或“放出”)的能量为___________ kJ。
Ⅱ.氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:___________ (填“氧化剂”或“还原剂”)。
(5)写出氧化炉中反应的化学方程式___________ 。
(6)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应;②将胆矾加热变为白色粉末;③干冰汽化;④甲烷在氧气中的燃烧反应;⑤
 固体溶于水;⑥C与CO2反应生成CO
固体溶于水;⑥C与CO2反应生成CO(2)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是___________。
A.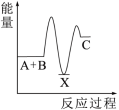 | B.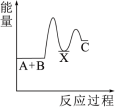 | C.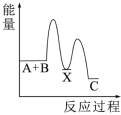 | D.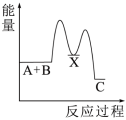 |
(3)过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),断裂1mol H2O2(l)中的O-O键和1mol O2(g)中的O=O键所需的能量依次为142kJ、497.3kJ,断裂H2O2(l)和H2O(l)中1molH-O键所需能量依次为367 kJ、467 kJ,则2 mol H2O2(l)反应生成2 mol H2O(l)和1mol O2(g)
Ⅱ.氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
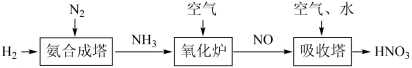
(5)写出氧化炉中反应的化学方程式
(6)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 请完成下列问题:
现代社会中,人类的一切活动都离不开能量,化学反应中不仅有新物质的生成,而且伴随着能量的变化,同时,化学电池也成为人类生产和生活的重要能量来源之一;
(1)下列反应属于放热反应的是___________ (填序号)。
①碳酸钙高温分解 ②生石灰和水的反应 ③ 在
在 中燃烧
中燃烧
(2)如图是原电池的装置图。请回答下列问题:___________ (填“正极”或“负极”),发生___________ 反应(填“氧化”或“还原”);电子由___________ 片通过导线流向___________ 片。(均填化学式)
②溶液中的 向
向___________ 片移动。(填化学式)
③Cu片上发生反应的电极反应式为___________ 。
④若Fe电极消耗5.6g,则外电路转移___________  。
。
现代社会中,人类的一切活动都离不开能量,化学反应中不仅有新物质的生成,而且伴随着能量的变化,同时,化学电池也成为人类生产和生活的重要能量来源之一;
(1)下列反应属于放热反应的是
①碳酸钙高温分解 ②生石灰和水的反应 ③
 在
在 中燃烧
中燃烧(2)如图是原电池的装置图。请回答下列问题:
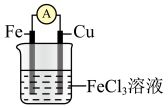
②溶液中的
 向
向③Cu片上发生反应的电极反应式为
④若Fe电极消耗5.6g,则外电路转移
 。
。
您最近一年使用:0次
4 . 水中存在电离平衡:H2O H++OH-。若在水中分别加入下列各物质:
H++OH-。若在水中分别加入下列各物质:
①NaOH(s) ②NH4Cl(s) ③Na2CO3(s) ④CH3COOH(l) ⑤K2SO4(s),试回答下列问题:
(1)能使水的电离平衡向左移动的是___________ ,不发生移动的是___________ 。(用序号填空)
(2)溶液呈酸性的是___________ ,溶液呈碱性的是___________ 。(用序号填空)
(3)能促进水的电离,且溶液pH>7的是___________ 。(用序号填空)
(4)将0.1mol CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为0.1mol/L,经测定溶液中c(CH3COO-)为1.4×10-3mol∙L-1,此温度下醋酸的电离常数Ka=___________ ,温度升高,Ka将___________ (填“变大”、“不变”或“变小”)。
(5)向 溶液中滴入酚酞试液,观察到的现象是
溶液中滴入酚酞试液,观察到的现象是___________ ,若微热溶液,观察到的现象是___________ ,由此证明碳酸钠的水解是___________ (填“吸热”或“放热”)反应。 溶液中
溶液中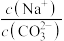
___________ 2(填“大于”或“小于”),能使其比值接近2的措施是___________ (填序号)。
①加入适量盐酸 ②加入适量NaOH固体 ③加入适量KOH固体 ④加热
 H++OH-。若在水中分别加入下列各物质:
H++OH-。若在水中分别加入下列各物质:①NaOH(s) ②NH4Cl(s) ③Na2CO3(s) ④CH3COOH(l) ⑤K2SO4(s),试回答下列问题:
(1)能使水的电离平衡向左移动的是
(2)溶液呈酸性的是
(3)能促进水的电离,且溶液pH>7的是
(4)将0.1mol CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为0.1mol/L,经测定溶液中c(CH3COO-)为1.4×10-3mol∙L-1,此温度下醋酸的电离常数Ka=
(5)向
 溶液中滴入酚酞试液,观察到的现象是
溶液中滴入酚酞试液,观察到的现象是 溶液中
溶液中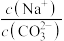
①加入适量盐酸 ②加入适量NaOH固体 ③加入适量KOH固体 ④加热
您最近一年使用:0次
5 . 下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。___________ 。
(2)该反应是___________ (填“放热”或“吸热”)反应,结合实验现象写出判断依据___________ 。
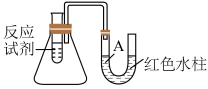
(2)该反应是
您最近一年使用:0次
2024-04-23更新
|
70次组卷
|
2卷引用:上海市松江二中2023-2024学年高一下学期期中测试 化学试卷
解题方法
6 . 根据所学知识,回答下列问题。
I.锌片与稀硫酸反应的能量变化特征如图所示:___________ 反应(填“吸热”或“放热”)。
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象是___________ 。
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
(3)该实验目的是研究水果种类和___________ 对水果电池电流大小的影响。
(4)该实验装置中,正极的材料是___________ ,负极的电极反应式是___________ 。
(5)当有3.25gZn参与反应,转移的电子数目为___________ 。
I.锌片与稀硫酸反应的能量变化特征如图所示:
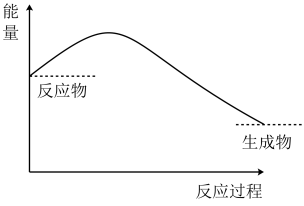
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象是
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流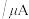 |
|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(3)该实验目的是研究水果种类和
(4)该实验装置中,正极的材料是
(5)当有3.25gZn参与反应,转移的电子数目为
您最近一年使用:0次
解题方法
7 . 能源是现代社会物质文明的原动力,与我们每个人息息相关。
I.人们常利用化学反应中的能量变化为人类服务。
(1)化石燃料是人类利用最多的常规能源,为促进社会的可持续发展,人类不断地寻找更多新能源,例如:______ 、______ (任意书写两种新能源)。
(2)下列反应属于吸热反应的是______ (填序号)
①CH4燃烧 ②C与CO2反应 ③煅烧石灰石(主要成分是CaCO3)制生石灰
④氯化铵晶体和 混合搅拌
混合搅拌
Ⅱ.已知31g白磷变为31g红磷释放能量。
(3)上述变化属于______ (填“物理”或“化学”)变化。
(4)常温常压下,白磷与红磷更稳定的是______ 。
Ⅲ.如图是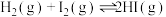 反应过程中的能量变化图。
反应过程中的能量变化图。______ (填“放热反应”或“吸热反应”)。
(6)已知1molH2与1mol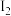 完全反应生成2molHI会放出11kJ的能量,则1gH2与足量
完全反应生成2molHI会放出11kJ的能量,则1gH2与足量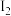 完全反应,放出
完全反应,放出______ kJ能量。断开1molH—H键、1molH—I键分别需要吸收的能量为436KJ、299kJ,则断开1molI—I键需要吸收的能量为______ kJ。
I.人们常利用化学反应中的能量变化为人类服务。
(1)化石燃料是人类利用最多的常规能源,为促进社会的可持续发展,人类不断地寻找更多新能源,例如:
(2)下列反应属于吸热反应的是
①CH4燃烧 ②C与CO2反应 ③煅烧石灰石(主要成分是CaCO3)制生石灰
④氯化铵晶体和
 混合搅拌
混合搅拌Ⅱ.已知31g白磷变为31g红磷释放能量。
(3)上述变化属于
(4)常温常压下,白磷与红磷更稳定的是
Ⅲ.如图是
 反应过程中的能量变化图。
反应过程中的能量变化图。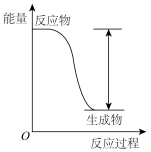
(6)已知1molH2与1mol
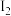 完全反应生成2molHI会放出11kJ的能量,则1gH2与足量
完全反应生成2molHI会放出11kJ的能量,则1gH2与足量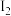 完全反应,放出
完全反应,放出
您最近一年使用:0次
名校
8 . 化学在生产生活中无处不在。
I.某汽车安全气囊的气体发生剂主要含有叠氮化钠(NaN3)、三氧化二铁(Fe2O3)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,是___________ (填“离子”或“共价”)化合物。
(2)汽车受到猛烈碰撞时,点火器点火引发NaN3迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母)。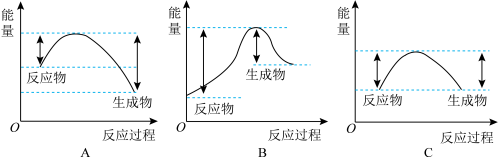
Ⅱ.CH4、CH3OH既是重要的化工原料,又是重要的能源物质。
(3)将2.0 mol CH4和4.0 mol H2O(g)通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应CH4(g)+H2O(g) CO(g)+3H2(g),测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用H2表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用H2表示该反应的平均反应速率为___________ 。
(4)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的H2O(g) e.加入合适的催化剂
(5)用CH4设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH=K2CO3+3H2O。___________ (填“A”或“B”)电极入口通甲烷。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
I.某汽车安全气囊的气体发生剂主要含有叠氮化钠(NaN3)、三氧化二铁(Fe2O3)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,是
(2)汽车受到猛烈碰撞时,点火器点火引发NaN3迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是

Ⅱ.CH4、CH3OH既是重要的化工原料,又是重要的能源物质。
(3)将2.0 mol CH4和4.0 mol H2O(g)通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g),测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用H2表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用H2表示该反应的平均反应速率为(4)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)
 CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的H2O(g) e.加入合适的催化剂
(5)用CH4设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH=K2CO3+3H2O。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
名校
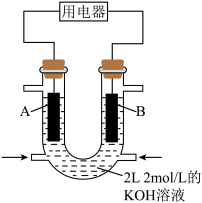
9 . 我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得 ,该反应变化过程中的能量变化如下图所示。
,该反应变化过程中的能量变化如下图所示。
(1)该反应_______ (填“吸热”或“放热”)。
(2)上述反应中的还原剂是_______ (填化学式,下同),还原产物是_______ 。
(3)请用单线桥表示该反应电子转移的方向与数目_______ 。
 ,该反应变化过程中的能量变化如下图所示。
,该反应变化过程中的能量变化如下图所示。
(1)该反应
(2)上述反应中的还原剂是
(3)请用单线桥表示该反应电子转移的方向与数目
您最近一年使用:0次
10 . 水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。
“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使H2O分解为H2和O2;若温度进一步升高至5000K,H2与O2会分解为气态原子。
(1)H2O分解过程中断裂的化学键属于
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
ⅰ.2H(g)+O(g)=H2O(g)
ⅱ.H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)
比较下列量的相对大小(均从选项中选择):①放出热量
A.ⅰ>ⅱ B.ⅰ=ⅱ C.ⅰ<ⅱ
您最近一年使用:0次