1 . 回答下列问题
(1)氨的催化氧化反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0,是工业制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H<0,是工业制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第lmin到第2min时,NH3的平均反应速率为_____ 。
②反应在第3min时改变了条件,改变的条件可能是_____ (填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g) 4NO(g)+6H2O(g)达到平衡状态的是
4NO(g)+6H2O(g)达到平衡状态的是_____ (填序号)。
A.单位时间内生成nmolNO的同时生成nmolNH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
(2)图是某燃料电池的结构示意图,电解质为硫酸溶液。回答下列问题。

①若使用甲烷为燃料,则a极的电极反应式为_____ 。
②若使用氢气为燃料,电解质溶液换成NaOH溶液,去掉质子交换膜。a极的电极反应式为_____ 。每转移1mol电子,消耗H2的体积为_____ L。(标准状况下)。
(1)氨的催化氧化反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H<0,是工业制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H<0,是工业制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:| c(NH3)mol/L | c(O2)mol/L | c(NO)mol/L | |
| 第0min | 0.8 | 1.6 | 0 |
| 第1min | a | 1.35 | 0.2 |
| 第2min | 0.3 | 0.975 | 0.5 |
| 第3min | 0.3 | 0.975 | 0.5 |
| 第4min | 0.7 | 1.475 | 0.1 |
②反应在第3min时改变了条件,改变的条件可能是
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)达到平衡状态的是
4NO(g)+6H2O(g)达到平衡状态的是A.单位时间内生成nmolNO的同时生成nmolNH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
(2)图是某燃料电池的结构示意图,电解质为硫酸溶液。回答下列问题。

①若使用甲烷为燃料,则a极的电极反应式为
②若使用氢气为燃料,电解质溶液换成NaOH溶液,去掉质子交换膜。a极的电极反应式为
您最近一年使用:0次
解题方法
2 . 回答下列问题:
(1)现有如下两个反应: A. ;B.
;B. 。判断上述两个反应中能设计成原电池的是
。判断上述两个反应中能设计成原电池的是_______ (填“A”或“B”)。
(2)将纯锌片和纯铜片按图中方式插入 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是_______ 。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 均增大
均增大
②在相同时间内,两烧杯中产生气泡的速度:甲_______ 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:_______ 。
(3)在反应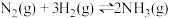 中,若以
中,若以 表示的该反应的化学反应速率为
表示的该反应的化学反应速率为 ,则以
,则以 表示此反应的化学反应速率为
表示此反应的化学反应速率为_______ 
(4)在 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和 ,在一定条件下发生反应,
,在一定条件下发生反应, 后测得
后测得 的物质的量为
的物质的量为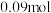 ,则以
,则以 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为_______ 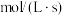
(5)将 充入容积为
充入容积为 的恒容密闭容器中,某温度下发生反应
的恒容密闭容器中,某温度下发生反应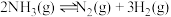 ,在
,在 内,消耗
内,消耗 的平均速率为
的平均速率为 ,则在
,则在 时,容器中生成
时,容器中生成_______ 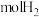 ,此时
,此时 的物质的量浓度为
的物质的量浓度为_______  。
。
(1)现有如下两个反应: A.
 ;B.
;B. 。判断上述两个反应中能设计成原电池的是
。判断上述两个反应中能设计成原电池的是(2)将纯锌片和纯铜片按图中方式插入
 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的
 均增大
均增大②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出图中构成原电池的负极电极反应式:
(3)在反应
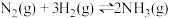 中,若以
中,若以 表示的该反应的化学反应速率为
表示的该反应的化学反应速率为 ,则以
,则以 表示此反应的化学反应速率为
表示此反应的化学反应速率为
(4)在
 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和 ,在一定条件下发生反应,
,在一定条件下发生反应, 后测得
后测得 的物质的量为
的物质的量为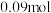 ,则以
,则以 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为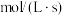
(5)将
 充入容积为
充入容积为 的恒容密闭容器中,某温度下发生反应
的恒容密闭容器中,某温度下发生反应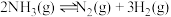 ,在
,在 内,消耗
内,消耗 的平均速率为
的平均速率为 ,则在
,则在 时,容器中生成
时,容器中生成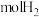 ,此时
,此时 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
解题方法
3 . A~D是四种烃分子的球棍模型(如图)
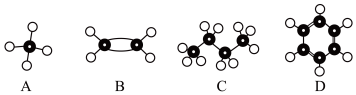
(1)A的分子式___________ 。
(2)能使酸性高锰酸钾溶液褪色的物质是___________ (填序号)。
(3)B的结构简式___________ 。
(4)从下列各组物质中,找出合适的序号填在对应的空格内:
①甲烷和丙烷②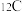 和
和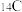 ③金刚石和石墨④H和D
③金刚石和石墨④H和D
⑤异戊烷( )和新戊烷(
)和新戊烷(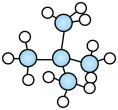 )⑥
)⑥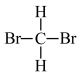 和
和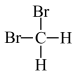
⑦正丁烷和异丁烷⑧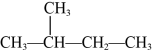 和
和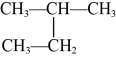 ⑨
⑨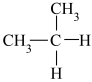 和
和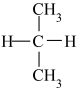
(一)互为同位素的是___________ (填序号,下同)。
(二)互为同分异构体的是___________ 。
(三)互为同系物的是___________ 。
(四)互为同素异形体的是___________ 。
(5)一定温度下,在体积为2 L的恒容密闭容器中充入1 mol N2和3 mol H2,一定条件下发生反应: ,测得其中N2的物质的量随时间的变化如图所示。
,测得其中N2的物质的量随时间的变化如图所示。
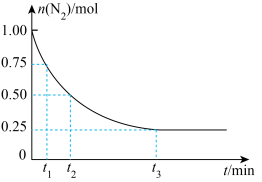
从开始反应到t2 min,氮气的平均反应速率为___________ 。

(1)A的分子式
(2)能使酸性高锰酸钾溶液褪色的物质是
(3)B的结构简式
(4)从下列各组物质中,找出合适的序号填在对应的空格内:
①甲烷和丙烷②
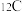 和
和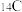 ③金刚石和石墨④H和D
③金刚石和石墨④H和D⑤异戊烷(
 )和新戊烷(
)和新戊烷( )⑥
)⑥ 和
和
⑦正丁烷和异丁烷⑧
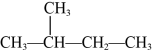 和
和 ⑨
⑨ 和
和
(一)互为同位素的是
(二)互为同分异构体的是
(三)互为同系物的是
(四)互为同素异形体的是
(5)一定温度下,在体积为2 L的恒容密闭容器中充入1 mol N2和3 mol H2,一定条件下发生反应:
 ,测得其中N2的物质的量随时间的变化如图所示。
,测得其中N2的物质的量随时间的变化如图所示。
从开始反应到t2 min,氮气的平均反应速率为
您最近一年使用:0次
4 .  的资源化利用成为研究热点。一定条件下,
的资源化利用成为研究热点。一定条件下, 催化加氢发生的反应为
催化加氢发生的反应为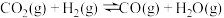 。一定条件下,向容积为1L的恒容密闭容器中充入
。一定条件下,向容积为1L的恒容密闭容器中充入 和
和 ,分别在温度为
,分别在温度为 条件下反应,测得反应体系中
条件下反应,测得反应体系中 的物质的量分数随时间的变化关系如图所示。回答下列问题:
的物质的量分数随时间的变化关系如图所示。回答下列问题:

(1)在T1K温度下,CO2的平衡转化率 =
=___________ %。压缩平衡体系体积,平衡___________ (“正向移动”“不移动”或“逆向移动”)。若想进一步提高CO2的平衡转化率,除改变温度外还可以采取的措施是___________
(2)在T2K温度下,经t1min后反应达到平衡。
①0~t1min内,用CO2表示的反应速率v(CO2)=___________ mol·L-1·min-1。
②在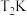 温度下,该反应的平衡常数K=
温度下,该反应的平衡常数K=___________ (用分数表示)。
(3)下图中能正确表示反应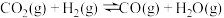 的化学平衡常数
的化学平衡常数 与温度T关系的是
与温度T关系的是___________ (填字母)。

(4)若反应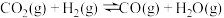 在恒容容器中发生,下列情况下反应一定达到平衡状态的是___________(填字母)。
在恒容容器中发生,下列情况下反应一定达到平衡状态的是___________(填字母)。
(5)已知反应 的
的
 。
。 为速率常数,x(B)为组分B的物质的量分数。a、b点的正反应速率之比va:vb
为速率常数,x(B)为组分B的物质的量分数。a、b点的正反应速率之比va:vb___________ (填“>”“<”或“=”)1;c点的 =
=___________ 。
 的资源化利用成为研究热点。一定条件下,
的资源化利用成为研究热点。一定条件下, 催化加氢发生的反应为
催化加氢发生的反应为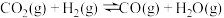 。一定条件下,向容积为1L的恒容密闭容器中充入
。一定条件下,向容积为1L的恒容密闭容器中充入 和
和 ,分别在温度为
,分别在温度为 条件下反应,测得反应体系中
条件下反应,测得反应体系中 的物质的量分数随时间的变化关系如图所示。回答下列问题:
的物质的量分数随时间的变化关系如图所示。回答下列问题:
(1)在T1K温度下,CO2的平衡转化率
 =
=(2)在T2K温度下,经t1min后反应达到平衡。
①0~t1min内,用CO2表示的反应速率v(CO2)=
②在
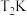 温度下,该反应的平衡常数K=
温度下,该反应的平衡常数K=(3)下图中能正确表示反应
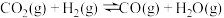 的化学平衡常数
的化学平衡常数 与温度T关系的是
与温度T关系的是
(4)若反应
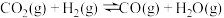 在恒容容器中发生,下列情况下反应一定达到平衡状态的是___________(填字母)。
在恒容容器中发生,下列情况下反应一定达到平衡状态的是___________(填字母)。| A.容器内的压强不再改变 |
| B.容器内气体密度不再改变 |
C.容器内 |
D.单位时间内,断开 键的数目和断开 键的数目和断开 键的数目相同 键的数目相同 |
(5)已知反应
 的
的
 。
。 为速率常数,x(B)为组分B的物质的量分数。a、b点的正反应速率之比va:vb
为速率常数,x(B)为组分B的物质的量分数。a、b点的正反应速率之比va:vb =
=
您最近一年使用:0次
名校
解题方法
5 . 已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
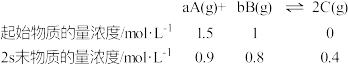
请回答下列问题。
(1)该可逆反应的化学方程式可表示为_______ 。
(2)用物质B来表示0~2s的平均反应速率为_______ 。
(3)从反应开始到2s末,A的转化率为_______ 。
(4)下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_______ (填序号)。
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(5)若平衡后改变温度,使得容器中气体的平均摩尔质量变大,则反应向_______ (填“反应物”或“生成物”)的方向移动。
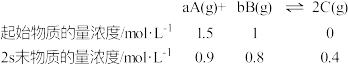
请回答下列问题。
(1)该可逆反应的化学方程式可表示为
(2)用物质B来表示0~2s的平均反应速率为
(3)从反应开始到2s末,A的转化率为
(4)下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(5)若平衡后改变温度,使得容器中气体的平均摩尔质量变大,则反应向
您最近一年使用:0次
6 . 磷酸二氢钾在工农业生产及国防工业等领域都有广泛的应用。某研究小组用 的磷酸与
的磷酸与 反应制备
反应制备 ,反应方程式为:
,反应方程式为: ,一定条件下的实验结果如图所示(忽略溶液体积变化)。
,一定条件下的实验结果如图所示(忽略溶液体积变化)。
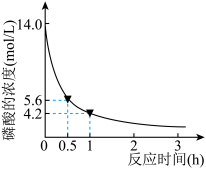
回答问题:
(1)该条件下, 内,用
内,用 表示的反应速率为
表示的反应速率为_______ 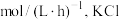 的转化率为
的转化率为_______  。
。
(2)若该反应仅在一定条件下自发进行,则该反应为_______ (选填“吸热”或“放热”)反应。
(3)向系统中不断通入水蒸气可以提高原料转化率的原因是:_______ 。
(4) 时,
时, 的平衡常数
的平衡常数
_______ 。(已知 的
的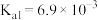 )
)
 的磷酸与
的磷酸与 反应制备
反应制备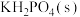 ,反应方程式为:
,反应方程式为: ,一定条件下的实验结果如图所示(忽略溶液体积变化)。
,一定条件下的实验结果如图所示(忽略溶液体积变化)。
回答问题:
(1)该条件下,
 内,用
内,用 表示的反应速率为
表示的反应速率为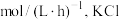 的转化率为
的转化率为 。
。(2)若该反应仅在一定条件下自发进行,则该反应为
(3)向系统中不断通入水蒸气可以提高原料转化率的原因是:
(4)
 时,
时, 的平衡常数
的平衡常数
 的
的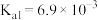 )
)
您最近一年使用:0次
7 . CO2的回收与利用是科学家研究的热点课题。工业上有一种用 CO2生产甲醇燃料的方法:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。将6mol CO2和8mol H2充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。

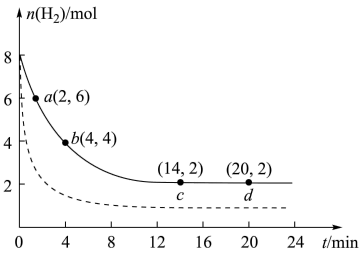
(1)a点正反应速率___________ (填大于、等于或小于)b点逆反应速率,前4min内,用CH3OH表示的平均反应速率为___________ mol/(L·min)(保留两位有效数字)。
(2)平衡时CO2的转化率为___________ ,该条件下反应的平衡常数K=___________ 。
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正___________ v逆(填“大于”,“小于”或者“等于”)。
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是___________ 。
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有___________ (写任意两个即可)。


(1)a点正反应速率
(2)平衡时CO2的转化率为
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有
您最近一年使用:0次
名校
8 . 某化学反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为___________ mol·(L·min)-1。
(2)在实验2中A的初始浓度C2=___________ mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3___________ v1(填“>”“=”或“<”=,且C3___________ 1.0mol·L-1(填“>”“=”或“<”=)。
(4)比较实验4和实验1,可推测该反应是___________ 反应(选填“吸热”或“放热”),理由是___________ 。
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20min时间内平均速率为
(2)在实验2中A的初始浓度C2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 银及其化合物在催化与电化学等领域中具有重要应用。
Ⅰ.一定条件下,银催化剂表面上存在反应:Ag2O(s) 2Ag(s)+
2Ag(s)+ O2(g),该反应平衡压强Pc与温度T的关系如下:
O2(g),该反应平衡压强Pc与温度T的关系如下:
(1)463K时的平衡常数Kp=_______  。
。
Ⅱ.起始状态Ⅰ中有Ag2O、Ag和O2,经下列过程达到各平衡状态:

(2)已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是_______ (填字母)。
A.从Ⅰ到Ⅱ的过程△S>0
B.Pc(Ⅱ)>Pc(Ⅲ)
C.平衡常数:K(Ⅱ)>K(Ⅳ)
D.若体积V(Ⅲ)=2V(Ⅰ),则Q(Ⅰ)= K(Ⅲ)
K(Ⅲ)
E.逆反应的速率:v(Ⅰ)>v(Ⅱ)=v(Ⅲ)>v(Ⅳ)
(3)某温度下,向恒容容器中加入Ag2O,分解过程中反应速率v(O2)与压强P的关系为v(O2)=k(1- ),k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则v(O2)=
),k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则v(O2)=_______ (用k表示)。
Ⅰ.一定条件下,银催化剂表面上存在反应:Ag2O(s)
 2Ag(s)+
2Ag(s)+ O2(g),该反应平衡压强Pc与温度T的关系如下:
O2(g),该反应平衡压强Pc与温度T的关系如下:| T/K | 401 | 443 | 463 |
| Pc/kPa | 10 | 51 | 100 |
 。
。Ⅱ.起始状态Ⅰ中有Ag2O、Ag和O2,经下列过程达到各平衡状态:

(2)已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是
A.从Ⅰ到Ⅱ的过程△S>0
B.Pc(Ⅱ)>Pc(Ⅲ)
C.平衡常数:K(Ⅱ)>K(Ⅳ)
D.若体积V(Ⅲ)=2V(Ⅰ),则Q(Ⅰ)=
 K(Ⅲ)
K(Ⅲ)E.逆反应的速率:v(Ⅰ)>v(Ⅱ)=v(Ⅲ)>v(Ⅳ)
(3)某温度下,向恒容容器中加入Ag2O,分解过程中反应速率v(O2)与压强P的关系为v(O2)=k(1-
 ),k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则v(O2)=
),k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则v(O2)=
您最近一年使用:0次
名校
解题方法
10 . 反应A+3B=2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15mol·L-1·s-1;②v(B)=0.6mol·L-1·s-1;③v(C)=0.4mol·L-1·s-1;④v(D)=0.45mol·L-1·s-1。该反应进行的快慢顺序为___________ 。
您最近一年使用:0次



