解题方法
1 . 一定温度下,在V = 1L的恒容容器中,反应2N2O(g) = 2N2(g) + O2(g)的部分实验数据如下:
下列说法不正确的是
| 反应时间 / min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O) / mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
| A.其它条件一定时,N2O的分解速率与其浓度无关 |
| B.0~100min内,以O2表示的平均反应速率为5×10-4mol∙L-1∙min-1 |
| C.若某时刻N2O的转化率为50%,则此时容器内压强为初始压强的1.25倍 |
| D.若保持体积不变,N2O初始浓度改为0.20mol/L,则反应30min时其转化率仍为30% |
您最近一年使用:0次
名校
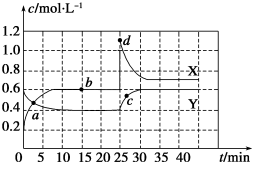
2 . 已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
| A.如混合气体的压强不再发生改变,说明反应已达化学平衡状态 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点 |
| C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1 |
| D.反应进行至25 min时,曲线发生变化的原因是增加N2O4的浓度 |
您最近一年使用:0次
2022-01-17更新
|
740次组卷
|
13卷引用:辽宁省葫芦岛市2021届高考第一次模拟考试化学试题
辽宁省葫芦岛市2021届高考第一次模拟考试化学试题辽宁省大连市第一中学2021-2022学年高二上学期阶段性学情反馈(二)化学试题广东省广州中学2021-2022学年高二上学期期中考试化学试题(已下线)2.3.1 浓度、压强变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)2018年9月12日 《每日一题》人教选修4-化学平衡状态的判断(已下线)2018年9月24日《每日一题》一轮复习化学平衡状态的判断(已下线)2018年10月27日 《每日一题》人教选修4--周末培优(已下线)2019年9月23日 《每日一题》2020年高考一轮复习-化学平衡状态的判断甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题(已下线)第02章 化学反应速率与化学平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时1 化学平衡状态的特征湖南省新宁县崀山培英学校2020-2021学年高二上学期第二次月考化学试题陕西省千阳中学2020-2021学年高二上学期期中化学(理科)试题
21-22高二上·河北石家庄·阶段练习
3 . 回答下列问题:
(Ⅰ)某温度下,在一个10L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据回答下列问题:
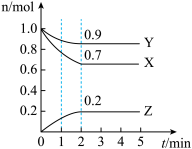
(1)该反应的化学方程式为___________ 。反应开始至2min,以气体Y表示的平均反应速率为___________ 。
(2)将含a mol X与b mol Y的混合气体充入该容器发生反应,某时刻测得容器中各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a∶b=___________ 。
(3)对于上述反应,在不同时间段内所测反应速率如下,则表示该化学反应进行由快到慢顺序为___ (用字母表示)。
A.v(X)=1.2 mol·L-1·min-1 B.v(Y)=1.5 mol·L-1·min-1
C.v(Z)=0.6 mol·L-1·min-1 D.v(Z)=0.015 mol·L-1·s-1
(4)写出该反应平衡常数的表达式___ 。
(Ⅱ)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g) Y(g)Z(s) (乙)A(s)2B(g)
Y(g)Z(s) (乙)A(s)2B(g)  C(g)D(g)
C(g)D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是___________ ;能表明(乙)达到化学平衡状态是___________ 。
①混合气体的密度 ②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量
(Ⅲ)在 催化下发生反应:
催化下发生反应: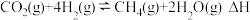 。假定未发生其他反应,
。假定未发生其他反应, 时向
时向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,初始总压强为
,初始总压强为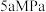 ,
, 后反应达到平衡,
后反应达到平衡, 和
和 的平衡分压分别为
的平衡分压分别为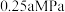 和
和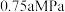 。
。
平衡时 的转化率为
的转化率为___________ 。该温度下充入 和
和 ,则该反应的平衡常数
,则该反应的平衡常数
___________  。
。
(Ⅰ)某温度下,在一个10L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据回答下列问题:

(1)该反应的化学方程式为
(2)将含a mol X与b mol Y的混合气体充入该容器发生反应,某时刻测得容器中各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a∶b=
(3)对于上述反应,在不同时间段内所测反应速率如下,则表示该化学反应进行由快到慢顺序为
A.v(X)=1.2 mol·L-1·min-1 B.v(Y)=1.5 mol·L-1·min-1
C.v(Z)=0.6 mol·L-1·min-1 D.v(Z)=0.015 mol·L-1·s-1
(4)写出该反应平衡常数的表达式
(Ⅱ)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)
 Y(g)Z(s) (乙)A(s)2B(g)
Y(g)Z(s) (乙)A(s)2B(g)  C(g)D(g)
C(g)D(g)当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度 ②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量
(Ⅲ)在
 催化下发生反应:
催化下发生反应: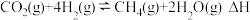 。假定未发生其他反应,
。假定未发生其他反应, 时向
时向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,初始总压强为
,初始总压强为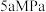 ,
, 后反应达到平衡,
后反应达到平衡, 和
和 的平衡分压分别为
的平衡分压分别为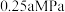 和
和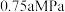 。
。平衡时
 的转化率为
的转化率为 和
和 ,则该反应的平衡常数
,则该反应的平衡常数
 。
。
您最近一年使用:0次
解题方法
4 . 利用磷石膏废渣(主要成分为 )生产硫酸可实现硫资源的循环利用.回答下列问题:
)生产硫酸可实现硫资源的循环利用.回答下列问题:
硫黄分解磷石膏工艺涉及的主要反应为:
(I)

(II)

(1)对于反应(I),下列化学反应速率最大的是______
A. B.
B.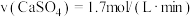
C.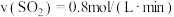 D.
D.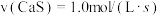
(2)反应 =
=  的
的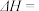
______  ;
;
(3)在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是______ (填字母).
A.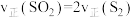 B.气体中含硫原子总数不随时间变化
B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化 D.容器内气体总压强不再随时间变化
(4)在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中( 、
、 、
、 均足量)再充入少量
均足量)再充入少量 ,达到新平衡后,与原平衡相比
,达到新平衡后,与原平衡相比
____ (填“增大”“减小”或“不变”),原因为_____ .
 )生产硫酸可实现硫资源的循环利用.回答下列问题:
)生产硫酸可实现硫资源的循环利用.回答下列问题:硫黄分解磷石膏工艺涉及的主要反应为:
(I)


(II)


(1)对于反应(I),下列化学反应速率最大的是
A.
 B.
B.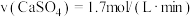
C.
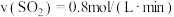 D.
D.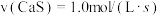
(2)反应
 =
=  的
的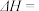
 ;
;(3)在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是
A.
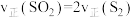 B.气体中含硫原子总数不随时间变化
B.气体中含硫原子总数不随时间变化C.容器内固体总质量不再随时间变化 D.容器内气体总压强不再随时间变化
(4)在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(
 、
、 、
、 均足量)再充入少量
均足量)再充入少量 ,达到新平衡后,与原平衡相比
,达到新平衡后,与原平衡相比
您最近一年使用:0次
2021-10-28更新
|
340次组卷
|
3卷引用:2021年湖北高考化学试题变式题11-19
名校
解题方法
5 . 反应2NO(g)+2H2(g)=N2(g)+2H2O(g)中,每生成14 g N2放出332 kJ的热量,该反应的速率表达式为v=kc(NO)mc(H2)n(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
下列说法错误的是
| 序号 | c(NO)/mol/L | c(H2)/mol/L | 速率/mol/(L•min) |
| Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
| Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
| Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
| Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
| A.该反应速率达式:ν=500c2(NO)•c(H2) |
| B.正反应的活化能:①>② |
| C.整个反应速度由第①步反应决定 |
| D.该反应的热化学方程式为2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-664 kJ/mol |
您最近一年使用:0次
2021-10-07更新
|
556次组卷
|
4卷引用:2021年山东高考化学试题变式题11-20
名校
6 . 一定温度下,在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是
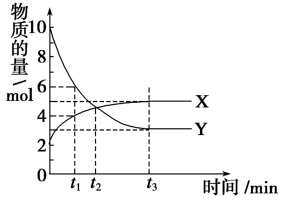

A.反应的化学方程式为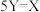 |
B. 时,Y的浓度是X浓度的1.5倍 时,Y的浓度是X浓度的1.5倍 |
C. 时,X的反应速率与Y的反应速率相等 时,X的反应速率与Y的反应速率相等 |
D.Y的反应速率: 时刻 时刻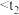 时刻 时刻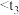 时刻 时刻 |
您最近一年使用:0次
2021-10-01更新
|
991次组卷
|
8卷引用:2021年广东省高考化学试卷变式题11-21
2021年广东省高考化学试卷变式题11-21云南省昭通市永善县第一中学2021-2022学年高二上学期9月月考化学试题辽宁省调兵山市第二高级中学2021-2022学年高三上学期第二次考试化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)陕西省西安市周至县第四中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)河北省邯郸市大名县第一中学2022-2023学年高一下学期3月月考化学试题
2021·浙江·高考真题
7 . 一定温度下:在 的四氯化碳溶液(
的四氯化碳溶液( )中发生分解反应:
)中发生分解反应: 。在不同时刻测量放出的
。在不同时刻测量放出的 体积,换算成
体积,换算成 浓度如下表:
浓度如下表:
下列说法正确的是
 的四氯化碳溶液(
的四氯化碳溶液( )中发生分解反应:
)中发生分解反应: 。在不同时刻测量放出的
。在不同时刻测量放出的 体积,换算成
体积,换算成 浓度如下表:
浓度如下表: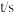 | 0 | 600 | 1200 | 1710 | 2220 | 2820 | x |
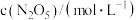 | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | 0.12 |
A.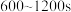 ,生成 ,生成 的平均速率为 的平均速率为 |
B.反应 时,放出的 时,放出的 体积为 体积为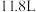 (标准状况) (标准状况) |
C.反应达到平衡时, |
| D.推测上表中的x为3930 |
您最近一年使用:0次
2021-06-15更新
|
9687次组卷
|
47卷引用:2021年6月浙江高考化学试题变式题11-20
(已下线)2021年6月浙江高考化学试题变式题11-202021年6月新高考浙江化学高考真题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一下学期期末考试化学(文)试题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省烟台市莱州第一中学2021-2022学年高二上学期10月月考化学试题(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)浙江省嘉兴市第五高级中学2021-2022学年高二10月份月考化学试题安徽省卓越县中联盟2021-2022学年高二上学期期中联考化学试题浙江省S9联盟2021-2022学年高二上学期期中联考化学试题山东省滕州第一中学2021-2022学年高二上学期第一学段模块考试(期中)化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)吉林省长春市东北师大学属中学2021-2022学年高三上学期第三次摸底考试化学试题浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题黑龙江省哈尔滨市第三中学2021-2022学年上学期高三第三次验收考试化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题12 化学反应速率与化学平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)卷07 化学反应速率与化学平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)陕西省汉中中学2021-2022学年高二上学期第三次月考化学试题(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第26练 化学反应速率-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第18讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省大庆铁人中学2022-2023学年高三上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高三上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省岳阳县第一中学2022-2023学年高二下学期开学考试化学试题(已下线)题型113 化学反应速率的计算与大小比较(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第26讲化学反应速率及影响因素(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)(已下线)第1讲 化学反应速率及其影响因素(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西师范大学附属中学2024届高三上学期第一次月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题云南省大理白族自治州祥云祥华中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
8 . 化学反应速率与反应物浓度的关系式(称为速率方程)是通过实验测定的。以反应S2O +2I-=2SO
+2I-=2SO +I2为例,可先假设该反应的速率方程为v=kcm(S2O
+I2为例,可先假设该反应的速率方程为v=kcm(S2O )cn(I-),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程。25℃时,测得反应在不同浓度时的反应速率如表:
)cn(I-),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程。25℃时,测得反应在不同浓度时的反应速率如表:
已知过二硫酸(H2S2O8)可以看成是H2O2中两个氢原子被二个磺基(—SO3H)取代的产物。下列说法正确的是
 +2I-=2SO
+2I-=2SO +I2为例,可先假设该反应的速率方程为v=kcm(S2O
+I2为例,可先假设该反应的速率方程为v=kcm(S2O )cn(I-),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程。25℃时,测得反应在不同浓度时的反应速率如表:
)cn(I-),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程。25℃时,测得反应在不同浓度时的反应速率如表:| 实验 | c(S2O )/mol·L-1 )/mol·L-1 | c(I-)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | 0.032 | 0.030 | 1.4×10-5 |
| 2 | 0.064 | 0.030 | 2.8×10-5 |
| 3 | 0.064 | 0.015 | 1.4×10-5 |
A.过二硫酸根离子(S2O )中含有2个过氧键 )中含有2个过氧键 |
| B.该反应的总级数为2 |
| C.速率方程中k=6.14×10-3L·mol-1·s-1 |
| D.化学反应速率与反应的路径无关,速率方程中浓度的方次要由实验确定 |
您最近一年使用:0次
2021-05-21更新
|
1406次组卷
|
8卷引用:吉林省松原市前郭县、长岭县、乾安县2021年普通高等学校招生高中毕业年级5月联考化学试题
吉林省松原市前郭县、长岭县、乾安县2021年普通高等学校招生高中毕业年级5月联考化学试题(已下线)第20讲 化学反应速率(精讲)-2022年一轮复习讲练测(已下线)2.1.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题21 化学反应速率(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练河北省秦皇岛市昌黎第一中学2023届高三第十次调研考试化学试题(已下线)专题09反应速率、化学平衡-2022年高考真题+模拟题汇编(全国卷)(已下线)专题09反应速率、化学平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题09反应速率、化学平衡-五年(2018~2022)高考真题汇编(全国卷)
名校
解题方法
9 . 在密闭容器中发生反应2A(g) B(g),不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
B(g),不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是

 B(g),不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
B(g),不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
| A.T1>T2 |
| B.a点的正反应速率大于b点的正反应速率 |
| C.c点的正反应速率大于c点的逆反应速率 |
| D.T1温度下,反应开始至b点时,B的平均反应速率为:0.9mol·L-1·h-1 |
您最近一年使用:0次
2021-05-13更新
|
288次组卷
|
4卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
名校
解题方法
10 . 在2020年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标。使利用CO2合成高价值化学品更突显其重要性。
Ⅰ.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应起始物质的量如表:
(1)达到平衡时,CO2的体积分数φ①_____ φ②(填“>”“<”或“=”)。
(2)当_____ = v逆(H2)时,说明反应在条件②达到平衡状态。
v逆(H2)时,说明反应在条件②达到平衡状态。
Ⅱ.利用CH4超干重整CO2的催化转化如图所示:
(3)CH4与CO2超干重整反应的方程式为_____ 。
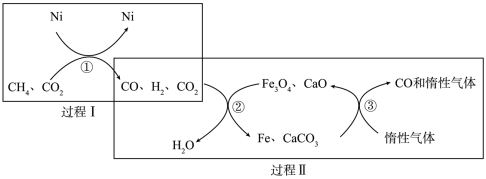
(4)有关转化过程,下列说法正确的是_____ (填序号)。
a.过程Ⅰ中CO2未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转化②中CaO消耗过程中的CO2,有利于反应正向进行
d.转化③中Fe与CaCO3反应的物质的量之比为4∶3
Ⅲ.通过下列反应可实现CO2的再转化,合成CO、CH4:
①CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH<0
②CO2(g)+H2(g)=CO(g)+H2O(g)ΔH>0
在密闭容器中通入3mol的H2和1mol的CO2,分别在压强为1MPa和10MPa下进行反应。实验中对平衡体系的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4在三种物质中的体积分数影响如图所示。
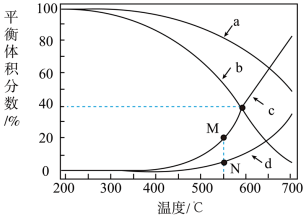
(5)1MPa时,表示CH4和CO平衡体积分数随温度变化关系的曲线分别是_____ 和_____ 。M点平衡体积分数高于N点的原因是_____ 。
(6)图中当CH4和CO平衡体积分数均为40%时,若容器的体积为1L,该温度下反应①的平衡常数K的值为_____ 。
Ⅰ.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应起始物质的量如表:
| 反应条件 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| ①恒温恒容 | 1 | 3 | 0 | 0 |
| ②绝热恒容 | 0 | 0 | 1 | 1 |
(1)达到平衡时,CO2的体积分数φ①
(2)当
 v逆(H2)时,说明反应在条件②达到平衡状态。
v逆(H2)时,说明反应在条件②达到平衡状态。Ⅱ.利用CH4超干重整CO2的催化转化如图所示:
(3)CH4与CO2超干重整反应的方程式为

(4)有关转化过程,下列说法正确的是
a.过程Ⅰ中CO2未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转化②中CaO消耗过程中的CO2,有利于反应正向进行
d.转化③中Fe与CaCO3反应的物质的量之比为4∶3
Ⅲ.通过下列反应可实现CO2的再转化,合成CO、CH4:
①CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH<0
②CO2(g)+H2(g)=CO(g)+H2O(g)ΔH>0
在密闭容器中通入3mol的H2和1mol的CO2,分别在压强为1MPa和10MPa下进行反应。实验中对平衡体系的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4在三种物质中的体积分数影响如图所示。

(5)1MPa时,表示CH4和CO平衡体积分数随温度变化关系的曲线分别是
(6)图中当CH4和CO平衡体积分数均为40%时,若容器的体积为1L,该温度下反应①的平衡常数K的值为
您最近一年使用:0次
2021-05-01更新
|
680次组卷
|
3卷引用:山东省泰安市2021届高考第二次模拟化学试题



