解题方法
1 . 甲醇用途广泛,可用作溶剂、防冻剂、燃料,也可用于生产生物柴油,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下,回答下列问题:
反应ⅰ:CO(g)+2H2(g) CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1
反应ii:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
反应iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):___________ 。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式___________ 。
③m=___________ (计算结果保留两位有效数字,已知1eV=1.6×10−22kJ)。
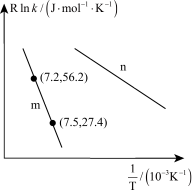
(2)反应ⅰ的Arrhenius经验公式Rlnk=− +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是___________ 。 和CO的选择性
和CO的选择性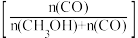 随压强变化曲线如图所示。
随压强变化曲线如图所示。___________ (填“m”“n”或“p”),简述判断方法___________ 。___________ mol·L−1·s−1(保留两位有效数字)。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1反应ii:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1反应iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
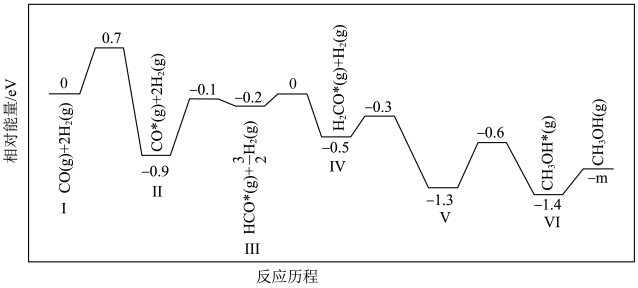
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式
③m=
(2)反应ⅰ的Arrhenius经验公式Rlnk=−
 +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是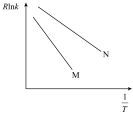
 和CO的选择性
和CO的选择性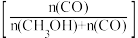 随压强变化曲线如图所示。
随压强变化曲线如图所示。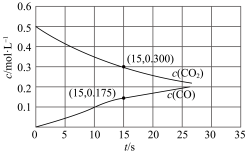
您最近半年使用:0次
2 . 为研究反应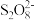 (aq)+2I-(aq)=2
(aq)+2I-(aq)=2 (aq)+I2(aq)的反应进程中的能量变化,在
(aq)+I2(aq)的反应进程中的能量变化,在 和I-的混合溶液中加入Fe3+,过程变化如下:
和I-的混合溶液中加入Fe3+,过程变化如下:
第一步:2Fe3+(aq)+2I-(aq)= I2(aq) + 2Fe2+(aq)
第二步:2Fe2+(aq)+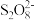 (aq)=2Fe3+(aq)+2
(aq)=2Fe3+(aq)+2 (aq)
(aq)
下列有关该反应的说法正确的是
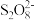 (aq)+2I-(aq)=2
(aq)+2I-(aq)=2 (aq)+I2(aq)的反应进程中的能量变化,在
(aq)+I2(aq)的反应进程中的能量变化,在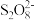 和I-的混合溶液中加入Fe3+,过程变化如下:
和I-的混合溶液中加入Fe3+,过程变化如下: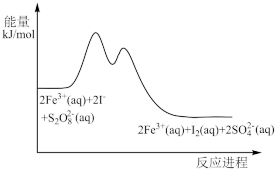
第一步:2Fe3+(aq)+2I-(aq)= I2(aq) + 2Fe2+(aq)
第二步:2Fe2+(aq)+
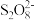 (aq)=2Fe3+(aq)+2
(aq)=2Fe3+(aq)+2 (aq)
(aq) 下列有关该反应的说法正确的是
A.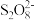 (已知其中有1个-O-O-结构)中S元素化合价为+7 (已知其中有1个-O-O-结构)中S元素化合价为+7 |
| B.总反应是吸热反应 |
| C.第一步基元反应是该反应的决速步骤 |
| D.Fe3+改变了总反应的反应历程和焓变 |
您最近半年使用:0次
3 . 二氧化碳捕集、利用和封存是减少化石能源发电和工业过程中 排放的关键技术。减少碳排放的方法还有很多,
排放的关键技术。减少碳排放的方法还有很多, 转化成其他化合物可有效实现碳循环,如下反应:
转化成其他化合物可有效实现碳循环,如下反应:
a.
b.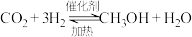
c.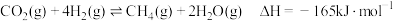
d.
回答下列问题:
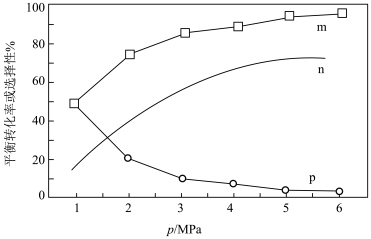
(1)已知:原子利用率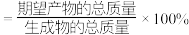 ,上述反应中原子利用率最高的是
,上述反应中原子利用率最高的是_______ (填标号)。
(2)著名的 经验公式为
经验公式为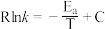 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,兴趣小组对反应b进行了实验探究,并依据实验数据获得如图曲线。在m催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,兴趣小组对反应b进行了实验探究,并依据实验数据获得如图曲线。在m催化剂作用下,该反应的活化能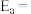
_______  ,从图中信息获知催化效能较高的催化剂是
,从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”)。
(3)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识反应b制备甲醇在不同催化条件下存在的两种反应路径:
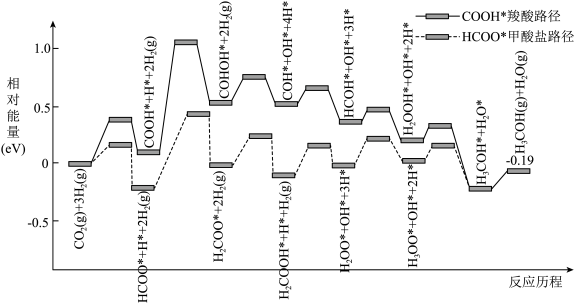
根据势能图,判断下列说法正确的是_______(填标号)。
(4)反应d中, 将等物质的量
将等物质的量 和
和 充入恒压
充入恒压 的密闭容器中。已知逆反应速率
的密闭容器中。已知逆反应速率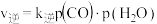 ,其中p为分压,该温度下
,其中p为分压,该温度下 。反应达平衡时测得
。反应达平衡时测得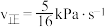 。
。 的平衡转化率为
的平衡转化率为_______ ,该温度下反应的压强平衡常数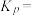
_______ (用各组分的分压计算平衡常数)。
(5)向恒容密闭容器中以物质的量之比为 充入
充入 和
和 ,发生反应c和反应d,实验测得平衡体系中各组分的体积分数与温度的关系如图所示。其中表示
,发生反应c和反应d,实验测得平衡体系中各组分的体积分数与温度的关系如图所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为_______ (填“ ”“
”“ ”或“
”或“ ”);
”); 之后,
之后, 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为_______ 。

 排放的关键技术。减少碳排放的方法还有很多,
排放的关键技术。减少碳排放的方法还有很多, 转化成其他化合物可有效实现碳循环,如下反应:
转化成其他化合物可有效实现碳循环,如下反应:a.

b.
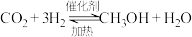
c.
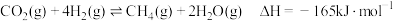
d.

回答下列问题:
(1)已知:原子利用率
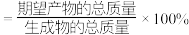 ,上述反应中原子利用率最高的是
,上述反应中原子利用率最高的是(2)著名的
 经验公式为
经验公式为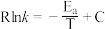 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,兴趣小组对反应b进行了实验探究,并依据实验数据获得如图曲线。在m催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,兴趣小组对反应b进行了实验探究,并依据实验数据获得如图曲线。在m催化剂作用下,该反应的活化能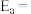
 ,从图中信息获知催化效能较高的催化剂是
,从图中信息获知催化效能较高的催化剂是
(3)通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识反应b制备甲醇在不同催化条件下存在的两种反应路径:

根据势能图,判断下列说法正确的是_______(填标号)。
A.提高 分压一定可以提高 分压一定可以提高 在催化剂表面的吸附速率 在催化剂表面的吸附速率 |
B.甲酸盐路径的决速步反应是 |
C.中间体 比 比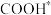 更稳定 更稳定 |
| D.使用高活性催化剂可降低反应焓变,加快反应速率 |
(4)反应d中,
 将等物质的量
将等物质的量 和
和 充入恒压
充入恒压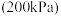 的密闭容器中。已知逆反应速率
的密闭容器中。已知逆反应速率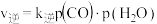 ,其中p为分压,该温度下
,其中p为分压,该温度下 。反应达平衡时测得
。反应达平衡时测得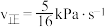 。
。 的平衡转化率为
的平衡转化率为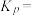
(5)向恒容密闭容器中以物质的量之比为
 充入
充入 和
和 ,发生反应c和反应d,实验测得平衡体系中各组分的体积分数与温度的关系如图所示。其中表示
,发生反应c和反应d,实验测得平衡体系中各组分的体积分数与温度的关系如图所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为 ”“
”“ ”或“
”或“ ”);
”); 之后,
之后, 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为
您最近半年使用:0次
解题方法
4 . 在 催化作用下,
催化作用下, 与
与 反应制备乙醛的反应机理如图所示。下列说法正确的是
反应制备乙醛的反应机理如图所示。下列说法正确的是
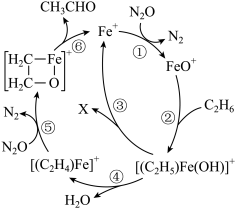
 催化作用下,
催化作用下, 与
与 反应制备乙醛的反应机理如图所示。下列说法正确的是
反应制备乙醛的反应机理如图所示。下列说法正确的是
A.基态 价层电子的轨道表示式为 价层电子的轨道表示式为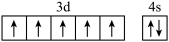 |
B.X为 ,是中间产物之一 ,是中间产物之一 |
C.每消耗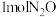 ,生成 ,生成 的物质的量小于 的物质的量小于 |
D.过程 , , 元素的化合价均发生了变化 元素的化合价均发生了变化 |
您最近半年使用:0次
解题方法
5 . 芳胺化反应在有机合成中具有很高的应用价值,我国学者合成的催化剂能高效催化电化学芳胺化反应,其反应机理如图所示。下列说法错误的是

A.⑤中Ni的化合价为 价 价 |
| B.①和Br都为该反应的催化剂 |
| C.①→②形成配位键,N原子提供孤对电子 |
D.总反应化学方程式为 |
您最近半年使用:0次
6 . 甲酸( )可在纳米级
)可在纳米级 表面分解为活性
表面分解为活性 和
和 ,经下列历程实现
,经下列历程实现 的催化还原。已知
的催化还原。已知 (Ⅱ)、
(Ⅱ)、 (Ⅲ)表示
(Ⅲ)表示 中二价铁和三价铁。下列说法正确的是
中二价铁和三价铁。下列说法正确的是

 )可在纳米级
)可在纳米级 表面分解为活性
表面分解为活性 和
和 ,经下列历程实现
,经下列历程实现 的催化还原。已知
的催化还原。已知 (Ⅱ)、
(Ⅱ)、 (Ⅲ)表示
(Ⅲ)表示 中二价铁和三价铁。下列说法正确的是
中二价铁和三价铁。下列说法正确的是
| A.生产中将催化剂处理成纳米级颗粒对甲酸分解的速率无影响 |
B.在整个历程中,每 可还原 可还原 |
C. 分解时,既有极性共价键又有非极性共价键发生断裂 分解时,既有极性共价键又有非极性共价键发生断裂 |
D.反应历程中生成的 可调节体系 可调节体系 ,有增强 ,有增强 氧化性的作用 氧化性的作用 |
您最近半年使用:0次
名校
7 . 甲酸可在固体催化剂表面逐步分解,各步骤的反应历程及相对能量如图所示,下列说法错误的是


| A.各步反应中,②生成③的速率最快 |
| B.催化剂为固态,其表面积对催化反应速率有影响 |
C.若用D(氘)标记甲酸中的羧基氢,最终产物中可能存在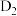 |
D.甲酸在该催化剂表面分解,放出14.2 热量 热量 |
您最近半年使用:0次
名校
8 . 煤的气化是一种重要的制氢途径。一定条件下,在容积固定的密闭容器中发生反应: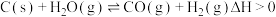 。下列说法不正确的是
。下列说法不正确的是
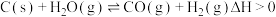 。下列说法不正确的是
。下列说法不正确的是| A.该反应的逆方向高温自发 |
| B.将炭块粉碎,可提高反应速率 |
C.增大 的量,可以增大活化分子浓度 的量,可以增大活化分子浓度 |
D.升高温度,可以提高 的转化率 的转化率 |
您最近半年使用:0次
2024-02-16更新
|
115次组卷
|
3卷引用:吉林省四校期初联考2023-2024学年高二下学期开学考试化学试题
名校
9 . 为克服传统的甲烷水蒸气重整制氢工艺中产生积碳和过多CO的缺点,科学家提出将传统的甲烷水蒸气重整分两步进行,即CH4催化裂解和催化剂消碳再生交替进行的循环制氢工艺(原理如图所示)。下列说法错误的是
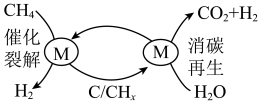

A.消碳再生过程涉及的反应之一为C+2H2O CO2+2H2 CO2+2H2 |
| B.更换合适的催化剂,降低反应焓变,效果更好 |
| C.每消耗1molCH4最多可产生4molH2 |
| D.CHx为中间产物 |
您最近半年使用:0次
2024-01-15更新
|
186次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期12月月考化学试题
解题方法
10 . “碳达峰·碳中和”是我国社会发展重大战略之一, CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ:CH4(g) + CO2(g) 2CO(g) + 2H2(g) ΔH = +247 kJ·mol−1
2CO(g) + 2H2(g) ΔH = +247 kJ·mol−1
Ⅱ:CO2(g) + H2(g) CO(g) + H2O(g) ΔH = +41 kJ·mol−1
CO(g) + H2O(g) ΔH = +41 kJ·mol−1
请回答下列问题:
(1)有利于提高CO2平衡转化率的条件是___________。
(2)反应CH4(g) + 3CO2(g) 4CO(g) + 2H2O(g)的ΔH =
4CO(g) + 2H2O(g)的ΔH = ______ kJ·mol−1。
(3)恒温恒压条件下,1mol CH4(g)和1mol CO2 (g)反应达平衡时,CH4(g)的转化率为 ,H2O (g)的物质的量为bmol,则反应Ⅰ的平衡常数Kx =
,H2O (g)的物质的量为bmol,则反应Ⅰ的平衡常数Kx =_______ (写出含有α、b的计算式;对于反应mA(g) + nB(g) pC(g) + qD(g),
pC(g) + qD(g),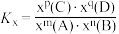 ,x为物质的量分数)。
,x为物质的量分数)。
(4)恒压、750℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化。
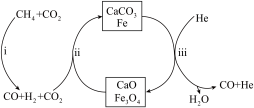
①下列说法正确的是______ 。
A.Fe3O4可循环利用,CaO不可循环利用
B.过程ⅱ,CaO吸收CO2,可促使Fe3O4氧化CO的平衡正移
C.过程ⅱ产生的H2O最终未被CaO吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原1molCO2需吸收的能量更多
②过程ⅱ平衡后通入He,测得一段时间内CO物质的量上升,根据过程ⅲ,结合平衡移动原理,解释CO物质的量上升的原因______ 。
(5)CH4还原能力(R)可衡量CO2转化效率,R= (同一时段内CO2与CH4的物质的量变化量之比)。催化剂X可提高R值,某一时段内CH4转化率、R值随温度变化如下表:
(同一时段内CO2与CH4的物质的量变化量之比)。催化剂X可提高R值,某一时段内CH4转化率、R值随温度变化如下表:
①温度升高,CH4转化率增加,CO2 转化率______ (填“增大”“减小”或“不变”)。
②分析催化剂提高R值的原因___________ 。
Ⅰ:CH4(g) + CO2(g)
 2CO(g) + 2H2(g) ΔH = +247 kJ·mol−1
2CO(g) + 2H2(g) ΔH = +247 kJ·mol−1Ⅱ:CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH = +41 kJ·mol−1
CO(g) + H2O(g) ΔH = +41 kJ·mol−1请回答下列问题:
(1)有利于提高CO2平衡转化率的条件是___________。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(2)反应CH4(g) + 3CO2(g)
 4CO(g) + 2H2O(g)的ΔH =
4CO(g) + 2H2O(g)的ΔH = (3)恒温恒压条件下,1mol CH4(g)和1mol CO2 (g)反应达平衡时,CH4(g)的转化率为
 ,H2O (g)的物质的量为bmol,则反应Ⅰ的平衡常数Kx =
,H2O (g)的物质的量为bmol,则反应Ⅰ的平衡常数Kx = pC(g) + qD(g),
pC(g) + qD(g),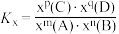 ,x为物质的量分数)。
,x为物质的量分数)。(4)恒压、750℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化。

①下列说法正确的是
A.Fe3O4可循环利用,CaO不可循环利用
B.过程ⅱ,CaO吸收CO2,可促使Fe3O4氧化CO的平衡正移
C.过程ⅱ产生的H2O最终未被CaO吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原1molCO2需吸收的能量更多
②过程ⅱ平衡后通入He,测得一段时间内CO物质的量上升,根据过程ⅲ,结合平衡移动原理,解释CO物质的量上升的原因
(5)CH4还原能力(R)可衡量CO2转化效率,R=
 (同一时段内CO2与CH4的物质的量变化量之比)。催化剂X可提高R值,某一时段内CH4转化率、R值随温度变化如下表:
(同一时段内CO2与CH4的物质的量变化量之比)。催化剂X可提高R值,某一时段内CH4转化率、R值随温度变化如下表:| 温度/℃ | 480 | 500 | 520 | 550 |
| CH4转化率/% | 7.9 | 11.5 | 20.2 | 34.8 |
| R | 2.6 | 2.4 | 2.1 | 1.8 |
②分析催化剂提高R值的原因
您最近半年使用:0次
2024-01-13更新
|
223次组卷
|
3卷引用:吉林省吉林市2023-2024学年高三上学期第二次模拟考试 化学试题
吉林省吉林市2023-2024学年高三上学期第二次模拟考试 化学试题吉林省吉林市2023-2024学年高三上学期第二次模拟考试化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)



