名校
解题方法
1 . N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂用[L-Ru-NH3]+表示|能高效电催化氧化NH3合成N2H4,其反应机理如图所示(图中L为原子团)。下列说法错误的是
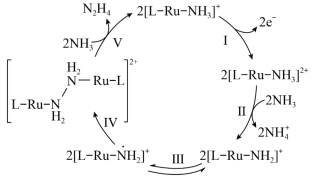
| A.[L-Ru-NH3]2+中Ru的化合价为+3 |
| B.反应Ⅳ中有非极性键的断裂与形成 |
| C.电催化氧化NH3合成N2H4发生在电解池阳极区 |
| D.N2H4与NH3中 N 原子的 VSEPR 模型均为四面体形 |
您最近半年使用:0次
7日内更新
|
327次组卷
|
4卷引用:安徽省示范高中皖北协作区2024届高三联考化学试题
安徽省示范高中皖北协作区2024届高三联考化学试题江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 (已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
2 . 精脱硫技术主要用于煤气中羰基硫(COS)和二硫化碳(CS2)的转化。回答下列问题:
(1)利用焦炉煤气中的H2可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径I和途径Ⅱ两种可能,如图所示:___________ (填“I”或“Ⅱ”)。
②反应 的△H=
的△H=___________ kJ·mol-1。
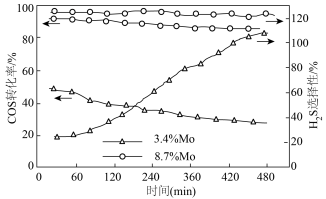
(2)MoS2可作羰基硫氢化反应的催化剂,催化机理如图所示:___________ (填“3.4%Mo”或“8.7%Mo”)作催化剂效果最好;当H2S选择性低于100%时表明部分COS气体与催化剂发生了反应,催化剂有吸硫现象,若H2S选择性高于100%,可能的原因是___________ 。
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为___________ ,设晶体密度为ρg·cm3,则晶胞参数为___________ pm(阿伏加德罗常数的值为NA)。 ,容器内气体压强随时间变化如下表所示。
,容器内气体压强随时间变化如下表所示。
①0-250min内,H2分压的平均变化值为___________ kPa·min-l。
②该温度下,平衡常数Kp=___________ (kPa)-2(列出计算式)。
(1)利用焦炉煤气中的H2可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径I和途径Ⅱ两种可能,如图所示:
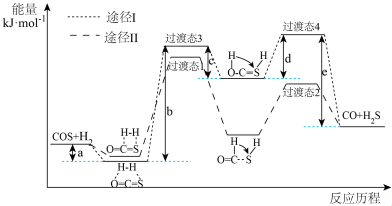
②反应
 的△H=
的△H=(2)MoS2可作羰基硫氢化反应的催化剂,催化机理如图所示:
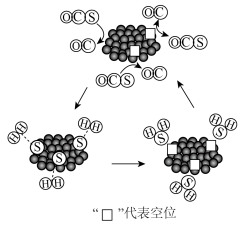
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为

 ,容器内气体压强随时间变化如下表所示。
,容器内气体压强随时间变化如下表所示。| 时间/min | 0 | 50 | 100 | 150 | 200 | 250 | 300 |
| 压强/kPa | 100 | 88.0 | 79.8 | 72.4 | 68.2 | 65.0 | 65.0 |
②该温度下,平衡常数Kp=
您最近半年使用:0次
名校
3 . 反应物(S转化为产物(P或P·Z)的能量与反应进程的关系如图所示
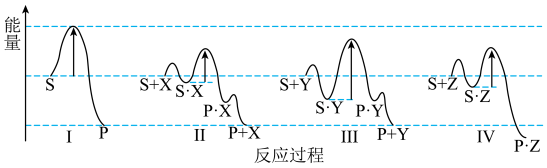
| A.进程Ⅳ中,Z没有催化作用 | B.平衡时P的产率:Ⅱ>Ⅰ |
| C.生成P的速率:Ⅲ>Ⅱ | D.进程Ⅰ是吸热反应 |
您最近半年使用:0次
名校
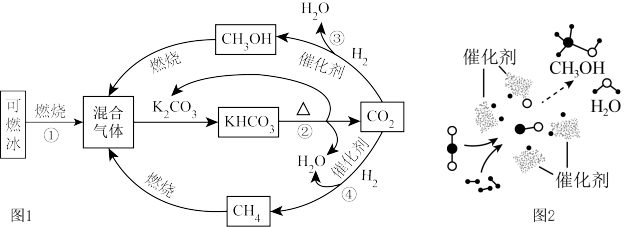
4 . 为解决能源与环境问题,有学者提出如图1所示的含碳物质转化的技术路线。 )完全燃烧的化学方程式为
)完全燃烧的化学方程式为______ 。
(2)反应②属于______ 反应(填基本反应类型)。
(3)我国学者开发促进反应③的一种新型催化剂,催化过程如图2所示。该过程的中间产物______ (填化学式)、氧和氢进一步作用生成甲醇( )和水。
)和水。
(4)反应④的化学方程式为______ 。
(5)该技术路线有利用于实现______ (填字母)。
A.碳循环利用 B.减少碳排放 C.减少白色污染
 )完全燃烧的化学方程式为
)完全燃烧的化学方程式为(2)反应②属于
(3)我国学者开发促进反应③的一种新型催化剂,催化过程如图2所示。该过程的中间产物
 )和水。
)和水。(4)反应④的化学方程式为
(5)该技术路线有利用于实现
A.碳循环利用 B.减少碳排放 C.减少白色污染
您最近半年使用:0次
解题方法
5 . 一种Zn-催化电极(表面锂掺杂了锡纳米粒子)催化制甲酸盐的电化学装置如图所示。下列说法正确的是

| A.放电时,正极电极反应式为:CO2+2e-+H2O=HCOO-+OH- |
| B.充电时,催化电极周围pH升高 |
| C.放电时,锡纳米粒子能提高CO2的平衡转化率 |
| D.充电时,催化电极应与电源的负极相连 |
您最近半年使用:0次
解题方法
6 . 中科大某课题组通过自由基杂环反应直接合成各种 稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是

 稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
稠合的内酰胺,应用于钙钛矿电池器件中。底物与Cu(Ⅰ)物种通过电子转移经历两种途径得到目标产物D。下列说法错误的是
| A.Cu(Ⅰ)物种是催化剂 | B.底物具有氧化性 |
| C.两种途径不同,总反应的反应热也不同 | D.合成过程中 中碳碳双键断裂 中碳碳双键断裂 |
您最近半年使用:0次
名校
解题方法
7 . 我国学者提出的一种CO2催化加氢合成CH3OH的反应机理如图所示,其中吸附在催化剂表面的物种用“*”标注。下列叙述错误的是
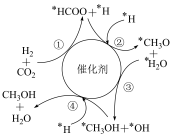

A.总反应为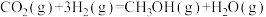 |
| B.步骤①中存在极性键的断裂和形成 |
| C.反应气中加入少量水有利于甲醇的生成 |
| D.步骤②和④中,含碳物种均被还原 |
您最近半年使用:0次
名校
解题方法
8 . 工业上以硫黄或黄铁矿为原料制备硫酸的原理示意图如下。下列叙述错误的是


| A.通过量的空气可将硫黄直接转化为SO3 |
| B.控制温度400-500℃可增大催化剂活性 |
| C.吸收剂b可选用98.3%的浓硫酸 |
| D.工业上可用氨水处理尾气中的SO2 |
您最近半年使用:0次
解题方法
9 . 四氧化锇与烯烃的反应历程如图所示,下列说法错误的是
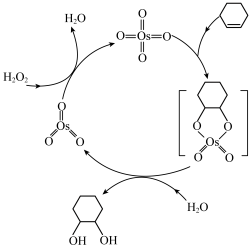

| A.H2O2作氧化剂 |
| B.利用此法乙烯可能转化为乙二醇 |
C.OsO4与 中Os的化合价均为+8价 中Os的化合价均为+8价 |
D.该历程中总反应式为: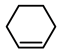 +H2O2 +H2O2 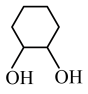 |
您最近半年使用:0次
解题方法
10 . 2023 年杭州亚运会主火炬创新使用了绿色“零碳甲醇”作为燃料,这不仅在亚运史上是第一次,在全球大型体育赛事上也是首次实现了废碳的再生利用。“零碳甲醇”是符合“碳中和”属性的绿色能源。
请回答下列问题:
(1)工业上主要利用以下反应合成甲醇: CO2(g)+3H2(g) CH3OH(g)+H2O(g)。已知在一定条件下该反应的
CH3OH(g)+H2O(g)。已知在一定条件下该反应的 = -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围
= -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围 ___________ K(用含a、b的代数式表示)。
(2)目前有多种用于工业捕集CO2的方法,主要分为吸收(物理吸收、化学吸收、生物吸收)、吸附、深冷分离和膜分离等,也有将不同捕集方法相结合的方法。一种模拟脱除工业尾气中CO2的示意图如图所示:
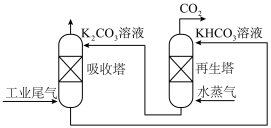
某温度下,吸收塔中H2CO3溶液吸收一定量的 后,
后, 则该溶液的pOH=
则该溶液的pOH=___________ (该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11 Kw=1×10-a,用含a的代数式表示)。
(3)CO2合成甲醇的工艺主要分为两类,一类称为直接法:CO2直接加H2合成甲醇;一类称为间接法:CO2和H2通过逆水煤气反应,先合成CO后,CO和H2再合成甲醇。
I.CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1
CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1
Ⅲ.CO(g)+2H2(g) 3CH3OH(g) ΔH3=-90kJ⋅mol-1
3CH3OH(g) ΔH3=-90kJ⋅mol-1
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是___________ (填字母)。
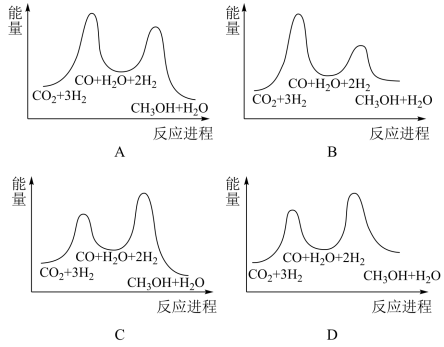
②室温下,二氧化碳与氢气合成甲醇的平衡常数K为6.8×10-3,寻找催化效率高、选择性高的催化剂是推动该反应投入实际生产的一个重要研究方向。在某催化剂下,反应Ⅲ的反应历程(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,﹡表示吸附在催化剂上)如图所示:
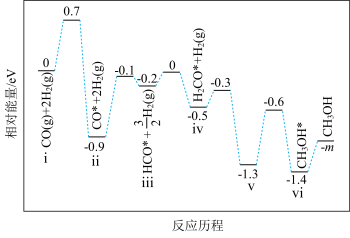
已知V中有一种吸附在催化剂表面的物质,V可表示为___________ 。
③工业生产中测定体系的压强具有实际意义。一定温度下,仅利用反应Ⅰ直接合成甲醇,将体积分数为a% CO2、3a% H2 的进料气(含杂质气体),以 Cu/Zn/Al/Zr纳米纤维为催化剂,控制压强为50 bar(1 bar=100 kPa)发生反应I,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时, p(H2) =___________ bar,反应I的平衡常数Kp= ___________ bar-2(Kp为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。
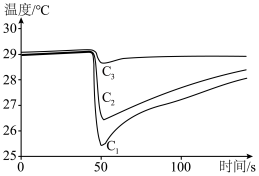
(4)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是___________ ,理由是___________ 。
请回答下列问题:
(1)工业上主要利用以下反应合成甲醇: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。已知在一定条件下该反应的
CH3OH(g)+H2O(g)。已知在一定条件下该反应的 = -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围
= -akJ⋅mol-1,ΔS=-bJ⋅mol-1⋅K-1(a>0,b >0),假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围 (2)目前有多种用于工业捕集CO2的方法,主要分为吸收(物理吸收、化学吸收、生物吸收)、吸附、深冷分离和膜分离等,也有将不同捕集方法相结合的方法。一种模拟脱除工业尾气中CO2的示意图如图所示:

某温度下,吸收塔中H2CO3溶液吸收一定量的
 后,
后, 则该溶液的pOH=
则该溶液的pOH=(3)CO2合成甲醇的工艺主要分为两类,一类称为直接法:CO2直接加H2合成甲醇;一类称为间接法:CO2和H2通过逆水煤气反应,先合成CO后,CO和H2再合成甲醇。
I.CO2 (g)+3H2 (g)
 CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1
CH3OH(g)+H2O(g) ΔH1=-48.9kJ⋅mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.1 kJ·mol-1Ⅲ.CO(g)+2H2(g)
 3CH3OH(g) ΔH3=-90kJ⋅mol-1
3CH3OH(g) ΔH3=-90kJ⋅mol-1①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是

②室温下,二氧化碳与氢气合成甲醇的平衡常数K为6.8×10-3,寻找催化效率高、选择性高的催化剂是推动该反应投入实际生产的一个重要研究方向。在某催化剂下,反应Ⅲ的反应历程(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,﹡表示吸附在催化剂上)如图所示:

已知V中有一种吸附在催化剂表面的物质,V可表示为
③工业生产中测定体系的压强具有实际意义。一定温度下,仅利用反应Ⅰ直接合成甲醇,将体积分数为a% CO2、3a% H2 的进料气(含杂质气体),以 Cu/Zn/Al/Zr纳米纤维为催化剂,控制压强为50 bar(1 bar=100 kPa)发生反应I,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时, p(H2) =
(4)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是

您最近半年使用:0次



