名校
1 . 可逆反应aA(g)+bB(s)⇌cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是
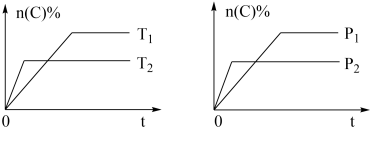

| A.升高温度,平衡向逆反应方向移动 |
| B.使用催化剂,C的物质的量分数增加 |
| C.化学方程式系数a>c+d |
| D.达到平衡后,P1条件V逆反应速率大于P2条件下V正反应速率 |
您最近一年使用:0次
解题方法
2 . 一定条件下合成乙烯; 。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是

 。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
| A.M点时平衡常数比N点时平衡常数小 |
B.若投料比 ,则图中M点乙烯的体积分数约为5.88% ,则图中M点乙烯的体积分数约为5.88% |
C.若该反应不使用催化剂,则M点的 大于N点的 大于N点的 |
| D.当温度高于250℃,由于升高温度导致催化剂的催化效率而使降低平衡逆向移动 |
您最近一年使用:0次
名校
3 . 某反应过程的能量变化如图所示。下列说法中,不正确的是
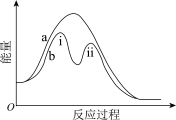
| A.该反应为放热反应 | B.曲线b表示有催化剂参与的反应过程 |
| C.反应i 的∆H>0 | D.反应i比反应ii的速率大 |
您最近一年使用:0次
2024-01-19更新
|
185次组卷
|
4卷引用:四川省什邡中学2023-2024学年高二下学期4月第一次月考化学试题
名校
4 . 甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成 和
和 。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是

 和
和 。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
| A.途径一与途径二甲酸平衡转化率相同 |
B.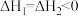 |
C.途径二 参与反应,通过改变反应途径,降低反应的活化能,加快反应速率 参与反应,通过改变反应途径,降低反应的活化能,加快反应速率 |
D.途径二反应的快慢由生成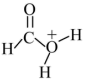 的速率决定 的速率决定 |
您最近一年使用:0次
名校
解题方法
5 . 已知反应S2O (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
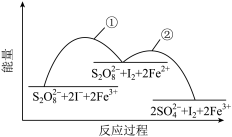
 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
| A.反应①②均为放热反应 |
| B.Fe2+是该反应的催化剂 |
| C.增大Fe3+浓度,能够加快反应速率 |
| D.若不加Fe3+,正反应的活化能比逆反应的活化能大 |
您最近一年使用:0次
名校
6 . 某反应的反应机理可以分成如下两步,下列说法错误的是
| 反应机理 | 第一步反应 | 第二步反应 |
 (慢反应) (慢反应) | 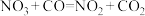 (快反应) (快反应) |
| A.在条件相同时,该反应的速率由第一步反应速率决定 |
| B.该反应的总反应方程式为NO2+CO=NO+CO2 |
| C.升高温度只会影响第一步反应速率,对第二步反应速率无影响 |
| D.加入合适的催化剂可降低反应的活化能,加快反应速率 |
您最近一年使用:0次
2024-01-01更新
|
143次组卷
|
12卷引用:四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题
四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题安徽省A10联盟2022届高三上学期摸底考试化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期中考试化学(理)试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)2021年广东省高考化学试卷变式题11-21吉林省长春市第二十中学2021-2022学年高二上学期第一次质量检测化学试题湖北省武汉市部分学校2021-2022学年高二上学期12月联考化学试题陕西省渭南市杜桥中学2023-2024学年高二上学期期中考试化学试卷 (已下线)专题02 化学反应速率-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)湖北省武汉市新洲区第一中学2024届高二上学期11月阶段测试化学试题河北省保定市高碑店市崇德实验中学2023-2024学年高二上学期1月考试化学试题
7 . 甲醇是重要的化工原料,可以使用多种方法制备甲醇。
I.利用反应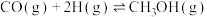
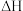 ,若在体积一定的密闭容器中按物质的量之比1:2充入CO和
,若在体积一定的密闭容器中按物质的量之比1:2充入CO和 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如如图所示。
的体积分数在不同压强下随温度的变化情况如如图所示。
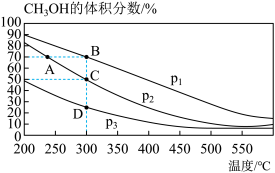
(1)该反应的
______ 0(填“>”“<”或“=”)
(2)达到平衡时,反应速率:A点____ B点(填“>”“<”或“=”)。在C点时,CO的转化率为____ 。
(3)要提高CO的平衡转化率,可以采取的措施是______ (填字母)。
A.加入催化剂 B.增大CO的浓度 C.通入 D.通入惰性气体 E.分离出甲醇
D.通入惰性气体 E.分离出甲醇
(4)关于该反应,下列说法正确的是___________(填字母)。
Ⅱ.利用 与在催化剂的作用下合成甲醇。主反应:
与在催化剂的作用下合成甲醇。主反应: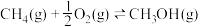 ,在温度为 T℃、压强为
,在温度为 T℃、压强为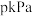 条件下,向容器中充入
条件下,向容器中充入 、
、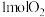 ,充分反应达平衡时
,充分反应达平衡时 的转化率为
的转化率为 。
。
(5)求平衡时 的物质的量为
的物质的量为______ 。
(6)主反应的相对压力平衡常数
___________ (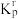 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
I.利用反应
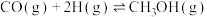
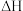 ,若在体积一定的密闭容器中按物质的量之比1:2充入CO和
,若在体积一定的密闭容器中按物质的量之比1:2充入CO和 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如如图所示。
的体积分数在不同压强下随温度的变化情况如如图所示。
(1)该反应的

(2)达到平衡时,反应速率:A点
(3)要提高CO的平衡转化率,可以采取的措施是
A.加入催化剂 B.增大CO的浓度 C.通入
 D.通入惰性气体 E.分离出甲醇
D.通入惰性气体 E.分离出甲醇(4)关于该反应,下列说法正确的是___________(填字母)。
| A.该反应在任何温度下都能自发进行 | B.使用催化剂,不能提高CO的平衡转化率 |
| C.升高温度,正反应速率增大,逆反应速率减小 | D.增大压强,该反应的化学平衡常数不变 |
Ⅱ.利用
 与在催化剂的作用下合成甲醇。主反应:
与在催化剂的作用下合成甲醇。主反应: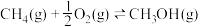 ,在温度为 T℃、压强为
,在温度为 T℃、压强为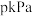 条件下,向容器中充入
条件下,向容器中充入 、
、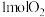 ,充分反应达平衡时
,充分反应达平衡时 的转化率为
的转化率为 。
。(5)求平衡时
 的物质的量为
的物质的量为(6)主反应的相对压力平衡常数

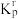 表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。用含p的式子表示)。
您最近一年使用:0次
2023-12-23更新
|
53次组卷
|
2卷引用:四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
8 .  可催化
可催化 分解,机理,Ⅰ:
分解,机理,Ⅰ: ;Ⅱ:
;Ⅱ: 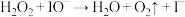 。反应过程中能量变化如图所示,下列判断正确的是
。反应过程中能量变化如图所示,下列判断正确的是
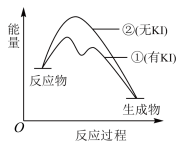
 可催化
可催化 分解,机理,Ⅰ:
分解,机理,Ⅰ: ;Ⅱ:
;Ⅱ: 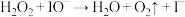 。反应过程中能量变化如图所示,下列判断正确的是
。反应过程中能量变化如图所示,下列判断正确的是
A. 是放热反应 是放热反应 | B. 分解反应的速率由机理Ⅰ决定 分解反应的速率由机理Ⅰ决定 |
C.KI能改变总反应的 | D. 不改变 不改变 分解反应的途径 分解反应的途径 |
您最近一年使用:0次
2023-12-19更新
|
96次组卷
|
2卷引用:四川省绵阳南山中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 反应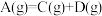 的能量变化如图所示,下列说法中正确的是
的能量变化如图所示,下列说法中正确的是
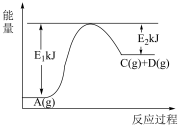
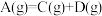 的能量变化如图所示,下列说法中正确的是
的能量变化如图所示,下列说法中正确的是
| A.C物质的能量一定高于A物质的能量 |
| B.反应物断键吸收的总能量小于产物形成新键放出的总能量 |
C. 晶体与 晶体与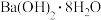 晶体反应中的能量变化符合左图关系 晶体反应中的能量变化符合左图关系 |
D.若使用催化剂,会使 、 、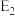 减小,反应热 减小,反应热 减小 减小 |
您最近一年使用:0次
名校
10 . 工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下。

(1)酸浸:①为加快酸浸速率可以采取的措施有___________ (任写两条)。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:①用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为___________ 。
②H2O2实际用量比理论上多的原因是___________ (用化学方程式解释)。
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
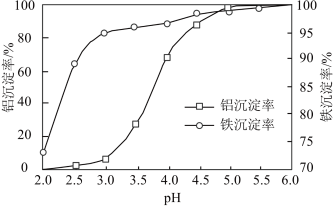
①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为________ (填字母)。
A.4.0左右 B.5.0左右 C.6.0左右
②检验Fe3+沉淀完全的实验方法为________ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为________ (填名称)。
(5)碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为___________ 。

(1)酸浸:①为加快酸浸速率可以采取的措施有
②浸渣的主要成分为
(2)氧化:①用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为
②H2O2实际用量比理论上多的原因是
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为
A.4.0左右 B.5.0左右 C.6.0左右
②检验Fe3+沉淀完全的实验方法为
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为
(5)碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
您最近一年使用:0次
2023-12-06更新
|
125次组卷
|
2卷引用:四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题



