1 . 常温下,往烧杯中加入10mL1mol/LFeCl3溶液和10mL2mol/LKI溶液,c(I-)随时间变化如图所示,不考虑溶液混合时体积的改变。下列说法正确的是
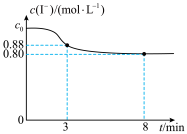
| A.c0=2 |
| B.3~8min内,Fe3+的平均反应速率为0.08mol/(L·min) |
| C.8min时,往烧杯中滴加KSCN溶液,溶液不变红 |
D.烧杯中发生反应的离子方程式为2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
您最近一年使用:0次
2 . 为了更好地利用化学反应中的物质和能量变化,研究化学反应的快慢和程度具有重要的意义。下列说法正确的是
| A.冰融化成水不属于吸热反应 |
| B.原电池是电能转化为化学能的装置 |
| C.化学反应速率快的反应一定不是可逆反应 |
| D.温度升高,吸热反应的反应速率会减小 |
您最近一年使用:0次
解题方法
3 . “液态阳光”,即“清洁甲醇”,指生产过程中碳排放量极低或为零时制得的甲醇。CO2加氢的实际化学过程包括下面三个主要的平衡反应:
反应1:
反应2:
反应3:
(1)已知反应3的反应体系能量变化如图所示,下列说法正确的是______(填标号)。
(2)恒容绝热密闭容器中进行反应2,下列说法表明反应达到了平衡的是____(填标号)。
(3)相关化学键的键能(常温常压下,断裂或形成1mol化学键需要吸收或放出的能量)数据如表所示:
反应1中,每生成1mol CH3OH(g),会_____ (填“吸收”或“放出”)___ kJ能量。
(4)一定条件下,向2L恒温密闭容器中加入1mol CO2 和3mol H2发生反应1,测得 和
和 的物质的量随时间的变化情况如下表:
的物质的量随时间的变化情况如下表:
①a=_____ , 内,
内,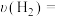
_____ 。
②12 min末时,混合气体中CH3OH的物质的量分数为_______ 。已知:B的物质的量分数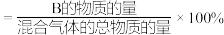 。
。
③第3 min时
____ 第9 min时 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
反应1:

反应2:

反应3:

(1)已知反应3的反应体系能量变化如图所示,下列说法正确的是______(填标号)。
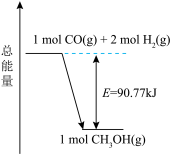
| A.该反应涉及极性键和非极性键的断裂和形成 |
B.若反应生成的 为液态,则放出的能量大于90.77kJ 为液态,则放出的能量大于90.77kJ |
C.1mol CO(g)和2mol  (g)的总键能低于1mol (g)的总键能低于1mol  (g)的总键能 (g)的总键能 |
D.1mol CO(g)和2mol  (g)在容器中充分反应,放出的能量为90.77kJ (g)在容器中充分反应,放出的能量为90.77kJ |
(2)恒容绝热密闭容器中进行反应2,下列说法表明反应达到了平衡的是____(填标号)。
| A.体系压强不再发生变化 | B. 的转化率不再变化 的转化率不再变化 |
| C.混合气体的密度不再发生变化 | D.每断裂n mol的H—H键时,形成2n mol H—O键 |
(3)相关化学键的键能(常温常压下,断裂或形成1mol化学键需要吸收或放出的能量)数据如表所示:
| 化学键 | C=O( ) ) | H—H | C—H | C—O | H—O |
键能E/( ) ) | 803 | 436 | 414 | 326 | 464 |
(4)一定条件下,向2L恒温密闭容器中加入1mol CO2 和3mol H2发生反应1,测得
 和
和 的物质的量随时间的变化情况如下表:
的物质的量随时间的变化情况如下表:| 时间 | 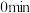 |  | 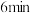 | 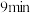 | 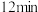 |
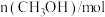 | 0 | 0.50 | a | 0.75 | 0.75 |
 | 1 | 0.50 | 0.35 | 0.25 | 0.25 |
 内,
内,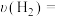
②12 min末时,混合气体中CH3OH的物质的量分数为
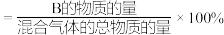 。
。③第3 min时

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
4 . 化学反应过程既有物质变化也有能量变化。
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。
(1)由 和
和 合成氨时,需要
合成氨时,需要_____________ (填“吸收”或“放出”)能量,写出该反应的热化学方程式_________________ 。
Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。_______ (填“氧化反应”或“还原反应”),电池工作过程中, 向极移动
向极移动_________ (填“A”或“B”);
②该燃料电池的总反应方程式可表示为__________ 。在标准状况下,若A极区产生11.2L  ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是__________ mol。
Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:_____________ 。
(4)反应开始至2min,以气体X表示的平均反应速率为___________ 。
(5)下列措施能增大反应速率的是_________ 。
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436
 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。(1)由
 和
和 合成氨时,需要
合成氨时,需要Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。
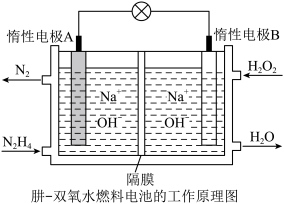
 向极移动
向极移动②该燃料电池的总反应方程式可表示为
 ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
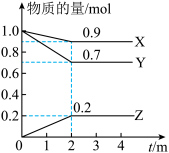
(4)反应开始至2min,以气体X表示的平均反应速率为
(5)下列措施能增大反应速率的是
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
| A.混合气体的压强不随时间的变化而变化 | B. |
| C.X体积分数保持不变 | D.混合气体的密度不随时间的变化而变化 |
您最近一年使用:0次
名校
5 . 一定条件下,对于反应 ,若X、Y、Z的起始浓度分别为
,若X、Y、Z的起始浓度分别为 、
、 、
、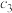 (均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1
(均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1 、0.3
、0.3 和0.08
和0.08 ,则下列判断合理的是
,则下列判断合理的是
①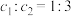
②平衡时,Y和Z的生成速率之比为2∶3
③X和Y转化量之比为1∶1
④ 的取值范围为
的取值范围为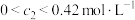
 ,若X、Y、Z的起始浓度分别为
,若X、Y、Z的起始浓度分别为 、
、 、
、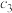 (均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1
(均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1 、0.3
、0.3 和0.08
和0.08 ,则下列判断合理的是
,则下列判断合理的是①
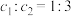
②平衡时,Y和Z的生成速率之比为2∶3
③X和Y转化量之比为1∶1
④
 的取值范围为
的取值范围为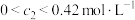
| A.①② | B.①④ | C.②③ | D.③④ |
您最近一年使用:0次
名校
6 . 对燃油尾气污染物进行脱硝处理有助于减少空气污染,可使用氨将氮氧化物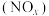 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为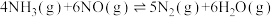 。下列说法正确的是
。下列说法正确的是
 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为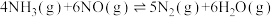 。下列说法正确的是
。下列说法正确的是A.标准状况下,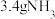 的体积约为 的体积约为 |
B. 可用作食品的保护气,原因是 可用作食品的保护气,原因是 的化学性质不活泼 的化学性质不活泼 |
C.该反应中, 与足量的 与足量的 反应,理论上可得到 反应,理论上可得到 |
D.该反应中,每断裂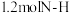 键,同时转移电子的物质的量为 键,同时转移电子的物质的量为 |
您最近一年使用:0次
名校
7 . 氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的效率。工业上用化学气相沉积法制备氮化硅,其反应为
 。一定条件下,在恒容密闭容器中发生上述反应,下列说法错误的是
。一定条件下,在恒容密闭容器中发生上述反应,下列说法错误的是

 。一定条件下,在恒容密闭容器中发生上述反应,下列说法错误的是
。一定条件下,在恒容密闭容器中发生上述反应,下列说法错误的是A. 属于共价晶体 属于共价晶体 |
B. 与 与 生成 生成 的反应属于固氮反应 的反应属于固氮反应 |
| C.当混合气体的密度不再随时间变化时,该反应达到平衡 |
| D.该反应的能量变化形式与盐酸和碳酸氢钠反应的能量变化形式相同 |
您最近一年使用:0次
名校
解题方法
8 . 在恒温恒容条件下,发生反应2A(g)+xB(g) 2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
 2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
| A.x=3 |
| B.曲线甲表示的是物质B在反应进程中的浓度变化 |
| C.10~30min内v(C)=0.05mol·L-1·min-1 |
| D.当混合气体的密度不再随时间的变化而变化,不能说明该反应达到平衡 |
您最近一年使用:0次
名校
9 .  表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.  与 与 在密闭容器中充分反应,生成 在密闭容器中充分反应,生成 分子的数目为 分子的数目为 |
| B.4.48L NO分子中含有的电子数为3NA |
| C.10g46%的酒精溶液中含有的氧原子数为0.1NA |
D.  和 和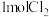 在光照下充分反应后生成的分子数为 在光照下充分反应后生成的分子数为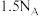 |
您最近一年使用:0次
名校
10 . 我国科学家开发新催化剂,高选择性实现丙烷脱氢制备丙烯。
反应原理:
Ⅰ.
 ;
;
Ⅱ.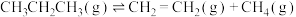
 。
。
(1)几种共价键的键能数据如下:
反应Ⅰ在__________ (填“高温”“低温”或“任意温度”)条件下自发进行,
__________  。
。
(2)一定温度下,在恒容密闭容器中充入 ,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
(3)在恒压密闭反应器中充入一定量的丙烷和不同量的Ar,发生上述反应Ⅰ和反应Ⅱ,丙烷平衡转化率与温度、投料比[ ]关系如图所示。
]关系如图所示。__________ n(填“>”“<”或“=”)。
②相同温度时,随着投料比( )增大,丙烷平衡转化率增大的原因是
)增大,丙烷平衡转化率增大的原因是__________ 。
(4)在1L恒容密闭容器中充入 和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
__________ 。(已知:丙烯的选择性 )
)
(5)以熔融 为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为
为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为__________ 。为了使电池长时间稳定运行且确保电解质组成不变,则还应在通入的空气中添加的物质是__________ (填化学式)。
反应原理:
Ⅰ.

 ;
;Ⅱ.
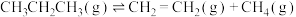
 。
。(1)几种共价键的键能数据如下:
共价键 | H-C | H-H | C-C | C=C |
键能 | 413 | 436 | 347 | 614 |

 。
。(2)一定温度下,在恒容密闭容器中充入
 ,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。
,发生上述反应Ⅰ和反应Ⅱ。下列叙述正确的是__________(填字母)。| A.混合气体平均摩尔质量不变时达到平衡状态 |
B.达到平衡时 体积分数最大为50% 体积分数最大为50% |
| C.平衡后,再充入少量的丙烷,丙烷的平衡转化率减小 |
| D.升高温度,反应Ⅰ和Ⅱ的平衡常数都减小 |
(3)在恒压密闭反应器中充入一定量的丙烷和不同量的Ar,发生上述反应Ⅰ和反应Ⅱ,丙烷平衡转化率与温度、投料比[
 ]关系如图所示。
]关系如图所示。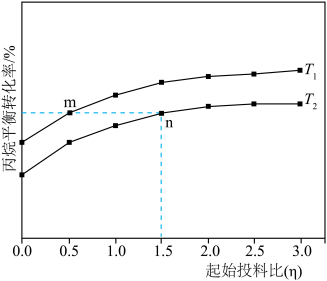
②相同温度时,随着投料比(
 )增大,丙烷平衡转化率增大的原因是
)增大,丙烷平衡转化率增大的原因是(4)在1L恒容密闭容器中充入
 和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。
和适量催化剂M发生反应Ⅰ和反应Ⅱ,测得相同时间内丙烷的转化率、丙烯的选择性与温度关系如图所示。

 )
)(5)以熔融
 为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为
为电解质,丙烷-空气燃料电池的装置如图所示。该电池放电时,负极反应式为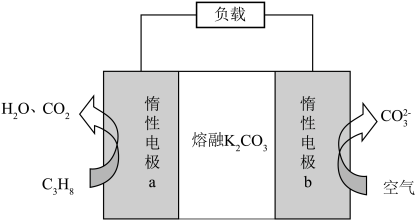
您最近一年使用:0次
2024-05-11更新
|
107次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷




