名校
解题方法
1 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
真题
名校
2 . 关于反应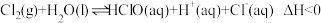 ,达到平衡后,下列说法
,达到平衡后,下列说法不正确 的是
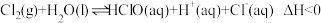 ,达到平衡后,下列说法
,达到平衡后,下列说法A.升高温度,氯水中的 减小 减小 |
B.氯水中加入少量醋酸钠固体,上述平衡正向移动, 增大 增大 |
C.取氯水稀释,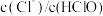 增大 增大 |
D.取两份氯水,分别滴加 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度 |
您最近一年使用:0次
2022-06-14更新
|
7565次组卷
|
28卷引用:上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题2022年6月浙江省普通高校招生选考化学试题(已下线)2022年浙江省6月高考真题变式题11-20(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题卷11 化学反应速率与化学平衡归因分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)模块综合检测卷2(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第三章 水溶液中的离子反应与平衡 第一节 电离平衡浙江省余姚中学2023-2024学年高二上学期第一次月考化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西省西安市2023-2024学年高二上学期期末化学测试卷B广东省江门市第一中学2023-2024学年高二上学期第二次段考化学(选考)试题海南省海桂中学2023-2024学年高二上学期12月教学检测(三)化学试题2024届海南省海南中学高三下学期第一次模拟化学试题
3 . 氯气与水的反应为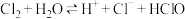 。氯水具有多种性质,研究小组同学用氯水分别与紫色石蕊溶液,
。氯水具有多种性质,研究小组同学用氯水分别与紫色石蕊溶液, 溶液反应。请完成下列问题:
溶液反应。请完成下列问题:
(1)向紫色石蕊溶液中滴加氯水的现象是___________ ,证明氯水中含有的微粒有___________ 。
(2)向 溶液中滴加少量氯水,证明氯水有氧化性的实验方案是:取适量反应后溶液于试管中,
溶液中滴加少量氯水,证明氯水有氧化性的实验方案是:取适量反应后溶液于试管中,___________ ,则证明氯水具有氧化性。
(3)氯水光照时黄绿色会逐渐变浅直至消失,并产生无色气体,请用平衡理论解释黄绿色变浅的原因:________ 。
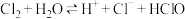 。氯水具有多种性质,研究小组同学用氯水分别与紫色石蕊溶液,
。氯水具有多种性质,研究小组同学用氯水分别与紫色石蕊溶液, 溶液反应。请完成下列问题:
溶液反应。请完成下列问题:(1)向紫色石蕊溶液中滴加氯水的现象是
(2)向
 溶液中滴加少量氯水,证明氯水有氧化性的实验方案是:取适量反应后溶液于试管中,
溶液中滴加少量氯水,证明氯水有氧化性的实验方案是:取适量反应后溶液于试管中,(3)氯水光照时黄绿色会逐渐变浅直至消失,并产生无色气体,请用平衡理论解释黄绿色变浅的原因:
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
名校
解题方法
5 . 痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:① ,②
,②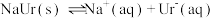 。已知:37℃时,
。已知:37℃时,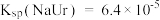 。
。
(1)关节炎发作大多在脚趾和手指的关节处,夏天症状减轻,冬天症状加重,说明反应②是
(2)下列事实可以证明尿酸是弱电解质的是___________
| A.HUr溶液可使石蕊溶液变红 | B.NaUr溶液显碱性 |
| C.常温下,等体积的尿酸溶液导电性比盐酸弱 | D.室温下测10mL0.01mol·L—1HUr溶液pH>2 |
A.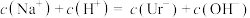 | B.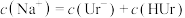 |
C.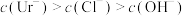 | D.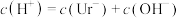 |
 。当向其中加入NaCl(s)至
。当向其中加入NaCl(s)至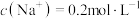 时,NaUr晶体
时,NaUr晶体
您最近一年使用:0次
2023-06-19更新
|
168次组卷
|
3卷引用:上海市嘉定区第一中学2022-2023学年高二上学期期末(等级)考试化学试题
上海市嘉定区第一中学2022-2023学年高二上学期期末(等级)考试化学试题(已下线)专题06 酸碱中和与盐类水解及难溶电解质的沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)陕西省汉中市南郑区铁佛中学2023-2024学年高二上学期12月月考化学试题
6 . 硫化氢的转化是资源利用和环境保护的重要研究课题,处理再利用 有多种方法。回答下列问题:
有多种方法。回答下列问题:
Ⅰ.热分解法
反应原理为 ,在体积为
,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入 气体,测得不同温度下
气体,测得不同温度下 分解反应的转化率与时间的关系曲线如下图所示:
分解反应的转化率与时间的关系曲线如下图所示:

(1)写出反应的平衡常数表达式_______ 。
(2)该反应的ΔH_______ 0(选填“>”、“<”或“=”)。
(3)温度为 时,当混合气体的
时,当混合气体的_______ 、_______ 不变时,可证明反应已达平衡状态。
(4)温度为 时,反应从开始到P点时,用
时,反应从开始到P点时,用 表示的平均化学反应速率
表示的平均化学反应速率
_______ 。
(5)某温度时,向体积不等的恒容容器中加入等量 ,反应相同时间后,测得各容器中
,反应相同时间后,测得各容器中 的转化率与容器体积关系如图所示。
的转化率与容器体积关系如图所示。 之后,
之后, 的转化率下降的原因是
的转化率下降的原因是_______ 。

Ⅱ.活性炭吸附氧化法
可用表面喷淋水的活性炭吸附氧化 ,其反应原理如下图所示。
,其反应原理如下图所示。

(6)该方法的总反应方程式为_______ 。
(7)其他条件不变时,水膜的酸碱性与厚度会影响 的去除率。
的去除率。
①适当增大活性炭表面的水膜 ,
, 的去除率增大,可能的原因是
的去除率增大,可能的原因是_______ 。
②若水膜过厚, 的去除率降低的原因是
的去除率降低的原因是_______ 。
 有多种方法。回答下列问题:
有多种方法。回答下列问题:Ⅰ.热分解法
反应原理为
 ,在体积为
,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入 气体,测得不同温度下
气体,测得不同温度下 分解反应的转化率与时间的关系曲线如下图所示:
分解反应的转化率与时间的关系曲线如下图所示:
(1)写出反应的平衡常数表达式
(2)该反应的ΔH
(3)温度为
 时,当混合气体的
时,当混合气体的(4)温度为
 时,反应从开始到P点时,用
时,反应从开始到P点时,用 表示的平均化学反应速率
表示的平均化学反应速率
(5)某温度时,向体积不等的恒容容器中加入等量
 ,反应相同时间后,测得各容器中
,反应相同时间后,测得各容器中 的转化率与容器体积关系如图所示。
的转化率与容器体积关系如图所示。 之后,
之后, 的转化率下降的原因是
的转化率下降的原因是
Ⅱ.活性炭吸附氧化法
可用表面喷淋水的活性炭吸附氧化
 ,其反应原理如下图所示。
,其反应原理如下图所示。
(6)该方法的总反应方程式为
(7)其他条件不变时,水膜的酸碱性与厚度会影响
 的去除率。
的去除率。①适当增大活性炭表面的水膜
 ,
, 的去除率增大,可能的原因是
的去除率增大,可能的原因是②若水膜过厚,
 的去除率降低的原因是
的去除率降低的原因是
您最近一年使用:0次
7 . 碳是一种极其重要的元素,工业上,生活中到处可见。2020年9月,习近平总书记在联合国大会上作出“努力争取2030年前实现碳达峰,2060年前实现碳中和”的承诺。碳达峰是指全球或一个地区的二氧化碳排放总量,在某一时间点达到历史最高点,即碳峰值。
碳中和是指将人类经济社会活动所必需的碳排放,通过植树造林和其他人工技术或工程加以捕集利用或封存,从而使排放到大气中的二氧化碳净增量为零。
近期,中国科学院天津工业生物技术研究所在淀粉人工合成方面取得重大突破性进展,国际上首次实现了二氧化碳和水到淀粉(C6H10O5)n的从头合成。相关工作于2021年9月24日发表于国际学术期刊《科学》,实现 “从0到1”的突破。
(1)减少碳排放的方法有很多,CO2转化成有机物的以下4例可有效实现碳循环。
a. 6CO2+6H2O C6H12O6 b.CO2+3H2
C6H12O6 b.CO2+3H2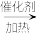 CH3OH十H2O
CH3OH十H2O
c.CO2+CH4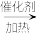 C6H12COOH d.2CO2+6H2
C6H12COOH d.2CO2+6H2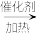 CH2=CH2+ 4H2O
CH2=CH2+ 4H2O
以上反应中,最节能的是___________ ,原子利用率最高的是___________ 。(填编号)
(2)虽然光合作用合成淀粉的表达式看起来很简单,但如果仔细探索其中的过程,会发现其反应非常复杂,需要60多个步骤。而我国科学家,不用生物细胞,单纯用工业的方式实现了二氧化碳到淀粉的合成。并且,大大缩短了自然光合作用的步骤,设计出一条只有11个步骤的“捷径”。请你设计简单实验证明第十一个步骤已经成功完成___________ 。
第一个步骤是把二氧化碳还原为甲醇(CH3OH),该方法的化学方程式是: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

(3)该反应平衡常数表达式K=_____ ,该反应在0~3 min内H2的平均反应速率是_____ molL-1•min-1)(保留3位有效数字);a点、b点、c点反应速率最大的是______ (选“a” “b” 或“c”)并解释原因_____ 。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是___________ ,曲线Ⅱ改变的条件可能是_______ 。
(5)金属钠既可以与水反应又可以与甲醇反应,_____ (填“水”、或“甲醇”)与钠反应速率更剧烈。在温度t℃下,某NaOH的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,t_____ 25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=x的盐酸(t℃),测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积变化忽略不计,则x为___________
碳中和是指将人类经济社会活动所必需的碳排放,通过植树造林和其他人工技术或工程加以捕集利用或封存,从而使排放到大气中的二氧化碳净增量为零。
近期,中国科学院天津工业生物技术研究所在淀粉人工合成方面取得重大突破性进展,国际上首次实现了二氧化碳和水到淀粉(C6H10O5)n的从头合成。相关工作于2021年9月24日发表于国际学术期刊《科学》,实现 “从0到1”的突破。
(1)减少碳排放的方法有很多,CO2转化成有机物的以下4例可有效实现碳循环。
a. 6CO2+6H2O
 C6H12O6 b.CO2+3H2
C6H12O6 b.CO2+3H2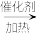 CH3OH十H2O
CH3OH十H2Oc.CO2+CH4
 C6H12COOH d.2CO2+6H2
C6H12COOH d.2CO2+6H2 CH2=CH2+ 4H2O
CH2=CH2+ 4H2O以上反应中,最节能的是
(2)虽然光合作用合成淀粉的表达式看起来很简单,但如果仔细探索其中的过程,会发现其反应非常复杂,需要60多个步骤。而我国科学家,不用生物细胞,单纯用工业的方式实现了二氧化碳到淀粉的合成。并且,大大缩短了自然光合作用的步骤,设计出一条只有11个步骤的“捷径”。请你设计简单实验证明第十一个步骤已经成功完成
第一个步骤是把二氧化碳还原为甲醇(CH3OH),该方法的化学方程式是: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题: 
(3)该反应平衡常数表达式K=
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
(5)金属钠既可以与水反应又可以与甲醇反应,
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则x为
您最近一年使用:0次
名校
8 . 已知:相关化学键的键能数据
回答下列问题:
1.合成氨反应

___________  。已知该反应的
。已知该反应的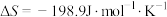 ,在下列温度下反应不能自发进行的是
,在下列温度下反应不能自发进行的是___________ 。
A.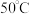 B.
B.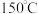 C.
C.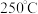
2.在合成氨过程中,需要不断分离出氨的原因为___________。
3.恒温恒容下进行的合成氨反应,以下说法中,一定能说明反应达到平衡状态的是___________。
4.针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂的解决方案。使用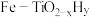 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为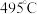 时,
时, 的温度为
的温度为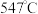 ,而
,而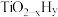 的温度为
的温度为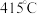 )。
)。
5. ,以
,以 和
和 为原料可合成化肥尿素:
为原料可合成化肥尿素: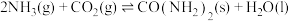 ;在
;在 的密闭容器中,通入
的密闭容器中,通入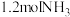 和
和
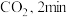 时反应刚好达到平衡。此时,
时反应刚好达到平衡。此时,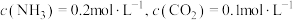 。
。
①写出该反应的平衡常数表达式___________ ;计算得 值为:
值为:___________ 。
②若 时保持
时保持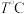 和平衡时容器的压强不变,再向体积可变的容器中充入
和平衡时容器的压强不变,再向体积可变的容器中充入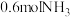 ,判断平衡移动的方向,并写出你的推理过程:
,判断平衡移动的方向,并写出你的推理过程:___________ 。
| 化学键 |  |  |  |
键能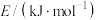 | 946 | 436.0 | 390.8 |
1.合成氨反应


 。已知该反应的
。已知该反应的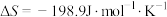 ,在下列温度下反应不能自发进行的是
,在下列温度下反应不能自发进行的是A.
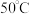 B.
B.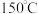 C.
C.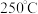
2.在合成氨过程中,需要不断分离出氨的原因为___________。
| A.有利于平衡正向移动 | B.防止催化剂中毒 |
| C.提高正反应速率 | D.提高逆反应速率 |
| A.混合气体密度不变 | B.混合气体的平均相对分子质量不变 |
C.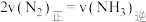 | D.化学平衡常数 不变 不变 |
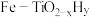 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为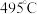 时,
时, 的温度为
的温度为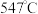 ,而
,而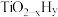 的温度为
的温度为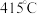 )。
)。
A.氨气在“冷 ”表面生成,有利于提高氨的平衡产率 ”表面生成,有利于提高氨的平衡产率 |
B. 在“热 在“热 ”表面断裂,有利于提高合成氨反应速率 ”表面断裂,有利于提高合成氨反应速率 |
C.“热 ”高于体系温度,有利于提高氨的平衡产率 ”高于体系温度,有利于提高氨的平衡产率 |
| D.“冷Ti”低于体系温度,有利于提高合成氨反应速率 |
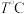 ,以
,以 和
和 为原料可合成化肥尿素:
为原料可合成化肥尿素: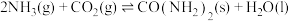 ;在
;在 的密闭容器中,通入
的密闭容器中,通入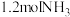 和
和
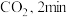 时反应刚好达到平衡。此时,
时反应刚好达到平衡。此时,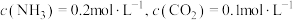 。
。①写出该反应的平衡常数表达式
 值为:
值为:②若
 时保持
时保持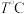 和平衡时容器的压强不变,再向体积可变的容器中充入
和平衡时容器的压强不变,再向体积可变的容器中充入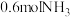 ,判断平衡移动的方向,并写出你的推理过程:
,判断平衡移动的方向,并写出你的推理过程:
您最近一年使用:0次
解题方法
9 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
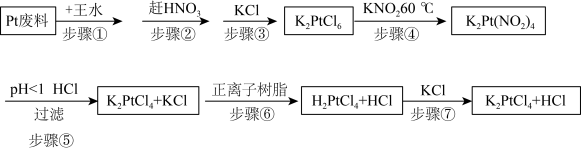
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近一年使用:0次
名校
解题方法
10 . 某小组为验证光照对次氯酸分解速率的影响,用 的浓盐酸与
的浓盐酸与 固体通过
固体通过 的反应制得少量氯气,将其通入水中制得少量氯水
的反应制得少量氯气,将其通入水中制得少量氯水 ,再将氯水分向倒入普通试剂瓶和棕色试剂瓶中,放置一段时间后,分别取样2种氯水进行后续实验探究。
,再将氯水分向倒入普通试剂瓶和棕色试剂瓶中,放置一段时间后,分别取样2种氯水进行后续实验探究。
1.写出 的结构式
的结构式___________ 。
2.请用写出除上述反应外,新制氯水中存在两个平衡(用方程式表示)___________ 。
3.利用上述反应制得的氯气原则上需要用饱和食盐水除去其中混有的 气体,请结合方程式从平衡移动角度进行解释
气体,请结合方程式从平衡移动角度进行解释___________ 。
4.下列说法错误的是 。
5.该小组设计了以下实验方案,方案以及结论均正确的是 。
6.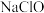 溶液具有漂白能力,已知
溶液具有漂白能力,已知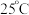 时,
时,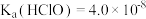 。下列关于
。下列关于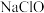 溶液说法正确的是 。
溶液说法正确的是 。
 的浓盐酸与
的浓盐酸与 固体通过
固体通过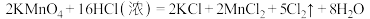 的反应制得少量氯气,将其通入水中制得少量氯水
的反应制得少量氯气,将其通入水中制得少量氯水 ,再将氯水分向倒入普通试剂瓶和棕色试剂瓶中,放置一段时间后,分别取样2种氯水进行后续实验探究。
,再将氯水分向倒入普通试剂瓶和棕色试剂瓶中,放置一段时间后,分别取样2种氯水进行后续实验探究。1.写出
 的结构式
的结构式2.请用写出除上述反应外,新制氯水中存在两个平衡(用方程式表示)
3.利用上述反应制得的氯气原则上需要用饱和食盐水除去其中混有的
 气体,请结合方程式从平衡移动角度进行解释
气体,请结合方程式从平衡移动角度进行解释4.下列说法错误的是 。
A.若生成了 氯气,则反应开始加入的浓盐酸的体积至少为 氯气,则反应开始加入的浓盐酸的体积至少为 |
| B.该制取氯气的反应中不存在非电解质 |
C.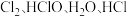 四种物质均为同一类晶体 四种物质均为同一类晶体 |
D.若测得其中一个试剂瓶里氯水中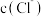 经过10分钟升高了 经过10分钟升高了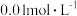 ,则次氯酸分解的速率为 ,则次氯酸分解的速率为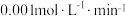 |
A.用 试纸测定两种溶液 试纸测定两种溶液 ,保存于棕色试剂瓶中的 ,保存于棕色试剂瓶中的 更高 更高 |
| B.用色度仪测量两种溶液颜色,保存于无色试剂瓶中的颜色更浅 |
C.量取等体积的两种溶液,分别加入足量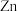 粉,无色试剂瓶中产生的气泡更快 粉,无色试剂瓶中产生的气泡更快 |
| D.测两种溶液导电性,保存于棕色试剂瓶中的导电性更强 |
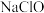 溶液具有漂白能力,已知
溶液具有漂白能力,已知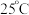 时,
时,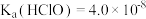 。下列关于
。下列关于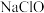 溶液说法正确的是 。
溶液说法正确的是 。A.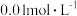 溶液中, 溶液中,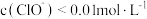 |
B.长期露置在空气中,释放 ,漂白能力减弱 ,漂白能力减弱 |
C.向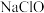 溶液中通入氯化氢能增加溶液的漂白性,此时 溶液中通入氯化氢能增加溶液的漂白性,此时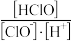 增大 增大 |
D.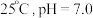 的 的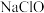 和 和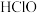 的混合溶液中, 的混合溶液中,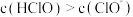 |
您最近一年使用:0次



