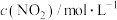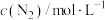名校
1 . 甲烷是重要的气体燃料和化工原料,可将甲烷催化裂解以制取乙烯、乙炔。主要反应如下:
反应ⅰ: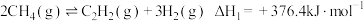
反应ⅱ:
反应ⅲ: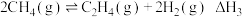
(1)反应ⅲ的焓变
___________ 。
(2)① 温度下,反应ⅰ的
温度下,反应ⅰ的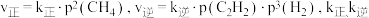 分别为正、逆反应速率常数,部分数据如表所示。
分别为正、逆反应速率常数,部分数据如表所示。
表中
___________ ,该温度下
___________ MPa-3∙min-1。
②反应ⅰ达平衡后,温度由 降到
降到 ,再达平衡,
,再达平衡,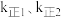 和
和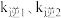 分别代表
分别代表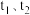 时的正、逆反应速率常数,则
时的正、逆反应速率常数,则
___________ 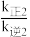 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
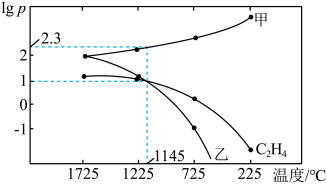
(3)一定温度下,向恒容密闭容器中充入一定量 发生反应,初始压强为
发生反应,初始压强为 ,体系中含碳元素气体平衡分压的对数与温度的关系如图所示(已知:
,体系中含碳元素气体平衡分压的对数与温度的关系如图所示(已知: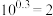 )。曲线乙表示物质为
)。曲线乙表示物质为___________ (填化学式),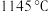 时
时 的平衡转化率为
的平衡转化率为___________ (保留1位小数),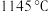 时反应ⅲ的
时反应ⅲ的
___________ 。
反应ⅰ:
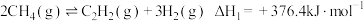
反应ⅱ:

反应ⅲ:
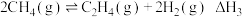
(1)反应ⅲ的焓变

(2)①
 温度下,反应ⅰ的
温度下,反应ⅰ的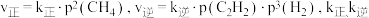 分别为正、逆反应速率常数,部分数据如表所示。
分别为正、逆反应速率常数,部分数据如表所示。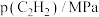 | 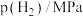 | 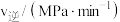 |
| 0.05 |  | 4 |
 | 1 | 2.4 |
 |  | 16 |
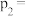
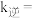
②反应ⅰ达平衡后,温度由
 降到
降到 ,再达平衡,
,再达平衡,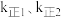 和
和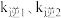 分别代表
分别代表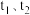 时的正、逆反应速率常数,则
时的正、逆反应速率常数,则
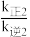 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)一定温度下,向恒容密闭容器中充入一定量
 发生反应,初始压强为
发生反应,初始压强为 ,体系中含碳元素气体平衡分压的对数与温度的关系如图所示(已知:
,体系中含碳元素气体平衡分压的对数与温度的关系如图所示(已知: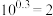 )。曲线乙表示物质为
)。曲线乙表示物质为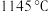 时
时 的平衡转化率为
的平衡转化率为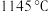 时反应ⅲ的
时反应ⅲ的

您最近一年使用:0次
2023-10-04更新
|
93次组卷
|
2卷引用:江西省百师联盟2023-2024学年高三开学考试化学试题
名校
解题方法
2 . 到目前为止,约90%的工业产品是借助催化剂(工业上也称为触媒)生产出来的,催化剂解决了现代人类衣食住行中的许多问题。催化剂的研发具有重大的科学意义。
I.铁触媒催化合成氨的反应可表示为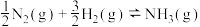 ,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。
,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。

(1)下列有关叙述正确的有___________(填代号)。
II.基元反应的过渡态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,称为过渡态,示意如下:

(2)一溴甲烷与NaOH溶液反应的历程可以表示为:

___________
III.降低CO2浓度,维持地球大气中CO2平衡,是当前的一项重要科研工程。我国力争于2030年前做到碳达峰,2060年前实现碳中和。有科学家提出以CO2与H2为原料,在催化剂作用下生成化工原料乙烯,反应原理如下:
2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g) 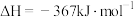
(3)已知上述反应中,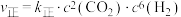 ,
, (
( 、
、 为速率常数,只与温度有关),反应在
为速率常数,只与温度有关),反应在 时达到平衡,已知
时达到平衡,已知 ,则该反应的平衡常数
,则该反应的平衡常数
___________ ; 下该反应达平衡时,若
下该反应达平衡时,若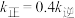 ,则
,则
___________  (填“>”或“<”)。
(填“>”或“<”)。
(4)已知(4)中反应可能伴随有以下副反应:

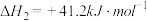
在恒压密闭容器中,CO2与H2的起始浓度一定的条件下,催化反应在相同时间内,测得不同温度下乙烯的产率如图中实线所示(图中虚线表示相同条件下乙烯的平衡产率随温度的变化):
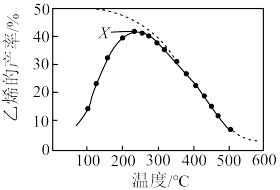
①一定温度下,乙烯的产率达到X点时,v(正)___________ v(逆)(选填“<”、“>”或“=”)。
②X点后乙烯的产率变小的原因可能是___________ 、___________ (写出两条即可)。
③工业生产中通常采用在一定条件下增大压强的方法来提高CO2的平衡转化率,从而提高乙烯的平衡产率,却意外发现的CO的平衡产率也显著提高了,请根据平衡移动原理解释其原因___________ 。
I.铁触媒催化合成氨的反应可表示为
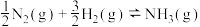 ,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。
,该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。
(1)下列有关叙述正确的有___________(填代号)。
A. 分子中的 分子中的 键强度比 键强度比 键高 键高 |
| B.反应物分子被吸附到催化剂表面是一个放热过程 |
C.反应 在历程中速率最慢 在历程中速率最慢 |
D.反应 的 的 |
II.基元反应的过渡态理论认为,基元反应在从反应物到生成物的变化过程中要经历一个中间状态,称为过渡态,示意如下:

(2)一溴甲烷与NaOH溶液反应的历程可以表示为:

III.降低CO2浓度,维持地球大气中CO2平衡,是当前的一项重要科研工程。我国力争于2030年前做到碳达峰,2060年前实现碳中和。有科学家提出以CO2与H2为原料,在催化剂作用下生成化工原料乙烯,反应原理如下:
2CO2(g)+6H2(g)
 CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g) 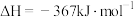
(3)已知上述反应中,
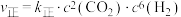 ,
, (
( 、
、 为速率常数,只与温度有关),反应在
为速率常数,只与温度有关),反应在 时达到平衡,已知
时达到平衡,已知 ,则该反应的平衡常数
,则该反应的平衡常数
 下该反应达平衡时,若
下该反应达平衡时,若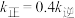 ,则
,则
 (填“>”或“<”)。
(填“>”或“<”)。(4)已知(4)中反应可能伴随有以下副反应:

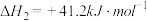
在恒压密闭容器中,CO2与H2的起始浓度一定的条件下,催化反应在相同时间内,测得不同温度下乙烯的产率如图中实线所示(图中虚线表示相同条件下乙烯的平衡产率随温度的变化):

①一定温度下,乙烯的产率达到X点时,v(正)
②X点后乙烯的产率变小的原因可能是
③工业生产中通常采用在一定条件下增大压强的方法来提高CO2的平衡转化率,从而提高乙烯的平衡产率,却意外发现的CO的平衡产率也显著提高了,请根据平衡移动原理解释其原因
您最近一年使用:0次
名校
3 . 在密闭容器中充入1molX和1molY,发生反应: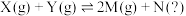 ,测得平衡混合物中M的体积分数在不同压强下随温度的变化情况如图所示。下列说法错误的是
,测得平衡混合物中M的体积分数在不同压强下随温度的变化情况如图所示。下列说法错误的是
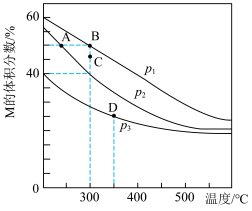
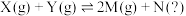 ,测得平衡混合物中M的体积分数在不同压强下随温度的变化情况如图所示。下列说法错误的是
,测得平衡混合物中M的体积分数在不同压强下随温度的变化情况如图所示。下列说法错误的是
| A.在该反应条件下N为气体 |
B.A、B、D三点平衡常数,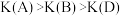 |
C.温度为300℃、压强为 条件下,X的平衡转化率为50% 条件下,X的平衡转化率为50% |
D.温度为300℃、压强为 条件下,C点v(正)>v(逆) 条件下,C点v(正)>v(逆) |
您最近一年使用:0次
4 . 工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应: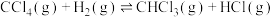 ,使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
,使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
(1)此反应在110℃时平衡常数为___________ 。
(2)实验l中,CCl4的转化率为___________ 。
(3)判断该反应的正反应是___________ (填“放热”或“吸热”),理由是___________ 。
(4)为提高实验3中CCl4的转化率,可采取的措施是___________ 。
a.使用高效催化剂
b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃
d.向容器中再投入1mol HCl
e.向容器中再投入1mol H2
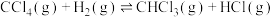 ,使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
,使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:| 实验序号 | 温度℃ | 初始n(CCl4)(mol) | 初始n(H2)(mol) | 平衡时n(CHCl3)(mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
(2)实验l中,CCl4的转化率为
(3)判断该反应的正反应是
(4)为提高实验3中CCl4的转化率,可采取的措施是
a.使用高效催化剂
b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃
d.向容器中再投入1mol HCl
e.向容器中再投入1mol H2
您最近一年使用:0次
名校
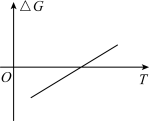
5 . 一定温度和压强下,在催化剂作用下可发生反应: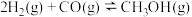 。该反应的自由能(
。该反应的自由能(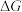 )与温度(T)的关系如图所示。已知:分压=总压
)与温度(T)的关系如图所示。已知:分压=总压 物质的量分数,浓度平衡常数用K表示。下列说法正确的是
物质的量分数,浓度平衡常数用K表示。下列说法正确的是
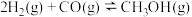 。该反应的自由能(
。该反应的自由能(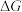 )与温度(T)的关系如图所示。已知:分压=总压
)与温度(T)的关系如图所示。已知:分压=总压 物质的量分数,浓度平衡常数用K表示。下列说法正确的是
物质的量分数,浓度平衡常数用K表示。下列说法正确的是
A.增大CO的浓度, 和K均增大 和K均增大 |
| B.加入更多的固体酸催化剂,有利于提高甲醇的平衡产率 |
C.由图像可知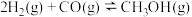  |
D.当反应达到平衡状态时,体系的总压强为p,其中 、 、 、 、 的物质的量均为 的物质的量均为 ,则用分压表示的平衡常数为 ,则用分压表示的平衡常数为 |
您最近一年使用:0次
2023-10-03更新
|
138次组卷
|
3卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期第一次月考化学试题
名校
6 . 一定温度下,在恒容密闭容器中发生反应: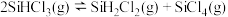 。
。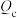 表示某时刻的浓度商,K为该温度下的平衡常数。下列情况能说明该反应一定达到化学平衡状态的是
表示某时刻的浓度商,K为该温度下的平衡常数。下列情况能说明该反应一定达到化学平衡状态的是
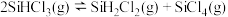 。
。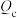 表示某时刻的浓度商,K为该温度下的平衡常数。下列情况能说明该反应一定达到化学平衡状态的是
表示某时刻的浓度商,K为该温度下的平衡常数。下列情况能说明该反应一定达到化学平衡状态的是A. |
| B.体系内物质的总质量保持不变 |
C. 、 、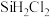 、 、 同时在容器中存在 同时在容器中存在 |
D.单位时间内消耗  ,同时生成 ,同时生成 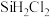 |
您最近一年使用:0次
2023-10-03更新
|
112次组卷
|
4卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期第一次月考化学试题
河北省邢台市五岳联盟2023-2024学年高二上学期第一次月考化学试题河北省邢台市五岳联盟2023-2024学年高二上学期11月期中考试化学试题河南省新乡市2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
7 . 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在体积为2L的密闭中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)。在体积为2L的密闭中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

(1)该反应的平衡常数K表达式为_____ 。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_____ ,H2的转化率为_____ 。
(3)下列叙述中,能说明反应已达到化学平衡状态的是_____ 。(填字母)
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1:3:1:1
B.v(CO2)正:v(H2)逆=1:3
C.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-1452.8kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ•mol-1
③CH3OH(1)+O2(g)=2H2O(1)+CO(g) △H
则△H=_____ kJ/mol
 CH3OH(g)+H2O(g)。在体积为2L的密闭中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)。在体积为2L的密闭中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
(1)该反应的平衡常数K表达式为
(2)0~10min时间内,该反应的平均反应速率v(H2O)=
(3)下列叙述中,能说明反应已达到化学平衡状态的是
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1:3:1:1
B.v(CO2)正:v(H2)逆=1:3
C.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-1452.8kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ•mol-1
③CH3OH(1)+O2(g)=2H2O(1)+CO(g) △H
则△H=
您最近一年使用:0次
名校
解题方法
8 . 在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 ,该反应的方程式为
,该反应的方程式为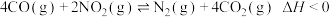
(1)现向某密闭容器中充入等物质的量浓度的 和
和 气体,维持恒温恒容,在倠化剂作用下发生反应。相关数据如下:
气体,维持恒温恒容,在倠化剂作用下发生反应。相关数据如下:
在0~ 内,以
内,以 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为______ ,在 时,
时, 的转化率为
的转化率为______ 。此温度下,该反应的化学平衡常数
______ (保留两位有效数字)。
(2)该反应的正、逆反应的平衡常数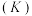 与温度
与温度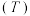 的关系如图所示,其中表示正反应的平衡常数
的关系如图所示,其中表示正反应的平衡常数 的是
的是______ (选“A”或“B”),原因是______ 。

 能催化
能催化 与
与 反应生成
反应生成 ,该反应的方程式为
,该反应的方程式为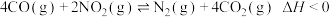
(1)现向某密闭容器中充入等物质的量浓度的
 和
和 气体,维持恒温恒容,在倠化剂作用下发生反应。相关数据如下:
气体,维持恒温恒容,在倠化剂作用下发生反应。相关数据如下:
|
|
|
|
| |
| 2.0 | 1.7 | 0.56 | 1.5 | 1.5 |
| 0 | 0.15 | 0.22 | 0.25 | 0.25 |
 内,以
内,以 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为 时,
时, 的转化率为
的转化率为
(2)该反应的正、逆反应的平衡常数
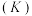 与温度
与温度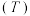 的关系如图所示,其中表示正反应的平衡常数
的关系如图所示,其中表示正反应的平衡常数 的是
的是
您最近一年使用:0次
名校
解题方法
9 . 下列图示与对应叙述不相符的是
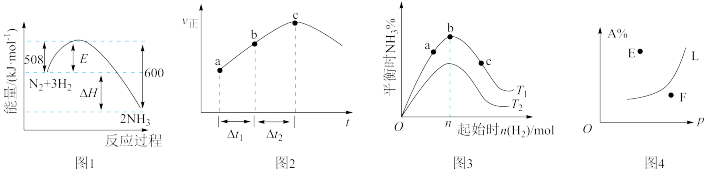

A.图1升高温度时,反应 的平衡常数会减小 的平衡常数会减小 |
B.图2为在绝热恒容密闭容器中,反应 的正反应速率随时间变化的示意图,由图可知该反应为放热反应 的正反应速率随时间变化的示意图,由图可知该反应为放热反应 |
C.图3为合成氨反应中,其它条件不变时,起始时 用量对反应的影响图,则图中温度 用量对反应的影响图,则图中温度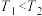 ,a、b、c三点所处的平衡状态中,反应物 ,a、b、c三点所处的平衡状态中,反应物 的转化率最高的是b点 的转化率最高的是b点 |
D.图4中,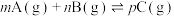 ,则E点 ,则E点 |
您最近一年使用:0次
名校
解题方法
10 . 在0.1MPa时,按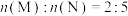 投料,密闭恒压容器中发生反应
投料,密闭恒压容器中发生反应
 ,平衡时各物质的物质的量(n)与温度(T)的关系如图所示。下列有关说法正确的是
,平衡时各物质的物质的量(n)与温度(T)的关系如图所示。下列有关说法正确的是

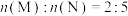 投料,密闭恒压容器中发生反应
投料,密闭恒压容器中发生反应
 ,平衡时各物质的物质的量(n)与温度(T)的关系如图所示。下列有关说法正确的是
,平衡时各物质的物质的量(n)与温度(T)的关系如图所示。下列有关说法正确的是
A.该反应逆反应的 |
| B.曲线b表示的物质为M |
C.温度升高,平衡常数 增大 增大 |
| D.不断分离出P,可以提高M的转化率 |
您最近一年使用:0次