解题方法
1 . 实验室以碳酸铈[ ]为原料制备氧化铈(
]为原料制备氧化铈( )粉末,部分实验过程如下:
)粉末,部分实验过程如下:
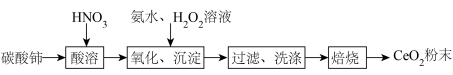
已知: 难溶于稀硝酸;
难溶于稀硝酸; 极易水解,酸性较强时有强氧化性。
极易水解,酸性较强时有强氧化性。
(1)“氧化、沉淀”过程
①向酸溶后的溶液中加入氨水和 溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[
溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[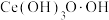 ]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[
]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[ ]。反应生成过氧化铈的离子方程式为
]。反应生成过氧化铈的离子方程式为___________ 。
②双氧水与氨水的加入量之比对 氧化率的影响如图所示,
氧化率的影响如图所示, 与
与 物质的量之比大于1.20时,
物质的量之比大于1.20时, 氧化率下降的原因是
氧化率下降的原因是___________ 。
(2)“过滤、洗涤”过程
①“过滤”需用到的玻璃仪器有烧杯、漏斗和___________ 。
②“洗涤”的实验操作是___________ 。
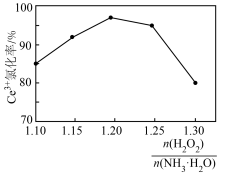
(3)“焙烧”过程
焙烧 过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为
过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为___________ (写出确定物质化学式的计算过程)。
(4)由稀土碳酸盐获取
以稀土碳酸盐样品[含有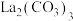 、
、 和可溶性
和可溶性 ]为原料可获得纯净的
]为原料可获得纯净的 请补充实验方案:向稀土碳酸盐样品中
请补充实验方案:向稀土碳酸盐样品中______ ,烘干,得到 固体。[已知:
固体。[已知: 不与
不与 反应;
反应; 、
、 开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1
开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1 氨水、30%
氨水、30% 溶液、2
溶液、2
 溶液、2mol·L-1HCl溶液、1mol·L-1
溶液、2mol·L-1HCl溶液、1mol·L-1 溶液、去离子水]
溶液、去离子水]
 ]为原料制备氧化铈(
]为原料制备氧化铈( )粉末,部分实验过程如下:
)粉末,部分实验过程如下:
已知:
 难溶于稀硝酸;
难溶于稀硝酸; 极易水解,酸性较强时有强氧化性。
极易水解,酸性较强时有强氧化性。(1)“氧化、沉淀”过程
①向酸溶后的溶液中加入氨水和
 溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[
溶液,维持pH为5~6充分反应,生成胶状红褐色过氧化铈[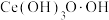 ]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[
]沉淀,加热煮沸,过氧化铈转化为黄色氢氧化铈[ ]。反应生成过氧化铈的离子方程式为
]。反应生成过氧化铈的离子方程式为②双氧水与氨水的加入量之比对
 氧化率的影响如图所示,
氧化率的影响如图所示, 与
与 物质的量之比大于1.20时,
物质的量之比大于1.20时, 氧化率下降的原因是
氧化率下降的原因是
(2)“过滤、洗涤”过程
①“过滤”需用到的玻璃仪器有烧杯、漏斗和
②“洗涤”的实验操作是
(3)“焙烧”过程
焙烧
 过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为
过程中测得剩余固体质量与起始固体质量的比值随温度变化的曲线如图所示。则301~317℃范围内,B→C发生反应的化学方程式为
(4)由稀土碳酸盐获取

以稀土碳酸盐样品[含有
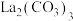 、
、 和可溶性
和可溶性 ]为原料可获得纯净的
]为原料可获得纯净的 请补充实验方案:向稀土碳酸盐样品中
请补充实验方案:向稀土碳酸盐样品中 固体。[已知:
固体。[已知: 不与
不与 反应;
反应; 、
、 开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1
开始转化为氢氧化物沉淀的pH分别为7.8、7.6;可选用的试剂有:1 氨水、30%
氨水、30% 溶液、2
溶液、2
 溶液、2mol·L-1HCl溶液、1mol·L-1
溶液、2mol·L-1HCl溶液、1mol·L-1 溶液、去离子水]
溶液、去离子水]
您最近一年使用:0次
解题方法
2 . 氮是空气中含量最多的元素,在自然界中的存在十分广泛,实验小组对不同含氮物质做了相关研究。
(1)乙二胺(H2NCH2CH2NH2)是二元弱碱,分步电离,在溶液中的电离类似于氨。 时,乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液
时,乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液 的变化曲线如图所示。
的变化曲线如图所示。
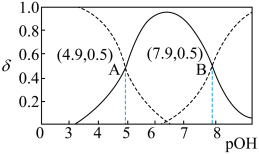
①H2NCH2CH2NH2在水溶液中第一步电离的方程式为___________ 。
②乙二胺一级电离平衡常数。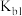 为
为___________ 。
(2)工业上利用氨气脱硝反应,实现二者的无害化处理,已知下列反应:
①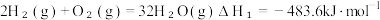
②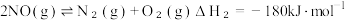
③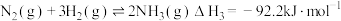
则 6NO(g)+4NH3(g) 6H2O(g)+5N2(g)
6H2O(g)+5N2(g) 
___________ 。
(3)氨气常被用于对汽车尾气中的氮氧化物进行无害化处理,以消除其对空气的污染。去除NO的反应历程如图1所示,此反应中的氧化剂为___________ (填化学式),含铁元素的中间产物有___________ 种。
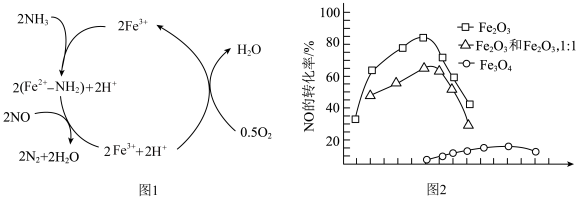
若选用不同的铁的氧化物为催化剂可实现较低温度下的转化,根据图 2选择的适宜条件为___________ 。
(4)利用电化学原理脱硝可同时获得电能,其工作原理如图所示。则负极发生的电极反应式为___________ ,当外电路中有2mol电子通过时,理论上通过质子膜的微粒的物质的量为___________ 。
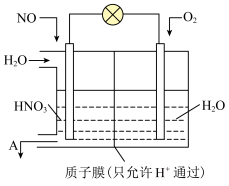
(1)乙二胺(H2NCH2CH2NH2)是二元弱碱,分步电离,在溶液中的电离类似于氨。
 时,乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液
时,乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液 的变化曲线如图所示。
的变化曲线如图所示。
①H2NCH2CH2NH2在水溶液中第一步电离的方程式为
②乙二胺一级电离平衡常数。
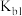 为
为(2)工业上利用氨气脱硝反应,实现二者的无害化处理,已知下列反应:
①
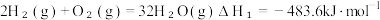
②
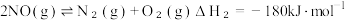
③
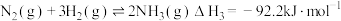
则 6NO(g)+4NH3(g)
 6H2O(g)+5N2(g)
6H2O(g)+5N2(g) 
(3)氨气常被用于对汽车尾气中的氮氧化物进行无害化处理,以消除其对空气的污染。去除NO的反应历程如图1所示,此反应中的氧化剂为

若选用不同的铁的氧化物为催化剂可实现较低温度下的转化,根据图 2选择的适宜条件为
(4)利用电化学原理脱硝可同时获得电能,其工作原理如图所示。则负极发生的电极反应式为

您最近一年使用:0次
名校
解题方法
3 . 通过对阳极泥的综合处理可以回收贵重金属,一种从铜阳极泥(主要成分为Se、Ag、Ag2Se、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
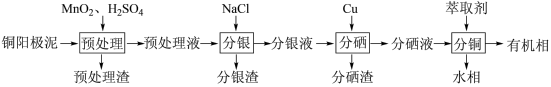
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为_______ 。
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是_______ 。
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:_______ 。
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++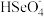 ,
,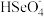
 H++
H++ ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K(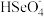 )=
)=_______ (写出含x的计算式)。
(5)分铜得到产品CuSO4·5H2O的具体操作如图:
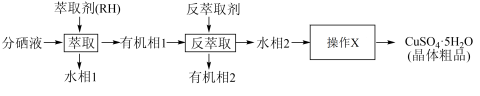
①萃取的原理为:2RH+Cu2+ R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用_______ (填化学式)溶液。
②操作X为_______ ,过滤;
③为了减少CuSO4·5H2O的损失,最好选用_______ 进行洗涤。
A.冷水 B.热水 C.无水乙醇
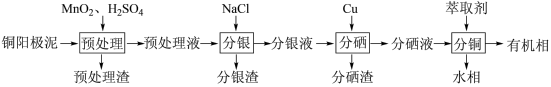
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++
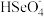 ,
,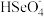
 H++
H++ ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K(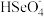 )=
)=(5)分铜得到产品CuSO4·5H2O的具体操作如图:

①萃取的原理为:2RH+Cu2+
 R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用②操作X为
③为了减少CuSO4·5H2O的损失,最好选用
A.冷水 B.热水 C.无水乙醇
您最近一年使用:0次
名校
4 . 新能源是未来能源发展的方向,积极发展氢能是实现“碳达峰、碳中和”的重要举措。
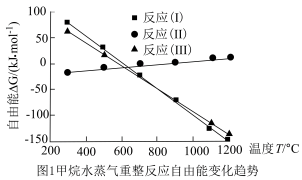
(1)近年来CH4-H2O催化重整制氢是氢能源获取的重要途径,主要反应如下:
反应I:CH4(g)+H2O(g) 3H2(g)+CO(g) ΔH1
3H2(g)+CO(g) ΔH1
反应II:CO(g)+H2O(g) H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2
反应III:CH4(g)+2H2O(g) 4H2(g)+CO2(g) ΔH3
4H2(g)+CO2(g) ΔH3
甲烷水蒸气重整过程中自由能(ΔG=ΔH-TΔS,设ΔH和ΔS不随温度变化)随温度变化趋势如图1所示:_______ 0,ΔH2________ 0(填“>”或“<”)。
②1.01×105Pa下,将n起始(CH4):n起始(H2O)=1:1的混合气体置于密闭容器中,研究发现不同温度下重整体系中,800℃下H2平衡产率远大于600℃下H2平衡产率,其原因是_______ 。
(2)硼氢化钠(NaBH4)是一种高效储氢材料,25℃时NaBH4在掺杂了MoO3的纳米Co2B合金催化剂表面活性位点水解制氢的机理如图2所示:________ (用元素符号表示)。
②写出NaBH4与水反应生成NaBO2和H2的离子方程式________ ;并分析掺杂MoO3能提高制H2效率的原因________ 。
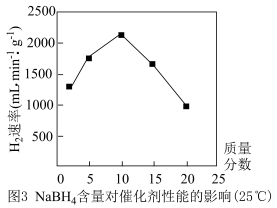
③已知25℃时NaBO2和NaBH4在水中的溶解度分别为28g和55g,NaBH4浓度对制H2速率影响如图3所示,NaBH4制H2的最佳浓度为10%,试分析浓度过低或过高反应速率变慢的原因_______ 。
(1)近年来CH4-H2O催化重整制氢是氢能源获取的重要途径,主要反应如下:
反应I:CH4(g)+H2O(g)
 3H2(g)+CO(g) ΔH1
3H2(g)+CO(g) ΔH1反应II:CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2反应III:CH4(g)+2H2O(g)
 4H2(g)+CO2(g) ΔH3
4H2(g)+CO2(g) ΔH3甲烷水蒸气重整过程中自由能(ΔG=ΔH-TΔS,设ΔH和ΔS不随温度变化)随温度变化趋势如图1所示:
②1.01×105Pa下,将n起始(CH4):n起始(H2O)=1:1的混合气体置于密闭容器中,研究发现不同温度下重整体系中,800℃下H2平衡产率远大于600℃下H2平衡产率,其原因是
(2)硼氢化钠(NaBH4)是一种高效储氢材料,25℃时NaBH4在掺杂了MoO3的纳米Co2B合金催化剂表面活性位点水解制氢的机理如图2所示:
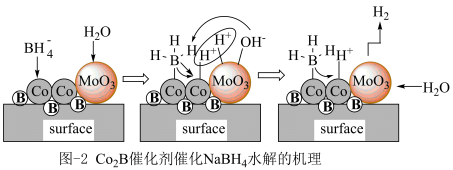
②写出NaBH4与水反应生成NaBO2和H2的离子方程式
③已知25℃时NaBO2和NaBH4在水中的溶解度分别为28g和55g,NaBH4浓度对制H2速率影响如图3所示,NaBH4制H2的最佳浓度为10%,试分析浓度过低或过高反应速率变慢的原因
您最近一年使用:0次
2023-11-08更新
|
479次组卷
|
2卷引用:江苏省前黄高级中学2023-2024学年高三上学期期中适应性考试化学试题
解题方法
5 . 锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
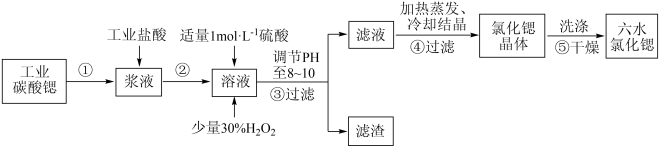
回答下列问题:
(1)为了加速碳酸锶粉末的溶解,常采用的方法有___________ (写两条即可)
(2)常温下,氯化锶溶液pH___________ 7(已知金属性Ca<Sr)(填“>”“=”或“<”)
(3)写出在浆液中加入盐酸时主要发生的离子方程式:___________ 。
(4)步骤③所得滤渣的主要成分为___________ (填化学式),调节溶液pH至8~10,宜选用的试剂为___________ (填标号)。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(5)步骤⑤中,洗涤氯化锶晶体最好选用___________(填标号)。
(6)工业上用热风吹干六水氯化锶,选择的适宜温度范围为___________(填标号)。

回答下列问题:
(1)为了加速碳酸锶粉末的溶解,常采用的方法有
(2)常温下,氯化锶溶液pH
(3)写出在浆液中加入盐酸时主要发生的离子方程式:
(4)步骤③所得滤渣的主要成分为
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(5)步骤⑤中,洗涤氯化锶晶体最好选用___________(填标号)。
| A.水 | B.稀硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
(6)工业上用热风吹干六水氯化锶,选择的适宜温度范围为___________(填标号)。
| A.50~60℃ | B.70~80℃ | C.80~100℃ | D.100℃以上 |
您最近一年使用:0次
解题方法
6 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
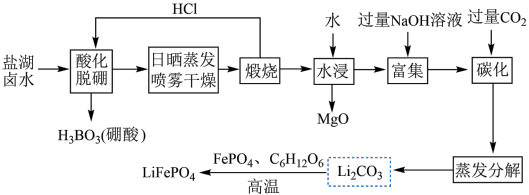
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
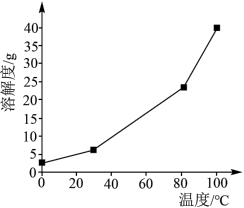
已知: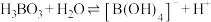
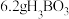 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
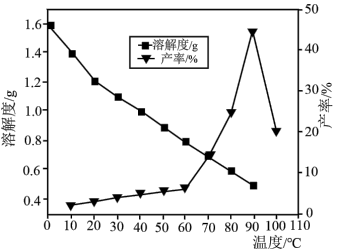
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
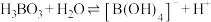
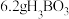 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023高三·全国·专题练习
7 . 氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
常温下,大气固氮的倾向___________ 工业固氮(填“大于”或“小于”)。
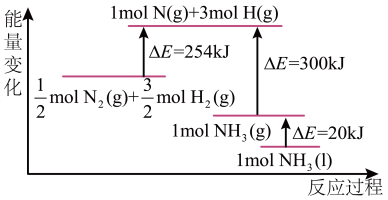
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g)反应制备NH3(l)的热化学方程式为:___________ 。
(3)T ℃时,在2 L恒容密闭容器中加入1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示:
2NH3(g)],体系中n(NH3)随时间的变化如图所示:
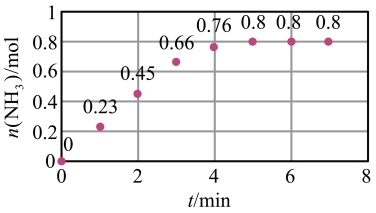
①前2分钟内的平均反应速率v(NH3)=___________ mol·L-1·min-1;
②有关工业固氮的说法正确的是___________ (选填序号)。
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500 ℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
③T ℃时,该反应的平衡常数为___________ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 ___________ (填化学式)。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2 000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g)反应制备NH3(l)的热化学方程式为:

(3)T ℃时,在2 L恒容密闭容器中加入1.2 mol N2和2 mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示:
2NH3(g)],体系中n(NH3)随时间的变化如图所示:
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用催化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500 ℃左右有利于反应向正方向进行
D.增大压强有利于加快反应速率,所以压强越大越好
③T ℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
名校
8 . 如下图所示为工业合成氨的流程图。下列说法不正确的是
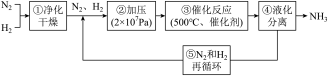

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.为提高反应物的转化率应及时将氨从混合气中分离出去 |
您最近一年使用:0次
2023-10-26更新
|
331次组卷
|
7卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
解题方法
9 . 下列事实不能用勒夏特列原理解释的是
| A.向溴水中加入少量的硝酸银溶液后,溶液的颜色变浅 |
| B.重铬酸钾溶液中滴加氢氧化钠溶液,溶液由橙色变为黄色 |
| C.氯水宜保存在低温、避光的条件下 |
| D.500℃左右比室温更有利于合成氨的反应 |
您最近一年使用:0次
解题方法
10 . 下列说法正确的是
A.明矾和 均可用作水处理剂,其作用机理完全相同 均可用作水处理剂,其作用机理完全相同 |
| B.电解法精炼镍时,粗镍作阴极,纯镍作阳极 |
| C.当温度、压强一定时,在合成氨的原料气中添加少量惰性气体,有利于提高反应气的平衡转化率 |
D.同温同压下,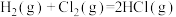 在光照和点燃条件下的ΔH相同 在光照和点燃条件下的ΔH相同 |
您最近一年使用:0次



