1 . 某化学小组制取无水三氯化铁并研究其与铜的反应,设计如下实验。
I.制备无水三氯化铁实验装置如图。(已知无水三氯化铁易潮解,100℃左右升华)___________ 。
(2)整个装置充满黄绿色气体后,才开始加热D装置的目的是___________ 。
(3)若实验过程中三氯化铁沉积在D与E的导管之间,导致导管内径变小,除去沉积的三氯化铁的简易操作是___________ ;此装置存在明显的缺陷,你的改进方案是___________ 。
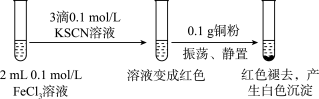
II.探究三氯化铁与铜反应的实验如图:(已知:KSCN中的C为+4价)___________ 。
(5)为了进一步研究白色沉淀进行如图实验。___________ (填化学式)。
②白色沉淀之一(用D表示)与过量稀硝酸反应生成白色沉淀B含有阴离子,同时生成 、NO、
、NO、 气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
气体。D与硝酸反应中还原剂与氧化剂物质的量之比为___________ 。
I.制备无水三氯化铁实验装置如图。(已知无水三氯化铁易潮解,100℃左右升华)
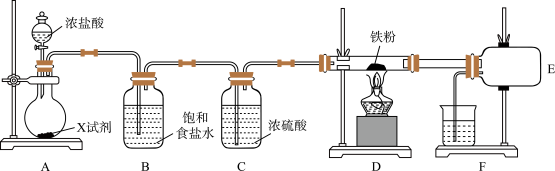
(2)整个装置充满黄绿色气体后,才开始加热D装置的目的是
(3)若实验过程中三氯化铁沉积在D与E的导管之间,导致导管内径变小,除去沉积的三氯化铁的简易操作是
II.探究三氯化铁与铜反应的实验如图:(已知:KSCN中的C为+4价)
(5)为了进一步研究白色沉淀进行如图实验。
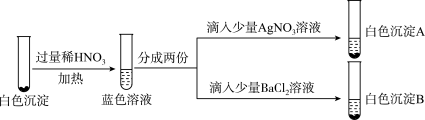
②白色沉淀之一(用D表示)与过量稀硝酸反应生成白色沉淀B含有阴离子,同时生成
 、NO、
、NO、 气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 达成“双碳”目标的重要途径是实现碳的固定。利用CO、 和
和 可以合成生物质能源甲醇:
可以合成生物质能源甲醇:
反应1:
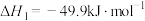
反应2:

反应3:
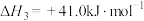
回答下列问题:
(1)反应1在___________ (填“较高温度”“较低温度”或“任何温度”)下能自发进行。
(2)
___________  。
。
(3)T℃时,向一恒容密闭容器中仅充入1molCO(g)和 ,仅发生反应2。下列叙述错误的是___________(填标号)。
,仅发生反应2。下列叙述错误的是___________(填标号)。
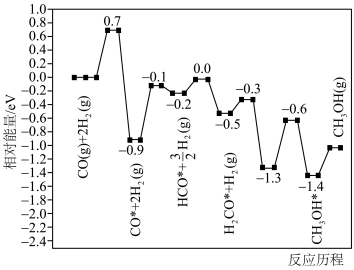
(4)在某催化剂作用下,反应2的历程如图所示(图中数据表示微粒的相对能量,*表示吸附在催化剂表面上)。___________ 。
(5)在某催化剂作用下,只发生反应: 。该反应的速率方程式为
。该反应的速率方程式为 ,
,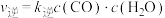 (k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
(k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
________ (填“>”“<”或“=”,下同) ,900℃时
,900℃时
________  。
。
(6) 时,在密闭容器甲、乙中,分别充入
时,在密闭容器甲、乙中,分别充入 和
和 ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得 平衡转化率与压强关系如图所示。
平衡转化率与压强关系如图所示。___________ (填“甲”或“乙”)。
②平衡常数
___________ (填“>”“<”或“=”) ,M点
,M点
___________ kPa。
(7) 时,向一体积为1L的恒容密闭容器中充入1molCO、
时,向一体积为1L的恒容密闭容器中充入1molCO、 和
和 ,在一定条件下发生上述3个反应,达到平衡时得到
,在一定条件下发生上述3个反应,达到平衡时得到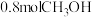 和
和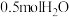 ,此时
,此时 平衡转化率为50%。该温度下,反应1的平衡常数K=
平衡转化率为50%。该温度下,反应1的平衡常数K=___________  。(列出计算式)
。(列出计算式)
 和
和 可以合成生物质能源甲醇:
可以合成生物质能源甲醇:反应1:

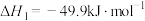
反应2:


反应3:

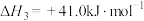
回答下列问题:
(1)反应1在
(2)

 。
。(3)T℃时,向一恒容密闭容器中仅充入1molCO(g)和
 ,仅发生反应2。下列叙述错误的是___________(填标号)。
,仅发生反应2。下列叙述错误的是___________(填标号)。| A.加入催化剂,反应速率增大 |
| B.CO体积分数不变时,反应达到平衡状态 |
| C.平衡后,充入氩气,平衡正向移动 |
D.平衡后,充入 ,CO平衡转化率增大 ,CO平衡转化率增大 |
(4)在某催化剂作用下,反应2的历程如图所示(图中数据表示微粒的相对能量,*表示吸附在催化剂表面上)。
(5)在某催化剂作用下,只发生反应:
 。该反应的速率方程式为
。该反应的速率方程式为 ,
,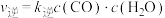 (k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
(k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
 ,900℃时
,900℃时
 。
。(6)
 时,在密闭容器甲、乙中,分别充入
时,在密闭容器甲、乙中,分别充入 和
和 ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得 平衡转化率与压强关系如图所示。
平衡转化率与压强关系如图所示。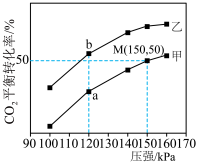
②平衡常数

 ,M点
,M点
(7)
 时,向一体积为1L的恒容密闭容器中充入1molCO、
时,向一体积为1L的恒容密闭容器中充入1molCO、 和
和 ,在一定条件下发生上述3个反应,达到平衡时得到
,在一定条件下发生上述3个反应,达到平衡时得到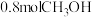 和
和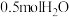 ,此时
,此时 平衡转化率为50%。该温度下,反应1的平衡常数K=
平衡转化率为50%。该温度下,反应1的平衡常数K= 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
2024-02-25更新
|
759次组卷
|
6卷引用:2024届陕西省安康市高三下学期一模考试理科综合试题-高中化学
2024届陕西省安康市高三下学期一模考试理科综合试题-高中化学2024届陕西省西安博爱国际学校高三下学期第一次模拟考试理科综合试卷-高中化学甘肃省白银市名校2023-2024学年高三下学期联合调研化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)甘肃省天水市麦积区2024届高三下学期2月第二次模拟检测化学试题湖南省衡阳市第八中学2024届高三下学期高考模拟预测化学试题
名校
解题方法
3 . 汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。
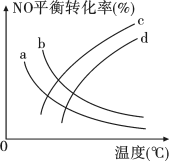
(1)用CO可将汽车尾气中的NO还原为 。探究温度、压强(2MPa、5MPa)对反应
。探究温度、压强(2MPa、5MPa)对反应
 的影响,如图所示,表示2MPa的是反应
的影响,如图所示,表示2MPa的是反应___________ (填字母)。
(2)一定温度下向容积为 的密闭容器中加入
的密闭容器中加入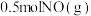 、
、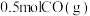 ,此时容器总压为
,此时容器总压为 ,发生反应
,发生反应 ,
, 时反应达到平衡,此时测得
时反应达到平衡,此时测得 的物质的量为
的物质的量为 ,则
,则 内
内
___________ mol∙L-1∙min-1;该反应的 为
为___________ 。[标准平衡常数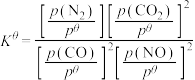 ,其中
,其中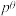 为标准压强(
为标准压强( ),
), 、
、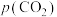 、
、 和
和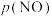 为各组分的平衡分压[已知
为各组分的平衡分压[已知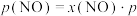 ,其中
,其中 为平衡总压,
为平衡总压, 为平衡系统中
为平衡系统中 的物质的量分数]
的物质的量分数]
(3)用 可催化消除
可催化消除 污染:
污染: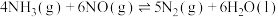
 。该反应速率
。该反应速率 ,
,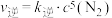 ,该反应的平衡常数
,该反应的平衡常数
___________ (用含 、
、 的式子表示)若将
的式子表示)若将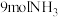 和
和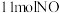 投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下
投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下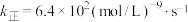 ,平衡时
,平衡时 的转化率为
的转化率为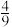 ,
,
___________  。
。
(4)在恒容、 和
和 的起始浓度一定的条件下,分别以VWTi/AC0、VWTi/AC10、VWTi/AC50、VWTi/AC70为催化剂,发生反应:
的起始浓度一定的条件下,分别以VWTi/AC0、VWTi/AC10、VWTi/AC50、VWTi/AC70为催化剂,发生反应:
 ,相同时间内测得不同温度下
,相同时间内测得不同温度下 转化为
转化为 的转化率如图a所示,温度升高有副产物
的转化率如图a所示,温度升高有副产物 生成,测得不同温度
生成,测得不同温度 的生成量如图b所示。
的生成量如图b所示。
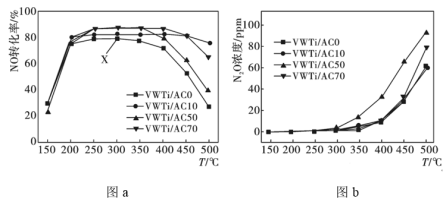
①结合图b分析,VWTi/AC50在 之后NO转化率降低的可能原因是
之后NO转化率降低的可能原因是___________ 。
②图中X点所示条件下,反应向___________ (填“正反应”或“逆反应”)方向移动。
③250℃时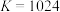 ,若起始时充入
,若起始时充入 ,
,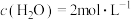 ,则
,则
___________ (填“>”、“<”或“=”) 。
。
(1)用CO可将汽车尾气中的NO还原为
 。探究温度、压强(2MPa、5MPa)对反应
。探究温度、压强(2MPa、5MPa)对反应
 的影响,如图所示,表示2MPa的是反应
的影响,如图所示,表示2MPa的是反应
(2)一定温度下向容积为
 的密闭容器中加入
的密闭容器中加入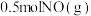 、
、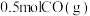 ,此时容器总压为
,此时容器总压为 ,发生反应
,发生反应 ,
, 时反应达到平衡,此时测得
时反应达到平衡,此时测得 的物质的量为
的物质的量为 ,则
,则 内
内
 为
为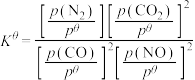 ,其中
,其中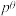 为标准压强(
为标准压强( ),
), 、
、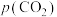 、
、 和
和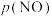 为各组分的平衡分压[已知
为各组分的平衡分压[已知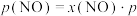 ,其中
,其中 为平衡总压,
为平衡总压, 为平衡系统中
为平衡系统中 的物质的量分数]
的物质的量分数](3)用
 可催化消除
可催化消除 污染:
污染: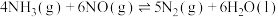
 。该反应速率
。该反应速率 ,
,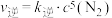 ,该反应的平衡常数
,该反应的平衡常数
 、
、 的式子表示)若将
的式子表示)若将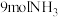 和
和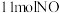 投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下
投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下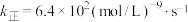 ,平衡时
,平衡时 的转化率为
的转化率为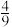 ,
,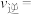
 。
。(4)在恒容、
 和
和 的起始浓度一定的条件下,分别以VWTi/AC0、VWTi/AC10、VWTi/AC50、VWTi/AC70为催化剂,发生反应:
的起始浓度一定的条件下,分别以VWTi/AC0、VWTi/AC10、VWTi/AC50、VWTi/AC70为催化剂,发生反应:
 ,相同时间内测得不同温度下
,相同时间内测得不同温度下 转化为
转化为 的转化率如图a所示,温度升高有副产物
的转化率如图a所示,温度升高有副产物 生成,测得不同温度
生成,测得不同温度 的生成量如图b所示。
的生成量如图b所示。
①结合图b分析,VWTi/AC50在
 之后NO转化率降低的可能原因是
之后NO转化率降低的可能原因是②图中X点所示条件下,反应向
③250℃时
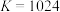 ,若起始时充入
,若起始时充入 ,
,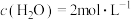 ,则
,则
 。
。
您最近一年使用:0次
名校
解题方法
4 . “碳达峰”“碳中和”是推动我国经济社会高质量发展的内在要求。通过二氧化碳催化加氢合成二甲醚是一种重要的转化方法,其过程如下:
反应Ⅰ:
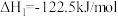
反应Ⅱ:
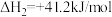
回答下列问题:
(1)二氧化碳与氢气合成CH3OCH3时,通常控制温度为 500℃左右,其可能的原因为_____(填字母)。
(2)在 1L 恒温密闭容器中充入4molCO2和6molH2 ,初始压强为 p,20min 时反应 Ⅰ、Ⅱ都达到平衡状态,体系压强为 0.8p,测得 c(H2O)=3mol/L。
①0~20min 内v(CO)=________ 。
②反应Ⅱ的化学平衡常数Kp=________ 。
③平衡时 CH3OCH3的选择性=________ 。( )
)
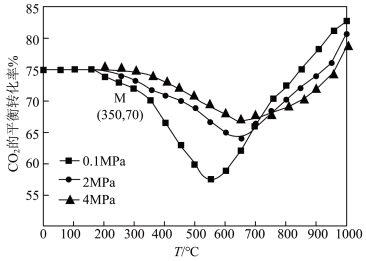
(3)在密闭容器中通入1 nolCO2和3molH2,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于 800℃时,随着压强的增大, CO2的平衡转化率减小,请解释原因:___________ 。
反应Ⅰ:

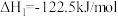
反应Ⅱ:

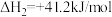
回答下列问题:
(1)二氧化碳与氢气合成CH3OCH3时,通常控制温度为 500℃左右,其可能的原因为_____(填字母)。
| A.反应速率快 | B.平衡的转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
(2)在 1L 恒温密闭容器中充入4molCO2和6molH2 ,初始压强为 p,20min 时反应 Ⅰ、Ⅱ都达到平衡状态,体系压强为 0.8p,测得 c(H2O)=3mol/L。
①0~20min 内v(CO)=
②反应Ⅱ的化学平衡常数Kp=
③平衡时 CH3OCH3的选择性=
 )
)(3)在密闭容器中通入1 nolCO2和3molH2,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于 800℃时,随着压强的增大, CO2的平衡转化率减小,请解释原因:

您最近一年使用:0次
解题方法
5 . 氮和氮的化合物与人类关系密切。已知:
i.
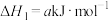
ii.
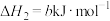
iii.

(1)

___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(2)T℃时,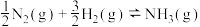
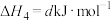 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为___________ ;d=___________ 。
(3)某小组往一恒温恒压含有铁触媒的容器中充入1
 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
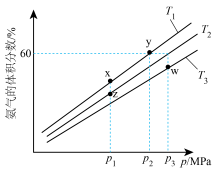
①图中温度 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图中x、y、z、w四点中,化学反应速率最快的是___________ 点。
②y点时, 的平衡转化率为
的平衡转化率为___________ ;在温度 时,该反应的平衡常数
时,该反应的平衡常数
___________  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。
③若在恒容条件下发生该反应,下列说法正确的是___________ (填标号)。
A.温度升高, 将增大
将增大
B.当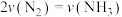 时,反应达到了平衡
时,反应达到了平衡
C.当 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡
D.断裂1
 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡
(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.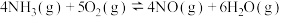
反应II.
测得相同时间内 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
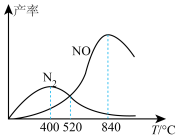
①反应II为___________ (填“放热”或“吸热”)反应。
②随着温度升高, 的产率先增大后减小的原因为
的产率先增大后减小的原因为___________ 。
i.

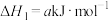
ii.

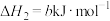
iii.


(1)


 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(2)T℃时,
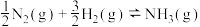
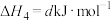 。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
。各步反应的能量变化如图所示,其中吸附在催化剂表面上的物种用“*”标注。图中决速步骤的反应方程式为
(3)某小组往一恒温恒压含有铁触媒的容器中充入1

 和3
和3
 ,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
,模拟合成氨的反应,不同温度下达到平衡时混合物中氨气的体积分数与总压强(p)的关系如图。
①图中温度
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②y点时,
 的平衡转化率为
的平衡转化率为 时,该反应的平衡常数
时,该反应的平衡常数
 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数,用含
为以分压表示的平衡常数,分压=总压×物质的量分数,用含 的式子表示)。
的式子表示)。③若在恒容条件下发生该反应,下列说法正确的是
A.温度升高,
 将增大
将增大B.当
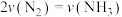 时,反应达到了平衡
时,反应达到了平衡C.当
 的体积分数不再改变时,反应达到了平衡
的体积分数不再改变时,反应达到了平衡D.断裂1

 键的同时断裂6
键的同时断裂6
 键,说明反应达到了平衡
键,说明反应达到了平衡(4)氨的催化氧化过程中同时发生的反应主要如下:
反应I.
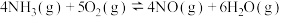
反应II.

测得相同时间内
 、
、 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。
①反应II为
②随着温度升高,
 的产率先增大后减小的原因为
的产率先增大后减小的原因为
您最近一年使用:0次
2023-11-13更新
|
214次组卷
|
4卷引用:陕西省西安市2023-2024学年高二上学期期中考试化学试题
解题方法
6 . 环氧乙烷作为一种高效消毒剂,能与微生物的蛋白质、DNA、RNA发生非特异性烷基化作用,阻碍细菌蛋白质的新陈代谢,因此,常用于一次性口罩生产过程中灭菌和新冠病毒的消杀。工业上常用乙烯氧化法生产环氧乙烷,具体反应原理为:
主反应:2CH2=CH2(g)+O2(g) 2
2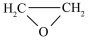 (g)△H1=-209.8kJ·mol-1
(g)△H1=-209.8kJ·mol-1
副反应:CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H2=-1323.0kJ·mol-1
(1)C2H4的燃烧热△H=-1411.0kJ·mol-1,则环氧乙烷(g)的燃烧热△H=___ 。
(2)以下既能加快反应速率又能提高环氧乙烷产率的方法有___ (填标号)。
A.降低温度 B.向容器中充入N2使压强增大
C.采用改性的催化剂 D.用空气替代氧气
(3)若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生主反应,达到平衡时CH2=CH2的转化率为75%,则平衡时用各组分的物质的量分数表示的化学平衡常数Kx=___ (保留2位有效数字)。
(4)已知: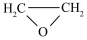 (g)+HCl(g)
(g)+HCl(g)
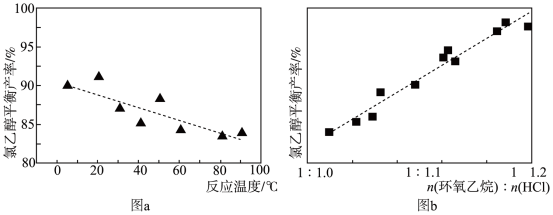
 (l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比
(l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比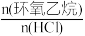 与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是
与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是___ ;其它条件不变时,降低原料投料比,环氧乙烷的平衡转化率将___ (填“增大”、“减小”或“不变”)。
(5)用电解法也能制备环氧乙烷,具体方法为:使用惰性电极电解KCl溶液,用Cl-交换膜将电解液分为阴极区和阳极区,其中一区持续通入乙烯;电解结束,移出交换膜,两区混合反应即得环氧乙烷。若阳极区的生成物为HOCH2CH2Cl,则乙烯应从___ (填“阳极”或“阴极”)通入,阴极的电极反应式为___ 。
主反应:2CH2=CH2(g)+O2(g)
 2
2 (g)△H1=-209.8kJ·mol-1
(g)△H1=-209.8kJ·mol-1副反应:CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H2=-1323.0kJ·mol-1
(1)C2H4的燃烧热△H=-1411.0kJ·mol-1,则环氧乙烷(g)的燃烧热△H=
(2)以下既能加快反应速率又能提高环氧乙烷产率的方法有
A.降低温度 B.向容器中充入N2使压强增大
C.采用改性的催化剂 D.用空气替代氧气
(3)若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生主反应,达到平衡时CH2=CH2的转化率为75%,则平衡时用各组分的物质的量分数表示的化学平衡常数Kx=
(4)已知:
 (g)+HCl(g)
(g)+HCl(g)
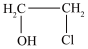 (l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比
(l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比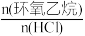 与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是
与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是
(5)用电解法也能制备环氧乙烷,具体方法为:使用惰性电极电解KCl溶液,用Cl-交换膜将电解液分为阴极区和阳极区,其中一区持续通入乙烯;电解结束,移出交换膜,两区混合反应即得环氧乙烷。若阳极区的生成物为HOCH2CH2Cl,则乙烯应从
您最近一年使用:0次
10-11高一下·河北衡水·期末
名校
7 . 在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是
 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是| A.A的转化率变小 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a>c+d |
您最近一年使用:0次
2019-11-19更新
|
191次组卷
|
51卷引用:2014-2015陕西省西安市一中高二上学期期末化学试卷
2014-2015陕西省西安市一中高二上学期期末化学试卷陕西省西安市西航一中2021-2022学年高二上学期期末考试化学试题陕西省安康市汉滨区五里高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2010-2011学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2010—2011学年浙江省杭州外国语学校高二年级下学期期中考试化学试卷(已下线)2011-2012学年河南省扶沟高中高二下学期第一次考试化学试卷(已下线)2011-2012学年山东省泰安市宁阳二中高二上学期期中考试化学试卷(已下线)2012年沪科版高中化学6.1提示化学反应速率和平衡之谜练习卷(已下线)2012-2013学年广东省实验中学高二上学期期中化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2012-2013福建省上杭一中高二上学期期中考试化学理试卷(已下线)2014届山东省济南一中高二上学期期末考试化学试卷 (已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷2014-2015甘肃省白银市会宁县五中高二上学期期末化学试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷2015-2016学年福建省福安市高级中学高二上学期第一次月考化学试卷2015-2016学年江西省铅山一中 、横峰中学高二上期中测试化学试卷2015-2016学年湖北省襄阳市四校高二上学期期中联考化学试卷2015-2016学年河北成安一中、永年二中高二上期中联考化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷2015-2016学年河北省成安一中高二上学期1月月考化学试卷2015-2016学年河北省邯郸一中高二下期中化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2016-2017学年河北省邯郸市成安一中、永年二中高二上期中化学卷2016-2017学年湖北省宜昌市葛洲坝中学高二上期中化学卷2016-2017学年安徽省合肥一中等名校高二上期末化学卷黑龙江省哈尔滨市第六中学2017-2018学年高二10月阶段考试化学试题云南省姚安县第一中学2017-2018学年高二10月月考化学试题河南省商丘市九校2017-2018学年高二上学期期中联考化学试题河北省邯郸市2016-2017学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试化学试题(B卷)【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题河北省唐县第一中学2019届高三上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题广东省潮州市潮安区颜锡祺中学2019-2020学年高二上学期期中考试化学试题江苏省宿豫中学2019-2020学年度高二下学期调研测试(实验班)化学试题黑龙江省绥化市明水县第一中学2020-2021学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题吉林省汪清县汪清第四中学2020-2021学年高二上学期第二阶段考试化学试题浙江省台州市路桥区东方理想学校2021-2022学年高二10月阶段性考试化学试题云南省红河县一中2021-2022学年高二上学期期中考试化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题北京市第一五九中学2021-2022学年高二上学期期中考试化学试题
真题
8 . 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A. 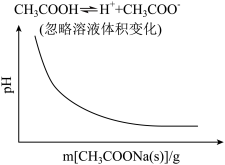 | B. 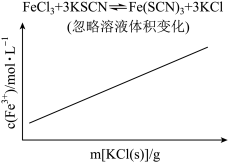 |
C.  | D.  |
您最近一年使用:0次
2019-01-30更新
|
1291次组卷
|
10卷引用:2011届陕西省师大附中、西工大附中高三第五次适应性训练(理综)化学部分
(已下线)2011届陕西省师大附中、西工大附中高三第五次适应性训练(理综)化学部分2009年普通高等学校招生统一考试理综试题化学部分(重庆卷)(已下线)2010年江西省新余一中 宜春中学 高安中学高二上学期第三次段考化学试卷(已下线)2011届天津市南开区高三一模考试(理综)化学部分(已下线)2011-2012学年江西省上高二中高二上学期第三次月考化学试卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷(已下线)2013-2014学年福建省宁德市高二上学期质量检测化学试卷A2015-2016学年山西省太原五中高二上第一次月考化学试卷2015-2016学年山西省临汾一中高二上12月月考化学试卷2020年安徽省全省教学质量检测统一考试(练习检测一)
名校
9 . 体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )| A.达平衡时间甲比乙短 |
| B.乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小 |
| C.达平衡时,甲中SO2的浓度比乙中SO2的浓度大 |
| D.达平衡时,甲的转化率比乙低 |
您最近一年使用:0次
2018-02-24更新
|
613次组卷
|
5卷引用:陕西省宝鸡市长岭中学2021-2022学年高二上学期期中考试化学试题
10-11高三上·黑龙江·期中
名校
10 . 对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是| A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n |
| C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
D.若温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的 要小 要小 |
您最近一年使用:0次
2015-06-11更新
|
485次组卷
|
11卷引用:陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题
陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题(已下线)2011届黑龙江省哈六中高三上学期期中考试化学试卷2014-2015安徽省安庆市第一中学高二下学期期中考试化学试卷河北省故城县高级中学2017-2018学年高二9月月考化学试题【校级联考】湖北省孝感市七校教学联盟2018-2019学年高二上学期期中联合考试化学试题山西省晋中市平遥县第二中学2018-2019学年高二上学期12月月考化学试题甘肃省张掖市山丹县第一中学2019-2020学年高二下学期期中考试化学试题河北省黄骅中学2020-2021学年高二上学期第一次月考化学试题福建省建瓯市芝华中学2021-2022学年高二上学期期中考试化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题



