名校
1 . 在一个体积为 2L 的密闭容器中发生以下反应: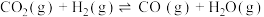 ,其平衡常数(K)和温度(t)的关系如下表所示
,其平衡常数(K)和温度(t)的关系如下表所示
(1)该反应的平衡常数表达式 K= ___________ ;该反应___________ 反应(填“吸热”或“放热”)
(2)600℃时,向容器中充入 1mol H2和 1mol CO2 气体,平衡时 CO 气体有 0.4mol,则 600℃时K=___________
(3)在 830℃向容器中充入 2mol CO 和 2mol H2O,保持温度不变,5 分钟后反应达到平衡后,其平衡常数___________ (填“大于”“小于”或“等于”)1,此时 H2O 的转化率为 ___________ 。
(4)若 1000℃时,某时刻反应混合物中 CO2、H2、CO、H2O 物质的量分别为 2mol 、2mol 、4mol 、4mol ,则此时上述反应的平衡移动方向为___________ (填“正反应方向”“逆反应方向”或“不移动”)
(5)为提高平衡时 H2的转化率,除了适当控制反应温度,还可以采取的措施是___________ 。
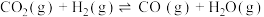 ,其平衡常数(K)和温度(t)的关系如下表所示
,其平衡常数(K)和温度(t)的关系如下表所示| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)600℃时,向容器中充入 1mol H2和 1mol CO2 气体,平衡时 CO 气体有 0.4mol,则 600℃时K=
(3)在 830℃向容器中充入 2mol CO 和 2mol H2O,保持温度不变,5 分钟后反应达到平衡后,其平衡常数
(4)若 1000℃时,某时刻反应混合物中 CO2、H2、CO、H2O 物质的量分别为 2mol 、2mol 、4mol 、4mol ,则此时上述反应的平衡移动方向为
(5)为提高平衡时 H2的转化率,除了适当控制反应温度,还可以采取的措施是
您最近一年使用:0次
2023-10-07更新
|
77次组卷
|
3卷引用:浙江省杭州市精诚联盟2023-2024学年高二上学期10月月考化学试题
2 . 化学与日常生活息息相关。下列说法错误的是
| A.使用含氟牙膏能预防龋齿 | B.晶体硅可用于制造光导纤维 |
| C.可用食醋除去水垢中的碳酸钙 | D.食品添加剂不应降低食品本身营养价值 |
您最近一年使用:0次
名校
解题方法
3 . 以 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:
一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用 合成
合成 ,方程式为:
,方程式为: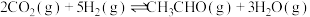
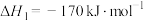
已知生成乙醛的净反应速率为 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下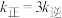 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
__________ 。
二、电化学技术
(2)研究证明 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是____________________ 。
三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。
反应Ⅰ
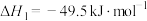
反应Ⅱ
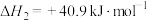
回答下列问题:
(3)下列说法不正确 的是__________。
(4)其他条件相同,仅改变容器体积,实验测得 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是________________ 。
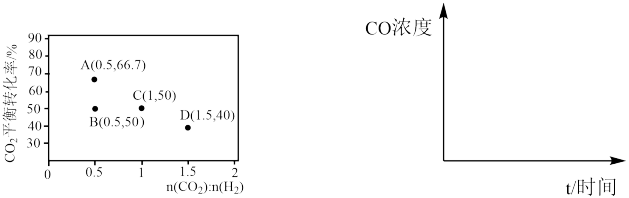
(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
①C、D二点对应的反应温度 、
、 的关系是
的关系是__________ 。
②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明 和
和
_______ 。
 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用
 合成
合成 ,方程式为:
,方程式为: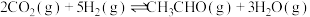
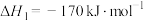
已知生成乙醛的净反应速率为
 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下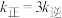 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
二、电化学技术
(2)研究证明
 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的
 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。反应Ⅰ

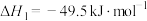
反应Ⅱ

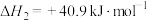
回答下列问题:
(3)下列说法
A.反应Ⅰ的活化能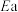 大于反应Ⅱ 大于反应Ⅱ | B.容器内压强不变时可以判断反应达到平衡 |
C.该温度下,反应Ⅱ的 大于零 大于零 | D.使用性能更佳的催化剂可以提高 平衡转化率 平衡转化率 |
 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整
 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。①C、D二点对应的反应温度
 、
、 的关系是
的关系是②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明
 和
和

您最近一年使用:0次
名校
解题方法
4 . 氢气是一种理想的能源,探索绿色化制氢是化学界一个热门话题。(本题反应中涉及 、
、 、
、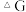 均为298K条件值)。
均为298K条件值)。
(1)传统制备氢气方法之一为水煤气法: ,该反应自发进行的条件是
,该反应自发进行的条件是___________ 。
(2)利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在 催化下,制取氢气有如下方法:
催化下,制取氢气有如下方法:
方法a:水蒸气催化重整


方法b:部分催化重整

已知:298K时,相关物质的相对能量如图1。

①依据图1数据,计算方法b反应的 =
=___________ 
②已知体系自由能变化: 时反应自发进行。请从
时反应自发进行。请从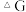 的角度分析方法a、b哪个更有利?
的角度分析方法a、b哪个更有利?___________ 。
③在某恒温和恒压( )体系中,
)体系中, 和
和 以系数比投料进行方法a制氢,若平衡时
以系数比投料进行方法a制氢,若平衡时 的产率为50%,该条件下方法a反应的平衡常数
的产率为50%,该条件下方法a反应的平衡常数 =
=___________ 。[如 的平衡压强
的平衡压强 为平衡系统中
为平衡系统中 的物质的量分数,p为平衡时总压]
的物质的量分数,p为平衡时总压]
(3)有化学工作者提出,在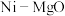 催化剂中添加纳米
催化剂中添加纳米 强化,开展“催化氧化重整”制氢,是一种优化的制氢方法。
强化,开展“催化氧化重整”制氢,是一种优化的制氢方法。
方法c: 下列有关说法正确的是___________。
下列有关说法正确的是___________。
 、
、 、
、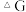 均为298K条件值)。
均为298K条件值)。(1)传统制备氢气方法之一为水煤气法:
 ,该反应自发进行的条件是
,该反应自发进行的条件是(2)利用生物质可再生资源乙醇制备氢气具有良好的开发前景。乙醇在
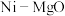 催化下,制取氢气有如下方法:
催化下,制取氢气有如下方法:方法a:水蒸气催化重整



方法b:部分催化重整


已知:298K时,相关物质的相对能量如图1。

①依据图1数据,计算方法b反应的
 =
=
②已知体系自由能变化:
 时反应自发进行。请从
时反应自发进行。请从 的角度分析方法a、b哪个更有利?
的角度分析方法a、b哪个更有利?③在某恒温和恒压(
 )体系中,
)体系中, 和
和 以系数比投料进行方法a制氢,若平衡时
以系数比投料进行方法a制氢,若平衡时 的产率为50%,该条件下方法a反应的平衡常数
的产率为50%,该条件下方法a反应的平衡常数 =
= 的平衡压强
的平衡压强 为平衡系统中
为平衡系统中 的物质的量分数,p为平衡时总压]
的物质的量分数,p为平衡时总压](3)有化学工作者提出,在
 催化剂中添加纳米
催化剂中添加纳米 强化,开展“催化氧化重整”制氢,是一种优化的制氢方法。
强化,开展“催化氧化重整”制氢,是一种优化的制氢方法。方法c:
 下列有关说法正确的是___________。
下列有关说法正确的是___________。A.方法c制氢时,充分提高廉价原料 的浓度,一定能增加氢气产率 的浓度,一定能增加氢气产率 |
| B.方法c与a比,相同条件下方法c能耗更低,制氢速率更快 |
C.乙醇制氢的三种方法中原子利用率(期望产物的总质量与生成物总质量之比)大小关系为: |
D.方法c相当于方法b与水煤气变换 的优化组合。水醇比 的优化组合。水醇比 对乙醇平衡转化率有较大影响 对乙醇平衡转化率有较大影响 |
您最近一年使用:0次
名校
解题方法
5 . 苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
___________ 。
(2)下列关于该反应的说法不正确的是___________。
(3)工业上通入过热水蒸气 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应
①反应中通入水蒸气的作用是___________
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为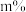 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
___________ (分压 总压
总压 物质的量分数)
物质的量分数)
(4)保持温度为 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线___________ 。

 ;
;

| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热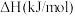 |  |  |  |
| A.高温、低压有利于该反应平衡正向进行 |
| B.高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化效果下降 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,可使乙苯的平衡转化率变大 |
 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应①反应中通入水蒸气的作用是
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为
 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
 总压
总压 物质的量分数)
物质的量分数)(4)保持温度为
 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线
您最近一年使用:0次
2023-04-27更新
|
165次组卷
|
2卷引用:浙江省海宁市高级中学2023-2024学年高二下学期3月月考化学试题
名校
6 . 向体积均为1 L的两恒容容器中分别充入2 mol X和1 mol Y发生反应:2X(g)+Y(g) ⇌Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是


| A.ΔH>0 |
| B.a点平衡常数:K=12 |
| C.气体的总物质的量:na<nc |
| D.反应速率:va正<vb正 |
您最近一年使用:0次
2022-07-10更新
|
486次组卷
|
5卷引用:浙江省台州市路桥中学2023-2024学年高二上学期10月月考化学试题
7 . 化学和生活密切相关,下列生产生活实例中不能 用勒夏特列原理解释的是
| A.摇晃后的可乐开启后有大量气泡 |
| B.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深 |
| C.酸遇紫色石蕊试剂变红 |
| D.生产硫酸的过程中用过量的空气和二氧化硫反应 |
您最近一年使用:0次
名校
8 . 下列三个反应均可用:aA(g)+B(g)⇌cC(g)表示,条件改变时变化如图所示(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
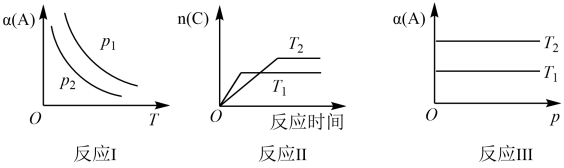

| A.反应I中,达平衡后升高温度,K值增大 |
| B.反应I中,若p2>p1,则有a+1<c |
| C.反应II中,达平衡后降低温度,C的体积分数减小 |
| D.反应III中,若T1>T2,则该反应一定不能自发进行 |
您最近一年使用:0次
2022-03-25更新
|
587次组卷
|
6卷引用:浙江金华第一中学2022-2023学年高二上学期12月月考化学试题
9 . 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌ N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
 N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
您最近一年使用:0次
2021-10-26更新
|
470次组卷
|
14卷引用:浙江省嘉兴市海盐第二高级中学2021-2022学年高二上学期(10月)阶段检测化学试题
浙江省嘉兴市海盐第二高级中学2021-2022学年高二上学期(10月)阶段检测化学试题广东省梅州市大埔县虎山中学2021-2022学年高二上学期第一次段考(10月)化学试题浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题辽宁师范大学附属中学2021-2022学年高二上学期10月月考化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题河南省新教材2022-2023学年高二上学期第三次阶段性模拟测试化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题西藏林芝市第二高级中学2021-2022学年高二上学期期中考试理综化学试题广东省广州市第二中学2022-2023学年高二上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题
名校
10 . 在一定温度下的密闭容器中发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.80mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.50mol/L。下列有关判断正确的是
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率增大 | D.C的体积分数减小 |
您最近一年使用:0次
2021-07-23更新
|
462次组卷
|
6卷引用:浙江省金华市第八中学2021-2022学年高二上学期9月月考化学试题



