名校
解题方法
1 . 硅是重要的半导体材料,构成现代电子工业的基础。磷及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。在工业上,高纯硅可以通过下列流程制取:
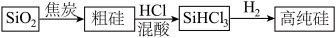
(1)基态硅原子核外电子的运动状态有___________ 种,占据的最高能层符号为___________ 。
(2)流程中由 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是___________ 。请写出一个能说明碳的非金属性强于硅的化学方程式___________ 。
(3) 甲硅烷 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:___________ 。
(4) 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是___________ 。
(5)工业上硅铁可以用于冶镁。以煅白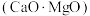 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于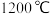 发生反应:
发生反应: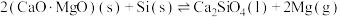 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:___________ 。
(6)有关碳和硅的有关化学键链能如下所示。
硅也有系列氢化物,如甲硅烷等。但硅烷在种类和数量上都远不如烷烃多,原因是___________ 。

(1)基态硅原子核外电子的运动状态有
(2)流程中由
 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是(3) 甲硅烷
 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:(4)
 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是(5)工业上硅铁可以用于冶镁。以煅白
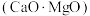 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于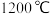 发生反应:
发生反应: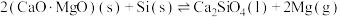 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:(6)有关碳和硅的有关化学键链能如下所示。
| 化学键 |  |  |  |  |  |  |
键能/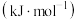 | 356 | 413 | 336 | 226 | 318 | 452 |
您最近一年使用:0次
名校
2 . 利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应:
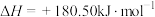 ,
,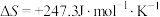 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知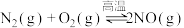 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、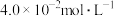 、
、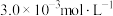 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.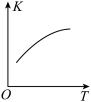 B.
B.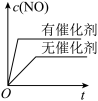 C.
C.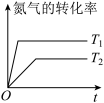
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应:
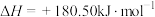 ,
,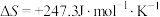 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为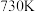 |
II.已知
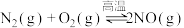 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、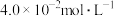 、
、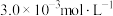 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
您最近一年使用:0次
2023-04-15更新
|
402次组卷
|
3卷引用:上海市徐汇中学2022-2023学年高二下学期 5月月考化学(等级)试题
名校
解题方法
3 . 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。图1是哈伯法的流程图,图2是反应历程。

(1)写出合成 的热化学方程式
的热化学方程式_______ 。已知该反应的 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
_______ kJ⋅mol 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因_______ 。
(2)步骤③采用的催化剂是_______ ,使用催化剂后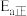
_______ (填“增大”、“减小”或“不变”,下同),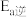
_______ 。
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
(4)500℃、20MPa时,将 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:

①反应开始到第10 min, 的平均反应速率为
的平均反应速率为_______ mol-1⋅L-1⋅min-1。
②反应进行到10 min至20 min时改变的条件可能是_______ 。
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了
③在25min改变条件后,平衡_______ (填“正”或“逆”)向移动,达到新平衡后 的体积分数比原平衡
的体积分数比原平衡_______ (填“大”或“小”)。

(1)写出合成
 的热化学方程式
的热化学方程式 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因(2)步骤③采用的催化剂是
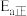
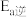
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:
①反应开始到第10 min,
 的平均反应速率为
的平均反应速率为②反应进行到10 min至20 min时改变的条件可能是
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了

③在25min改变条件后,平衡
 的体积分数比原平衡
的体积分数比原平衡
您最近一年使用:0次
2023-04-03更新
|
270次组卷
|
2卷引用:上海市交通大学附属中学2022-2023学年高二下学期摸底考化学试题
名校
解题方法
4 . 已知反应:

(1)该反应的平衡常数表达式是K=________________________ 。根据表中数据计算1300℃时, 在4分钟内的反应速率=
在4分钟内的反应速率=__________________  。达到平衡时
。达到平衡时 的转化率=
的转化率=__________________ %(结果保留到0.1%)
(2)表中a_________ b,c_________ 1.23(选填“>”、“<”或“=”)。
(3)若在1300℃时达到平衡后,继续往该容器内通入一定量的 (g),则该反应将
(g),则该反应将_________ (填写“向右”、“向左”或“不”)移动,平衡常数K_________ (填写“增大、减小或不变”)。


(1)该反应的平衡常数表达式是K=
 在4分钟内的反应速率=
在4分钟内的反应速率= 。达到平衡时
。达到平衡时 的转化率=
的转化率=(2)表中a
(3)若在1300℃时达到平衡后,继续往该容器内通入一定量的
 (g),则该反应将
(g),则该反应将
您最近一年使用:0次
名校
5 . 向密闭容器中充入S2Cl2、Cl2和SCl2,发生反应S2Cl2(g)+Cl2(g) 2SCl2(g),S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是
2SCl2(g),S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是

 2SCl2(g),S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是
2SCl2(g),S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是
| A.a为v(SCl2)随温度的变化曲线 |
| B.该反应正反应为放热反应 |
| C.0℃下反应一段时间,S2Cl2的物质的量增多 |
| D.反应达到平衡后向体系中充入氦气,平衡不移动 |
您最近一年使用:0次
2023-03-17更新
|
252次组卷
|
2卷引用:上海市卢湾高级中学2022-2023学年高三下学期3月月考化学试题
解题方法
6 . 在2L密闭容器内,800℃时反应: 体系中,n(NO)随时间的变化如表:
体系中,n(NO)随时间的变化如表:
(1)已知:K300℃>K350℃,则该反应是___________ 热反应。
(2)下图中表示 的变化的曲线是
的变化的曲线是___________ 。

用 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=___________ 。
(3)能说明该反应已达到平衡状态的是___________ 。
a. b.容器内压强保持不变
b.容器内压强保持不变
c. d.容器内密度保持不变
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________ 。
a.及时分离除 气体 b.适当升高温度
气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知某化学反应的平衡常数表达式为 ,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是
,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是___________ 。
a.该反应的化学方程式是:
b.该反应的正反应是放热反应
c.如果在一定体积的密闭容器中加入CO和 各
各 ,再把温度升高到
,再把温度升高到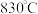 ,此时测得
,此时测得 为
为 时,这时可逆反应处于平衡状态。
时,这时可逆反应处于平衡状态。
d.若平衡浓度关系符合 ,可判断此时温度是
,可判断此时温度是
(6)某恒温密闭容器中,可逆反应 ,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是___________
a.产物B的状态只能为固态或液态
b.容器中气体的摩尔质量不再改变,说明反应已达平衡状态
c.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
d.若开始时向容器中加入1molB和1molC,达到平衡时放出热量
 体系中,n(NO)随时间的变化如表:
体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,则该反应是
(2)下图中表示
 的变化的曲线是
的变化的曲线是
用
 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=(3)能说明该反应已达到平衡状态的是
a.
 b.容器内压强保持不变
b.容器内压强保持不变c.
 d.容器内密度保持不变
d.容器内密度保持不变(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除
 气体 b.适当升高温度
气体 b.适当升高温度c.增大O2的浓度 d.选择高效催化剂
(5)已知某化学反应的平衡常数表达式为
 ,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是
,在不同的温度下该反应的平衡常数值见下表,下列有关叙述错误的是| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
a.该反应的化学方程式是:

b.该反应的正反应是放热反应
c.如果在一定体积的密闭容器中加入CO和
 各
各 ,再把温度升高到
,再把温度升高到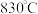 ,此时测得
,此时测得 为
为 时,这时可逆反应处于平衡状态。
时,这时可逆反应处于平衡状态。d.若平衡浓度关系符合
 ,可判断此时温度是
,可判断此时温度是
(6)某恒温密闭容器中,可逆反应
 ,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是a.产物B的状态只能为固态或液态
b.容器中气体的摩尔质量不再改变,说明反应已达平衡状态
c.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
d.若开始时向容器中加入1molB和1molC,达到平衡时放出热量

您最近一年使用:0次
名校
解题方法
7 . 某科学实验小组将6mol CO2和8mol H2充入容积为2L的密闭容器中(温度保持不变)。发生反应CO2(g) +3H2(g) CH3OH (g) +H2O (g)ΔH=-49.0 kJ·mol-1
CH3OH (g) +H2O (g)ΔH=-49.0 kJ·mol-1
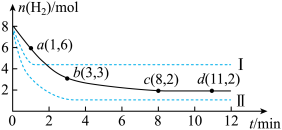
测得H2的物质的量随时间变化如上图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~3min内CO2的平均反应速率是_______ mol·L-1·min -1,在3~8min内CO2的平均反应速率是_______ mol·L-1·min -1,通过上述数据可以发现,0~8min内CO2的平均反应速率变化趋势为_______ ,运用碰撞理论解释该变化趋势:_______ 。
(2)此温度下该反应的平衡常数K的数值为_______ 。到达平衡状态时,H2的转化率是_______ 。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线I改变的条件可能是_______ ,曲线Ⅱ改变的条件可能是_______ 。若实线对应条件下平衡常数为K,曲线I对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是_______ 。
 CH3OH (g) +H2O (g)ΔH=-49.0 kJ·mol-1
CH3OH (g) +H2O (g)ΔH=-49.0 kJ·mol-1
测得H2的物质的量随时间变化如上图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~3min内CO2的平均反应速率是
(2)此温度下该反应的平衡常数K的数值为
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线I改变的条件可能是
您最近一年使用:0次
名校
解题方法
8 . 努力实现碳达峰、碳中和展现了我国积极参与和引领全球气候治理的大国担当。 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。
I.回收利用 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:

(1)反应A为 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。
已知:
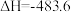 kJ⋅mol-1
kJ⋅mol-1

 kJ⋅mol-1
kJ⋅mol-1
反应A的
_______ kJ⋅mol-1
(2)将原料气按 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高 平衡转化率的措施有
平衡转化率的措施有_______ (选填编号)
a.降温
b.缩小容器体积
c.向容器中冲入Ar,增大压强
d.提高原料气中 的比例
的比例
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是_______ 。
(3)下列关于空间站内物质和能量变化的说法中,不正确的是_______ (填字母)。
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用
(4)用 代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是_______ 。
II.利用 生产乙烯:
生产乙烯: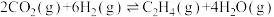
 ;在三个容积均为1 L的密闭容器中以不同的氢碳比
;在三个容积均为1 L的密闭容器中以不同的氢碳比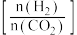 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。

(5)下列说法正确的是_______
a.该反应的
b.氢碳比:①>②
c.在氢碳比为2.0时,Q点: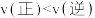
(6)若起始时, 、
、 浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则计算 可得P点对应温度的平衡常数为_______ (mol⋅L-1)-3。
 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。I.回收利用
 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:
(1)反应A为
 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。已知:

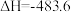 kJ⋅mol-1
kJ⋅mol-1
 kJ⋅mol-1
kJ⋅mol-1反应A的

(2)将原料气按
 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高
 平衡转化率的措施有
平衡转化率的措施有a.降温
b.缩小容器体积
c.向容器中冲入Ar,增大压强
d.提高原料气中
 的比例
的比例②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
 的转化效率,原因是
的转化效率,原因是(3)下列关于空间站内物质和能量变化的说法中,不正确的是
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用
 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用(4)用
 代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是II.利用
 生产乙烯:
生产乙烯: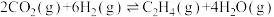
 ;在三个容积均为1 L的密闭容器中以不同的氢碳比
;在三个容积均为1 L的密闭容器中以不同的氢碳比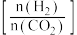 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
(5)下列说法正确的是
a.该反应的

b.氢碳比:①>②
c.在氢碳比为2.0时,Q点:
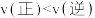
(6)若起始时,
 、
、 浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
您最近一年使用:0次
2023-03-04更新
|
245次组卷
|
2卷引用:上海市交通大学附属中学2022-2023学年高二下学期摸底考化学试题
名校
9 . NO2和N2O4存在平衡:2NO2(g) N2O4(g)△H<0。下列分析正确的是
N2O4(g)△H<0。下列分析正确的是
 N2O4(g)△H<0。下列分析正确的是
N2O4(g)△H<0。下列分析正确的是| A.平衡混合气体中NO2和N2O4体积比始终为2:1 |
| B.恒容时,水浴加热,平衡逆向移动,最终气体颜色变浅 |
| C.恒温时,缩小容积,平衡正向移动,最终气体颜色变深 |
| D.当υ(NO2):υ(N2O4)=2:1时,反应就处于平衡状态 |
您最近一年使用:0次
2022-03-04更新
|
406次组卷
|
8卷引用:上海市南洋模范中学2021-2022学年高一下学期3月考化学试题
上海市南洋模范中学2021-2022学年高一下学期3月考化学试题上海市南洋模范中学2021-2022学年高一下学期3月月考化学试题上海市崇明区2022届高三一模化学试题(已下线)化学-2022年高考押题预测卷02(上海卷)(含考试版、全解全析、参考答案、答题卡)上海市市北中学2022-2023学年高二上学期期中考试(等级)化学试题上海市致远高级中学2022-2023学年高二上学期期末教学评估化学等级考试题(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)
10 . 一定条件下: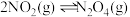
 。在测定
。在测定 的相对分子质量时,下列条件中,测定结果误差最小的是
的相对分子质量时,下列条件中,测定结果误差最小的是
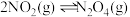
 。在测定
。在测定 的相对分子质量时,下列条件中,测定结果误差最小的是
的相对分子质量时,下列条件中,测定结果误差最小的是A.温度 、压强 、压强 | B.温度 、压强 、压强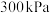 |
C.温度 、压强 、压强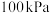 | D.温度 、压强 、压强 |
您最近一年使用:0次
2020-07-11更新
|
3801次组卷
|
56卷引用:上海市川沙中学2021-2022学年高三下学期5月月考化学试题
上海市川沙中学2021-2022学年高三下学期5月月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(二)化学试题北京二中2020-2021学年高二上学期10月月考化学试题福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题湖南省长沙市长郡中学2021-2022学年高三下学期月考考试(第六次)化学试题河北省石家庄市第十七中学2022-2023学年高二上学期10月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题福建省福州高级中学2022-2023学年高二上学期学段考试化学试题黑龙江省海林市朝鲜族中学2023-2024学年高二上学期第二次月考化学试题陕西省兴平市南郊高级中学2023-2024学年高二上学期第一次质量检测化学试题天津市九十六中学2023-2024学年高三上学期12月月考化学试题2020年浙江省高考化学试卷(7月选考)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编黑龙江省大庆市铁人中学2019-2020学年高一下学期期末考试化学试题海南省华中师范大学琼中附属中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】97湖北省咸宁市通城二中2020-2021学年度高二上学期期中考试化学试题河北省唐山市2020-2021学年高二上学期期末考试化学试题浙江省金华市金华十校2020-2021学年高二上学期调研考试化学试题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)【绍兴新东方】绍兴高中化学00007浙江省绍兴市上虞区2020-2021学年高二上学期期末教学质量调测化学试题(已下线)【浙江新东方】【2021.4.27】【温州】【高二上】【高中化学】【00197】(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)选择性必修1(SJ)专题2专题培优专练(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)河北正定中学2020-2021学年高二上学期开学考试化学试题(已下线)2.3.3 温度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题河南省濮阳市第一高级中学2021-2022学年高二上学期期中质量检测化学试题黑龙江省大庆实验中学2021-2022学年高二上学期期末考试化学试题陕西省宝鸡市渭滨区2021-2022学年高二上学期期末考试化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)天津市部分区2021-2022学年高三上学期期末考试化学试题广西柳州市第三中学2021-2022学年高二下学期期中考试化学试题(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省深圳市华中师范大学龙岗附属中学2021-2022学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第43讲 化学平衡移动原理及应用浙江省杭州第二中学2022-2023学年高二上学期期中考试化学(B卷)试题四川省凉山彝族自治州2022-2023学年高二上学期期末检测化学试题浙江省绍兴市柯桥区2022-2023学年高一下学期期末教学质量检测化学(实验班)试题作业(十二) 压强对化学平衡的影响 勒·夏特列原理广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题



