名校
解题方法
1 . 硅是重要的半导体材料,构成现代电子工业的基础。磷及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。在工业上,高纯硅可以通过下列流程制取:
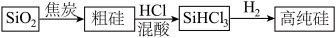
(1)基态硅原子核外电子的运动状态有___________ 种,占据的最高能层符号为___________ 。
(2)流程中由 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是___________ 。请写出一个能说明碳的非金属性强于硅的化学方程式___________ 。
(3) 甲硅烷 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:___________ 。
(4) 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是___________ 。
(5)工业上硅铁可以用于冶镁。以煅白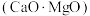 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于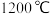 发生反应:
发生反应: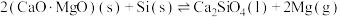 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:___________ 。
(6)有关碳和硅的有关化学键链能如下所示。
硅也有系列氢化物,如甲硅烷等。但硅烷在种类和数量上都远不如烷烃多,原因是___________ 。

(1)基态硅原子核外电子的运动状态有
(2)流程中由
 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是(3) 甲硅烷
 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:(4)
 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是(5)工业上硅铁可以用于冶镁。以煅白
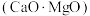 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于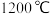 发生反应:
发生反应: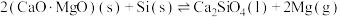 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:(6)有关碳和硅的有关化学键链能如下所示。
| 化学键 |  |  |  |  |  |  |
键能/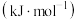 | 356 | 413 | 336 | 226 | 318 | 452 |
您最近一年使用:0次
名校
2 . 下列措施或事实不能用勒夏特列原理解释的是
A. 溶液中加入铁粉后颜色变浅 溶液中加入铁粉后颜色变浅 |
| B.合成氨工业中使用铁触媒作催化剂 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.氨水稀释过程中,铵根数目增多 |
您最近一年使用:0次
2023-11-24更新
|
101次组卷
|
3卷引用:上海市吴淞中学2023-2024学年高二上学期第二次学科质量检测 化学试卷
名校
解题方法
3 . 工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH<0
(1)书写该反应的平衡常数表达式K=___________ 。
(2)反应达到平衡后,为提高反应速率的同时提高NO2的转化率,可采取的措施有___________。
(3)在体积一定的容器中进行上述反应并达到平衡,保持其它条件不变,通入一定量的CH4,下列说法正确的是___________。
(1)书写该反应的平衡常数表达式K=
(2)反应达到平衡后,为提高反应速率的同时提高NO2的转化率,可采取的措施有___________。
| A.改用高效催化剂 | B.升高温度 |
| C.缩小容器的体积 | D.增加CH4的浓度 |
| A.正反应速率先增大后减小 | B.混合气体的平均密度增大 |
| C.化学平衡常数增大 | D.达到新平衡时 增大 增大 |
您最近一年使用:0次
名校
4 . 完成下列问题。
(1)合成氨是工业上的重要反应: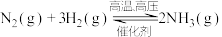 △H<0,下列说法错误的是
△H<0,下列说法错误的是_______ 。
A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动
B.反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2
C.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动
(2)合成氨工业中: △H<0,其化学平衡常数K与温度t的关系如表:
△H<0,其化学平衡常数K与温度t的关系如表:
完成下列填空:
①试比较K1、K2的大小,K1___________ K2(填写“>”、“=”或“<”)。
②400℃时,该反应的化学平衡常数的表达式_______ 。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则此时平衡___________ (填“正向移动”或“逆向移动”或“不移动”),此时
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
③已知

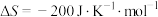 ,则该反应在温度低于
,则该反应在温度低于___________ K时能自发,但工业上选择反应温度在400℃~500℃是为了___________ 。
(1)合成氨是工业上的重要反应:
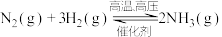 △H<0,下列说法错误的是
△H<0,下列说法错误的是A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动
B.反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2
C.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动
(2)合成氨工业中:
 △H<0,其化学平衡常数K与温度t的关系如表:
△H<0,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②400℃时,该反应的化学平衡常数的表达式

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)③已知


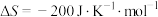 ,则该反应在温度低于
,则该反应在温度低于
您最近一年使用:0次
名校
5 . 甲醇是一种可再生能源,具有开发和应用的广阔前景,CO用于合成甲醇反应方程式(于固定容器中进行):
 。反应达平衡后,下列操作既能快反应速率,又能使平衡正向移动的是
。反应达平衡后,下列操作既能快反应速率,又能使平衡正向移动的是

 。反应达平衡后,下列操作既能快反应速率,又能使平衡正向移动的是
。反应达平衡后,下列操作既能快反应速率,又能使平衡正向移动的是| A.升温 | B.恒容条件下充入He | C.加入合适的催化剂 | D.压缩体积 |
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.下图为工业合成氨的流程图:
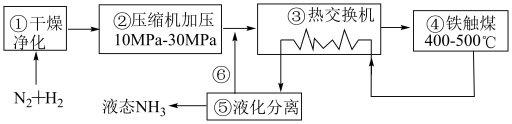
(1)⑥循环利用的物质是___________ ,①的气体若不进化,容易造成的问题是___________
(2)上述流程中能增加反应速率的是___________ ,能提高原料转化率的是___________ 。(填数字编号)
Ⅱ.某兴趣小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:(反应起始的温度和体积均相同):
(3)则:
___________  、
、
___________ 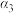 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)

(1)⑥循环利用的物质是
(2)上述流程中能增加反应速率的是
Ⅱ.某兴趣小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:(反应起始的温度和体积均相同):
| 序号 | 起始投入量 | 平衡转化率 | ||
 |  |  | ||
| ①恒温恒容 |  |  | 0 |  |
| ②绝热恒容 |  |  | 0 |  |
| ③恒温恒压 |  |  | 0 | 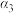 |
(3)则:

 、
、
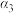 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
您最近一年使用:0次
名校
7 . 当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积分数增大 |
您最近一年使用:0次
名校
8 . CO 变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol⁻1。
(1)一定温度下,反应后测得各组分的平衡压强(即该组分的物质的量分数×总压): p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa 和 p(H2)=0.75 MPa,则该反应的平衡常数 Kp=___________ 。维持相同的温度和总压,提高水蒸气的投料比例,使 CO 的平衡转化率提高到 90%,则原料气中水蒸气和 CO 的物质的量之比为___________ 。
(2)生产过程中,为了提高变换反应的速率,下列措施中合适的是___________。
(3)以固体催化剂 M 催化 CO 变换反应,能量-反应过程关系如下图所示。步骤___________ 为决速步。(选填“I”或“II”)

用化学方程式表示该催化反应历程:
步骤 I: M(s)+H2O(g)=MO(s)+H2(g), 步骤 II:___________ 。
(1)一定温度下,反应后测得各组分的平衡压强(即该组分的物质的量分数×总压): p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa 和 p(H2)=0.75 MPa,则该反应的平衡常数 Kp=
(2)生产过程中,为了提高变换反应的速率,下列措施中合适的是___________。
| A.反应温度越高越好 | B.适当提高反应物压强 |
| C.选择合适的催化剂 | D.通入一定量的 N2 |

用化学方程式表示该催化反应历程:
步骤 I: M(s)+H2O(g)=MO(s)+H2(g), 步骤 II:
您最近一年使用:0次
名校
9 . 利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应:
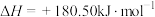 ,
,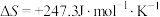 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知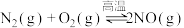 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、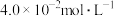 、
、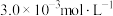 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.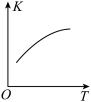 B.
B.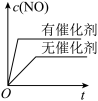 C.
C.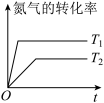
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应:
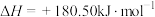 ,
,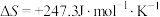 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为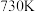 |
II.已知
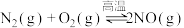 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、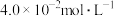 、
、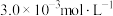 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
您最近一年使用:0次
2023-04-15更新
|
402次组卷
|
3卷引用:上海市徐汇中学2022-2023学年高二下学期 5月月考化学(等级)试题
名校
解题方法
10 . 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。图1是哈伯法的流程图,图2是反应历程。

(1)写出合成 的热化学方程式
的热化学方程式_______ 。已知该反应的 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
_______ kJ⋅mol 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因_______ 。
(2)步骤③采用的催化剂是_______ ,使用催化剂后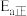
_______ (填“增大”、“减小”或“不变”,下同),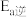
_______ 。
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
(4)500℃、20MPa时,将 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:

①反应开始到第10 min, 的平均反应速率为
的平均反应速率为_______ mol-1⋅L-1⋅min-1。
②反应进行到10 min至20 min时改变的条件可能是_______ 。
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了
③在25min改变条件后,平衡_______ (填“正”或“逆”)向移动,达到新平衡后 的体积分数比原平衡
的体积分数比原平衡_______ (填“大”或“小”)。

(1)写出合成
 的热化学方程式
的热化学方程式 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因(2)步骤③采用的催化剂是
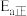
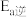
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:
①反应开始到第10 min,
 的平均反应速率为
的平均反应速率为②反应进行到10 min至20 min时改变的条件可能是
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了

③在25min改变条件后,平衡
 的体积分数比原平衡
的体积分数比原平衡
您最近一年使用:0次
2023-04-03更新
|
270次组卷
|
2卷引用:上海市交通大学附属中学2022-2023学年高二下学期摸底考化学试题



