解题方法
1 . 苯甲酸乙酯可用于配制香水、香精和人造精油,也大量用于食品中,实验室制备苯甲酸乙酯的原理为: .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:
实验装置如图所示(加热及夹持装置已省略),实验步骤如下:
②控制温度在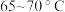 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;
③反应结束后,将X内反应液依次用水、饱和 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
④向③中所得有机层中加入氯化钙,蒸馏,接收 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。
请回答下列问题:
(1)仪器X的名称为___________ 。
(2)冷凝管的进水口为___________ (填“a”或“b”)。
(3)“加热回流”时,装置宜采用的加热方法是___________ ,判断反应完成的实验现象为___________ 。
(4)使用分水器能提高酯的产率,原因是___________ (用平衡移动的原理解释)。
(5)若步骤③加入的饱和 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是___________ 。
(6)本实验得到的苯甲酸乙酯的产率为___________ (结果保留3位有效数字)。
 +C2H5OH
+C2H5OH
 +H2O
+H2O
 .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:| 物质 | 颜色、状态 | 沸点( ) ) | 密度( ) ) | 溶解性 |
| 苯甲酸 | 无色晶体 | 249( 升华) 升华) | 1.27 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯甲酸乙酯 | 无色液体 | 212.6 | 1.05 | 微溶于热水,与乙醇、乙醚混溶 |
| 乙醇 | 无色液体 | 78.3 | 0.79 | 与水互溶 |
| 环己烷 | 无色液体 | 80.8 | 0.73 | 不溶于水 |

②控制温度在
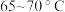 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;③反应结束后,将X内反应液依次用水、饱和
 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;④向③中所得有机层中加入氯化钙,蒸馏,接收
 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。请回答下列问题:
(1)仪器X的名称为
(2)冷凝管的进水口为
(3)“加热回流”时,装置宜采用的加热方法是
(4)使用分水器能提高酯的产率,原因是
(5)若步骤③加入的饱和
 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是(6)本实验得到的苯甲酸乙酯的产率为
您最近一年使用:0次
2 . 某温度下,在1 L恒容密闭容器中3.0 mol A发生反应 ,有关数据如下:
,有关数据如下:
下列说法错误的是
 ,有关数据如下:
,有关数据如下:| 时间段/min | 产物C的平均生成速率/mol·L-1·min-1 |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
| A.当容器内压强不再变化时,反应达到平衡状态 |
| B.2 min时,加入0.2 mol C,此时平衡逆向移动 |
| C.该温度下的平衡常数K=0.108 |
| D.5 min时,A的物质的量为2.1 mol |
您最近一年使用:0次
名校
3 . 下列关于化学反应速率和化学平衡的说法正确的是
| A.化学平衡常数K变化,平衡不一定发生移动 |
B.已知反应: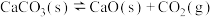 ,在密闭的反应炉内达到平衡后,若其他条件均不改变,将反应炉体积缩小一半,则达到新平衡时 ,在密闭的反应炉内达到平衡后,若其他条件均不改变,将反应炉体积缩小一半,则达到新平衡时 (g)的浓度将升高 (g)的浓度将升高 |
C.两个体积相同的容器中充入等量的 发生反应: 发生反应: △H<0,绝热容器中气体的颜色比铁制容器中颜色深 △H<0,绝热容器中气体的颜色比铁制容器中颜色深 |
| D.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
您最近一年使用:0次
4 . 在密闭容器中一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为0.8mol/L,下列判断正确的是
zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为0.8mol/L,下列判断正确的是
 zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为0.8mol/L,下列判断正确的是
zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为0.8mol/L,下列判断正确的是| A.x+y﹤z | B.平衡向正反应方向移动 |
| C.B的物质的量增大 | D.C的体积分数保持不变 |
您最近一年使用:0次
名校
5 . 一定温度下的密闭容器中,反应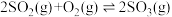 达到平衡,缩小容器容积,对反应产生影响的叙述不正确的是
达到平衡,缩小容器容积,对反应产生影响的叙述不正确的是
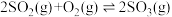 达到平衡,缩小容器容积,对反应产生影响的叙述不正确的是
达到平衡,缩小容器容积,对反应产生影响的叙述不正确的是| A.使平衡向正反应方向移动 | B.使平衡常数K增大 |
C.使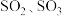 的浓度增大 的浓度增大 | D.使v(正)、v(逆)增大 |
您最近一年使用:0次
2024-02-18更新
|
79次组卷
|
2卷引用:安徽省淮北市第一中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
6 . 在煤化工领域主要涉及碳一化学,即研究以含有一个碳原子的物质(CO、 、
、 、
、 等)为原料合成化工产品或液体燃料。回答下列问题:
等)为原料合成化工产品或液体燃料。回答下列问题:
(1)已知物质之间转化能量关系如图所示: 和
和 生成
生成 和
和 的热化学方程式
的热化学方程式___________ 。
(2)煤化工业上主要利用CO和 反应制备甲醇(
反应制备甲醇( ),反应热化学方程式为
),反应热化学方程式为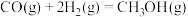
 。已知CO的平衡转化率与温度的关系如图所示:
。已知CO的平衡转化率与温度的关系如图所示:
___________ (填“>”“<”或“=”)0。
②A、B、C三点平衡常数 、
、 、
、 的大小关系为
的大小关系为___________ 。压强
___________ (填“>”“<”或“=”,下同) ,在
,在 和
和 条件下,由D点到B点过程中,正、逆反应速率之间的关系:
条件下,由D点到B点过程中,正、逆反应速率之间的关系:
___________  。
。
③若容器容积不变,则下列措施可提高CO平衡转化率的是___________ (填字母)。
a.充入CO,使体系总压强增大 b.将 从体系中分离
从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充入2molCO和 ,在
,在 和
和 条件下经10min达到平衡状态。在该条件下,
条件下经10min达到平衡状态。在该条件下,
___________  ;平衡常数
;平衡常数
___________ (填数值)。
(3)用 还原
还原 可以合成
可以合成 :
:
 。恒压下,
。恒压下, 和
和 的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出
的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出 )时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为
)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为___________ 。
 、
、 、
、 等)为原料合成化工产品或液体燃料。回答下列问题:
等)为原料合成化工产品或液体燃料。回答下列问题:(1)已知物质之间转化能量关系如图所示:

 和
和 生成
生成 和
和 的热化学方程式
的热化学方程式(2)煤化工业上主要利用CO和
 反应制备甲醇(
反应制备甲醇( ),反应热化学方程式为
),反应热化学方程式为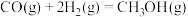
 。已知CO的平衡转化率与温度的关系如图所示:
。已知CO的平衡转化率与温度的关系如图所示: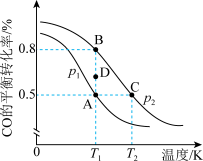

②A、B、C三点平衡常数
 、
、 、
、 的大小关系为
的大小关系为
 ,在
,在 和
和 条件下,由D点到B点过程中,正、逆反应速率之间的关系:
条件下,由D点到B点过程中,正、逆反应速率之间的关系:
 。
。③若容器容积不变,则下列措施可提高CO平衡转化率的是
a.充入CO,使体系总压强增大 b.将
 从体系中分离
从体系中分离c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充入2molCO和
 ,在
,在 和
和 条件下经10min达到平衡状态。在该条件下,
条件下经10min达到平衡状态。在该条件下,
 ;平衡常数
;平衡常数
(3)用
 还原
还原 可以合成
可以合成 :
:
 。恒压下,
。恒压下, 和
和 的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出
的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出 )时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为
)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为
您最近一年使用:0次
2024-01-12更新
|
251次组卷
|
2卷引用:安徽省芜湖市第一中学2022-2023学年高二上学期10月月考化学试卷
名校
解题方法
7 . 反应
 ,达到平衡后,下列说法
,达到平衡后,下列说法不正确 的是

 ,达到平衡后,下列说法
,达到平衡后,下列说法| A.对氯水进行光照产生氧气时发生了氧化还原反应 |
| B.氯水中加入少量醋酸钠固体,上述平衡正向移动 |
C.取氯水进行加水稀释,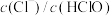 增大 增大 |
D.取两份氯水分别滴加 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝,说明上述反应存在限度 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝,说明上述反应存在限度 |
您最近一年使用:0次
名校
解题方法
8 . 恒温恒压下向密闭容器中充入 和
和 ,反应如下:
,反应如下: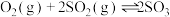
 ,在2min时反应达到平衡,生成
,在2min时反应达到平衡,生成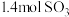 ,同时放出热量QkJ。则下列分析正确的是
,同时放出热量QkJ。则下列分析正确的是
 和
和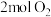 ,反应如下:
,反应如下: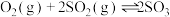
 ,在2min时反应达到平衡,生成
,在2min时反应达到平衡,生成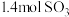 ,同时放出热量QkJ。则下列分析正确的是
,同时放出热量QkJ。则下列分析正确的是A.若改为恒容容器且体积为2L,则 |
B.2min后向容器中再通入一定量的 气体,重新达到平衡时, 气体,重新达到平衡时, 的含量增大 的含量增大 |
C.若把条件“恒温恒压”改为“绝热恒压”,则平衡后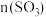 大于1.4mol 大于1.4mol |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ |
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)已知在一定温度下,下列各反应的焓变和平衡常数如下:
①C(s)+CO2(g) 2CO(g) ΔH1 K1
2CO(g) ΔH1 K1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2 K2
H2(g)+CO2(g) ΔH2 K2
③C(s)+H2O(g) CO(g)+H2(g) ΔH3 K3
CO(g)+H2(g) ΔH3 K3
则ΔH1、ΔH2、ΔH3三者关系为ΔH3=_______ ,K1、K2、K3三者关系为K3=_______ 。
(2)2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成 和
和 的反应为
的反应为
 。
。
①假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是_______ (填序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的容积
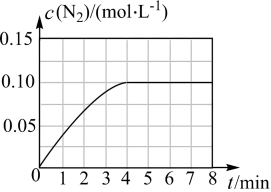
②若将1molNO和2molCO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的 物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_______ 。
(3)某密闭容器中存在反应:CO(g)+2H2(g) CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
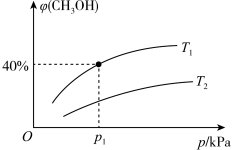
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1_______ (填“>”“<”或“=”)K2;若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1,则T1时该反应的压强平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)。
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_______ (填“>”“<”或“=”)α2。
(1)已知在一定温度下,下列各反应的焓变和平衡常数如下:
①C(s)+CO2(g)
 2CO(g) ΔH1 K1
2CO(g) ΔH1 K1②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2 K2
H2(g)+CO2(g) ΔH2 K2③C(s)+H2O(g)
 CO(g)+H2(g) ΔH3 K3
CO(g)+H2(g) ΔH3 K3则ΔH1、ΔH2、ΔH3三者关系为ΔH3=
(2)2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成
 和
和 的反应为
的反应为
 。
。①假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的容积
②若将1molNO和2molCO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的
 物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
(3)某密闭容器中存在反应:CO(g)+2H2(g)
 CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1
您最近一年使用:0次
名校
解题方法
10 . 肌红蛋白(Mb, g·mol
g·mol )和血红蛋白((Hb,
)和血红蛋白((Hb, g·mol
g·mol )分别存在于哺乳动物肌细胞和血液中,通过储存和分配
)分别存在于哺乳动物肌细胞和血液中,通过储存和分配 维持人体生理活动,其原理如下:
维持人体生理活动,其原理如下:
反应Ⅰ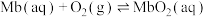

反应Ⅱ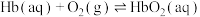

(1)设反应Ⅰ平衡时Mb与 的结合率(即Mb的转化率)为α(Mb)、氧气的分压为
的结合率(即Mb的转化率)为α(Mb)、氧气的分压为 ,在
,在 ℃下的
℃下的 、在
、在 kPa下的α(Mb)~T如图所示①下列说法正确的是
kPa下的α(Mb)~T如图所示①下列说法正确的是_______ 。

A.曲线a为等温线,曲线b为等压线
B.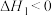
C.其他条件不变,高烧患者体内的 会比其健康时高
会比其健康时高
D.其他条件不变,从低海拔地区进入高海拔地区由于人体温度降低,人体内α(Mb)会降低,易有眩晕感
②设反应 的标准平衡常数
的标准平衡常数 ,其中
,其中 kPa、
kPa、 mol⋅L
mol⋅L ,则25℃时反应Ⅰ的标准平衡常数为
,则25℃时反应Ⅰ的标准平衡常数为_______ 。
(2)将0.5 L一定浓度的血红蛋白Hb溶液(比热容约为(4.2 J⋅g ⋅℃
⋅℃ 密度近似为1.0 g⋅cm
密度近似为1.0 g⋅cm 放入绝热量热计中并充入氧气,当有160 g Hb被氧化时,测得体温度升高0.21℃,
放入绝热量热计中并充入氧气,当有160 g Hb被氧化时,测得体温度升高0.21℃,
_______ J⋅mol 。
。
(3)若人体误食亚硝酸盐,会导致血红蛋白中的 转化为
转化为 失去载氧能力而中毒,可服用抗坏血酸(
失去载氧能力而中毒,可服用抗坏血酸( )解毒,抗坏血酸的作用是
)解毒,抗坏血酸的作用是_______ 。
(4)CO会与血红蛋白结合形成HbCO导致人体中毒:
①从化学平衡角度简述CO的中毒原理:_______ 。
②已知反应
 。实验表明,人体内HbCO与
。实验表明,人体内HbCO与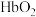 的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与
的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与 的体积比大于
的体积比大于_______ 即达到智力受损的程度。
 g·mol
g·mol )和血红蛋白((Hb,
)和血红蛋白((Hb, g·mol
g·mol )分别存在于哺乳动物肌细胞和血液中,通过储存和分配
)分别存在于哺乳动物肌细胞和血液中,通过储存和分配 维持人体生理活动,其原理如下:
维持人体生理活动,其原理如下:反应Ⅰ
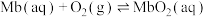

反应Ⅱ
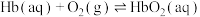

(1)设反应Ⅰ平衡时Mb与
 的结合率(即Mb的转化率)为α(Mb)、氧气的分压为
的结合率(即Mb的转化率)为α(Mb)、氧气的分压为 ,在
,在 ℃下的
℃下的 、在
、在 kPa下的α(Mb)~T如图所示①下列说法正确的是
kPa下的α(Mb)~T如图所示①下列说法正确的是
A.曲线a为等温线,曲线b为等压线
B.
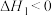
C.其他条件不变,高烧患者体内的
 会比其健康时高
会比其健康时高D.其他条件不变,从低海拔地区进入高海拔地区由于人体温度降低,人体内α(Mb)会降低,易有眩晕感
②设反应
 的标准平衡常数
的标准平衡常数 ,其中
,其中 kPa、
kPa、 mol⋅L
mol⋅L ,则25℃时反应Ⅰ的标准平衡常数为
,则25℃时反应Ⅰ的标准平衡常数为(2)将0.5 L一定浓度的血红蛋白Hb溶液(比热容约为(4.2 J⋅g
 ⋅℃
⋅℃ 密度近似为1.0 g⋅cm
密度近似为1.0 g⋅cm 放入绝热量热计中并充入氧气,当有160 g Hb被氧化时,测得体温度升高0.21℃,
放入绝热量热计中并充入氧气,当有160 g Hb被氧化时,测得体温度升高0.21℃,
 。
。(3)若人体误食亚硝酸盐,会导致血红蛋白中的
 转化为
转化为 失去载氧能力而中毒,可服用抗坏血酸(
失去载氧能力而中毒,可服用抗坏血酸( )解毒,抗坏血酸的作用是
)解毒,抗坏血酸的作用是(4)CO会与血红蛋白结合形成HbCO导致人体中毒:

①从化学平衡角度简述CO的中毒原理:
②已知反应

 。实验表明,人体内HbCO与
。实验表明,人体内HbCO与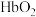 的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与
的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与 的体积比大于
的体积比大于
您最近一年使用:0次



