名校
解题方法
1 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为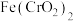 ,还含有
,还含有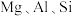 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾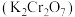 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时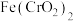 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
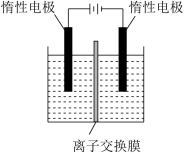
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
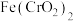 ,还含有
,还含有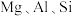 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾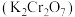 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
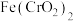 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为
(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近一年使用:0次
解题方法
2 . 干燥的二氧化碳和氨气反应可生成氨基甲酸铵固体,氨基甲酸铵遇水立即反应。化学方程式为:2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
NH2COONH4(s) ΔH<0,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
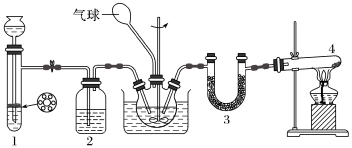
(1)装置1中用来添加液体药品的仪器名称为___________ 。
(2)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,然后所加入稀盐酸;所发生反应的离子方程式为___________ ,装置2中所盛放的试剂为___________ 。
(3)装置4是用来制取NH3,则发生反应的化学方程式为___________ ,装置3中所盛放的试剂为___________ 。
(4)用装置1来制取气体的优点是___________ 。
(5)反应时三颈烧瓶需用冷水浴冷却,其目的是___________ 。
(6)恒温恒容条件下,发生NH2COONH4(s) 2NH3(g)+CO2(g)这一反应,向容器中加入一定量的氨基甲酸铵固体,一段时间达平衡,下列不能说明该反应达平衡状态的是
2NH3(g)+CO2(g)这一反应,向容器中加入一定量的氨基甲酸铵固体,一段时间达平衡,下列不能说明该反应达平衡状态的是___________ (填字母)。
a.容器内压强保持不变 b.氨基甲酸铵固体的质量不变
c.NH3的体积百分含量保持不变 d.混合气体的平均相对分子质量保持不变
 NH2COONH4(s) ΔH<0,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
NH2COONH4(s) ΔH<0,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
(1)装置1中用来添加液体药品的仪器名称为
(2)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,然后所加入稀盐酸;所发生反应的离子方程式为
(3)装置4是用来制取NH3,则发生反应的化学方程式为
(4)用装置1来制取气体的优点是
(5)反应时三颈烧瓶需用冷水浴冷却,其目的是
(6)恒温恒容条件下,发生NH2COONH4(s)
 2NH3(g)+CO2(g)这一反应,向容器中加入一定量的氨基甲酸铵固体,一段时间达平衡,下列不能说明该反应达平衡状态的是
2NH3(g)+CO2(g)这一反应,向容器中加入一定量的氨基甲酸铵固体,一段时间达平衡,下列不能说明该反应达平衡状态的是a.容器内压强保持不变 b.氨基甲酸铵固体的质量不变
c.NH3的体积百分含量保持不变 d.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
3 . 一定温度下,向三个容积不等的恒容密闭容器中分别投入2molNOCl,发生反应: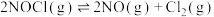 。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
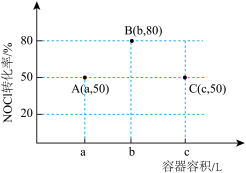
| A.A点加入适当催化剂,可以提高NOCl的转化率 |
| B.容积为aL的容器达到平衡后再投入1molNOCl、1molNO,平衡向左移动 |
| C.A、B两点的压强之比为25:28 |
| D.容积为cL的容器NOCl的平衡转化率大于80% |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

图中是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为________ 。
(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:2CO(g)+4H2(g) CH3OCH3 (g)+H2O(g) ΔH, 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
CH3OCH3 (g)+H2O(g) ΔH, 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________ 。
A.一氧化碳的转化率减小 B.容器的压强增大 C.化学平衡常数K值减小
D.逆反应速率先增大后减小 E.混合气体的密度增大
(3)25℃时, mL 0.2
mL 0.2 稀盐酸与
稀盐酸与 mL 0.1
mL 0.1 NaOH溶液混合,忽略溶液混合时的体积变化。若
NaOH溶液混合,忽略溶液混合时的体积变化。若 ,则混合溶液的pH=
,则混合溶液的pH=___________ ;若混合溶液的pH=12,则
___________ 。(已知溶液pH均为25℃时的pH, )
)
Ⅱ.25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。请回答如下问题

(4)曲线___________ (填“Ⅰ”或“Ⅱ”)代表盐酸的稀释过程
(5)a溶液中水的电离程度比b溶液___________ (填“大”或“小”)
(6)将a、b两溶液加热至30℃,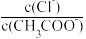
___________ (填“变大”、“变小”或“不变”)
(7)设稀释前的醋酸电离度为0.1%,醋酸的电离常数Ka=___________ 。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

图中是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为
(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:2CO(g)+4H2(g)
 CH3OCH3 (g)+H2O(g) ΔH, 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
CH3OCH3 (g)+H2O(g) ΔH, 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是A.一氧化碳的转化率减小 B.容器的压强增大 C.化学平衡常数K值减小
D.逆反应速率先增大后减小 E.混合气体的密度增大
(3)25℃时,
 mL 0.2
mL 0.2 稀盐酸与
稀盐酸与 mL 0.1
mL 0.1 NaOH溶液混合,忽略溶液混合时的体积变化。若
NaOH溶液混合,忽略溶液混合时的体积变化。若 ,则混合溶液的pH=
,则混合溶液的pH=
 )
)Ⅱ.25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。请回答如下问题

(4)曲线
(5)a溶液中水的电离程度比b溶液
(6)将a、b两溶液加热至30℃,
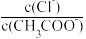
(7)设稀释前的醋酸电离度为0.1%,醋酸的电离常数Ka=
您最近一年使用:0次
名校
5 . 已知: 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: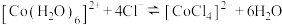 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:

以下结论和解释正确的是
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: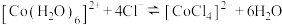 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
| A.由实验①可推知正反应为放热反应 |
B.等物质的量的 和 和 中 中 键数目之比为3∶2 键数目之比为3∶2 |
C.实验②是由于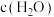 增大,导致平衡逆向移动 增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: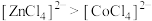 |
您最近一年使用:0次
名校
解题方法
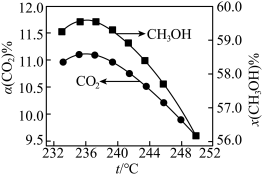
6 . CO2催化加氢制甲醇中发生的反应有:
i.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
ii.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,相同时间后,CO2转化率和CH3OH选择性[x(CH3OH)=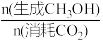 ×100%]随温度变化关系如图所示,下列说法正确的是
×100%]随温度变化关系如图所示,下列说法正确的是
i.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
ii.CO2(g)+H2(g)=CO(g)+H2O(g) △H2>0
在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,相同时间后,CO2转化率和CH3OH选择性[x(CH3OH)=
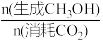 ×100%]随温度变化关系如图所示,下列说法正确的是
×100%]随温度变化关系如图所示,下列说法正确的是
| A.某温度下,若是发生i反应,保持CO2和H2的投料比和压强不变,增大CO2和H2的通入量,平衡时CH3OH的体积分数增大 |
| B.其他条件不变,若反应ⅱ生成的产物为CO(g)和H2O(l),则△H2将变大 |
| C.由图像可知,△H1一定小于0 |
| D.236℃后的曲线变化趋势可能是由于反应i中催化剂失去活性而造成的 |
您最近一年使用:0次
解题方法
7 . 三氧化二镍(Ni2O3)可用于制造镍氢电池,工业上利用含镍废料(主要成分为镍、铝、铁及其氧化物、碳等)回收其中的镍并制备Ni2O3的工艺流程如下:
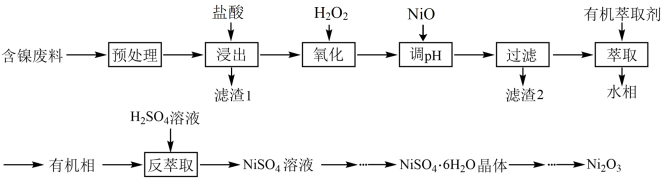
已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)“预处理”操作目的是除去镍废料表面的油脂,可选用试剂为___________ (填字母代号)。
A.水 B.饱和食盐水 C.NaOH溶液
(2)“酸浸”时温度过高,镍的浸出率下降,主要原因可能是___________ (答一点即可)。
(3)“氧化”时主要反应的离子方程式是___________ 。
(4)若“氧化”后的溶液中Ni2+浓度为0.01mol/L,则“调pH”应控制的pH范围是___________ 。
(5)反萃取的反应原理为 ,向有机相中加入H2SO4溶液能进行反萃取的原因为
,向有机相中加入H2SO4溶液能进行反萃取的原因为___________ (用化学平衡移动原理解释)。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为 ,则放电时负极的电极反应式为
,则放电时负极的电极反应式为___________ 。
(7)确定Ni2O3固体是晶体的最可靠的科学方法是___________(填字母代号)。

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时(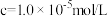 )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
A.水 B.饱和食盐水 C.NaOH溶液
(2)“酸浸”时温度过高,镍的浸出率下降,主要原因可能是
(3)“氧化”时主要反应的离子方程式是
(4)若“氧化”后的溶液中Ni2+浓度为0.01mol/L,则“调pH”应控制的pH范围是
(5)反萃取的反应原理为
 ,向有机相中加入H2SO4溶液能进行反萃取的原因为
,向有机相中加入H2SO4溶液能进行反萃取的原因为(6)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为
 ,则放电时负极的电极反应式为
,则放电时负极的电极反应式为(7)确定Ni2O3固体是晶体的最可靠的科学方法是___________(填字母代号)。
| A.测定熔、沸点 | B.观察外形 |
| C.对固体进行X射线衍射测定 | D.对比硬度 |
您最近一年使用:0次
2023-09-10更新
|
220次组卷
|
2卷引用:湖南省益阳市2024届高三上学期9月教学质量检测化学试题
解题方法
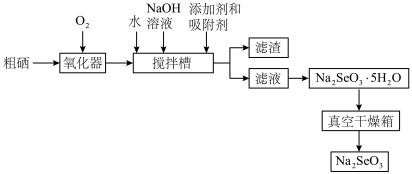
8 . 硒是人体必需微量元素之一,可用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。粗硒经过下列流程可获得亚硒酸钠( )。
)。
(1)298K、 ,
, 、S、Se、Te分别与
、S、Se、Te分别与 化合的反应热数据如下图所示。写出Se与
化合的反应热数据如下图所示。写出Se与 化合的热化学反应方程式:
化合的热化学反应方程式:___________ 。
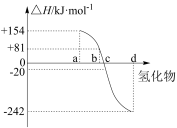
(2)硒与硫是同主族的相邻元素,硒的原子序数为___________ 。
(3)已知在氧化器中粗硒转化为 ,在搅拌槽中与NaOH发生反应的离子方程式为
,在搅拌槽中与NaOH发生反应的离子方程式为______ 。
(4)由滤液获取 晶体的操作为
晶体的操作为___________ 、过滤、洗涤。
(5) 转化为
转化为 的过程中存在平衡
的过程中存在平衡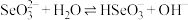 ,下列粒子中不会影响该平衡的是___________(填字母)。
,下列粒子中不会影响该平衡的是___________(填字母)。
(6)常温下,向 溶液中逐滴加入NaOH溶液,混合溶液中
溶液中逐滴加入NaOH溶液,混合溶液中 [X为
[X为 或
或 ]与pH的变化关系如图所示。
]与pH的变化关系如图所示。
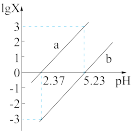
①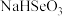 溶液呈
溶液呈___________ 性(填“酸”“碱”或“中”)。
② 时,溶液中
时,溶液中
___________ 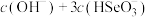 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
 )。
)。
(1)298K、
 ,
, 、S、Se、Te分别与
、S、Se、Te分别与 化合的反应热数据如下图所示。写出Se与
化合的反应热数据如下图所示。写出Se与 化合的热化学反应方程式:
化合的热化学反应方程式:
(2)硒与硫是同主族的相邻元素,硒的原子序数为
(3)已知在氧化器中粗硒转化为
 ,在搅拌槽中与NaOH发生反应的离子方程式为
,在搅拌槽中与NaOH发生反应的离子方程式为(4)由滤液获取
 晶体的操作为
晶体的操作为(5)
 转化为
转化为 的过程中存在平衡
的过程中存在平衡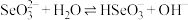 ,下列粒子中不会影响该平衡的是___________(填字母)。
,下列粒子中不会影响该平衡的是___________(填字母)。A. | B. | C. | D.O=C=O |
 溶液中逐滴加入NaOH溶液,混合溶液中
溶液中逐滴加入NaOH溶液,混合溶液中 [X为
[X为 或
或 ]与pH的变化关系如图所示。
]与pH的变化关系如图所示。
①
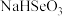 溶液呈
溶液呈②
 时,溶液中
时,溶液中
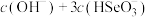 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
13-14高一下·山东济宁·阶段练习
名校
解题方法
9 . 在C(s)+CO2(g)=2CO(g)的反应中,其他条件不变的情况下,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③恒容下通入CO2 ④恒容下充入N2 ⑤恒压下充入N2,上述能够使反应速率增大的措施是
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
您最近一年使用:0次
2023-06-27更新
|
456次组卷
|
67卷引用:湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题
湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题(已下线)2013-2014山东省济宁市汶上一中高一5月质量检测化学试卷2015-2016学年山西省怀仁一中高一下第三次月考化学试卷2015-2016学年内蒙古包头九中高一6月月考化学试卷2016-2017学年天津市静海一中高二上9月调研化学试卷内蒙古北京八中乌兰察布分校2016-2017学年高一下学期第二次调考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题湖北省黄州中学2018-2019学年高二下学期5月月考化学试题黑龙江省大庆市铁人中学2019-2020学年高二上学期9月月考化学试题福建省福州市罗源第一中学2020-2021学年高二上学期10月月考化学试题安徽省桐城中学2020-2021学年高一上学期12月月考化学试题江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题广西钦州市浦北县浦北中学2020-2021学年高二3月月考化学试题天津市新华中学2020-2021学年高二上学期第一次月考化学试题江苏省连云港市赣榆智贤中学2021-2022学年高二上学期第一次月考化学试题吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题山西省大同市平城中学校2021-2022学年高二上学期10月月考化学试卷广东省珠海市第二中学2022-2023学年高二上学期10月月考化学试题广东省深圳实验学校高中部2022-2023学年高二上学期第一阶段考试化学试题山东菏泽市曹县一中2022-2023学年高一下学期5月月考化学试题陕西省延安中学新2022-2023学年高一下学期6月月考化学试题(已下线)同步君 人教版 选修4 第2章 第2节 影响化学反应速率的因素(已下线)同步君 必修2 第2章 第3节 化学反应速率湖北省宜昌市七校教学协作体2016-2017学年高二下学期期末考试化学试题黑龙江省大庆中学2016-2017学年高一下学期期末考试化学试题山西省怀仁县第一中学(两校区)2016-2017学年高一下学期期末考试化学试题(已下线)2.2 影响化学反应速率的因素山西省忻州市第一中学2016-2017学年高一下学期期末补考化学试题高中化学人教版 必修2 第二章 化学反应与能量 第三节 化学反应的速率和限度 化学反应速率高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第二节 影响化学反应速率的因素 影响化学反应速率的因素河南省三门峡市2017-2018学年高二上学期期末考试化学试题广东省揭西县河婆中学2018-2019学年高二上学期期中考试化学试题山西省运城市永济中学2019-2020学年高二上学期开学考试化学试题广东省蕉岭县蕉岭中学2019-2020学年高二上学期第一次段考化学试题江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中化学(统招班)试题江西省上饶中学2019-2020学年高二上学期期中考试(实验、重点班)化学试题第二节 化学反应的速率与限度 易错疑难集训(二)——A学习区 夯实基础(人教版(2019)第二册)第二章 化学反应与能量 易错疑难集训(二)——A学习区 夯实基础(人教版必修2)专题2 化学反应与能量转化 易错疑难集训(一)——A学习区 夯实基础(苏教版必修2)吉林省辽源市田家炳高级中学2019-2020学年高一下学期期中考试化学试题必修第二册RJ第6章易错疑难集训(二)福建省长泰县第一中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店第二中学2020-2021学年高二上学期期中考试化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题河北省张家口市宣化一中2020-2021学年高一下学期期初考试化学试题(已下线)第2章 化学反应与能量(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)(苏教版2019)必修第二册专题6 化学反应与能量变化 易错疑难集训(一)甘肃省永昌县第一高级中学2020-2021学年高一下学期期末考试化学试题甘肃省天水市秦安县第一中学2021-2022学年高一下学期期中考试化学试题 (已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)【期末复习】必刷题(2)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)吉林省长春市第二实验中学 2021-2022 学年高一下学期期中考试化学试题湖北省武汉市华中师范大学第一附属中学2021-2022学年高一下学期期中考试化学试题安徽省亳州市第二中学2021-2022学年高一下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题云南省砚山县第二高级中学2021-2022学年高二下学期期中(4月)考试化学试题黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题北京市第一六一中学2022-2023学年高一下学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高一下学期4月期中化学试题江西省景德镇市2022-2023学年高一下学期6月期末考试化学试题吉林省“BEST合作体”2022-2023学年高一下学期期末联考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高一下学期期末考试化学试题(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题江苏省扬州市广陵区红桥高级中学2023-2024学年高一下学期4月期中考试化学试题
10 . 氯化亚铜( )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下: 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤2是溶解过程,溶解时反应的离子方程式___________ 。
(3)步骤3为主反应, 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。___________ ;
②比较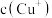 相对大小:A点
相对大小:A点___________ C点(填“>”、“<”或“=”);
③提高C点状态混合物中 沉淀率的措施是
沉淀率的措施是___________ ;
(4)步骤4进行的实验操作是___________ ;
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(6)产品纯度测定:称取 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。
① 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是___________ 。
②产品中 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为___________ 。
 )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下:
 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤2是溶解过程,溶解时反应的离子方程式
(3)步骤3为主反应,
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。
②比较
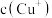 相对大小:A点
相对大小:A点③提高C点状态混合物中
 沉淀率的措施是
沉淀率的措施是(4)步骤4进行的实验操作是
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(6)产品纯度测定:称取
 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。①
 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是②产品中
 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为
您最近一年使用:0次
2023-05-31更新
|
709次组卷
|
7卷引用:湖南师范大学附属中学2024届高三上学期月考(二) 化学试题



