名校
解题方法
1 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为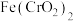 ,还含有
,还含有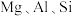 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾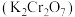 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时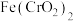 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
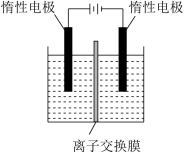
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
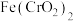 ,还含有
,还含有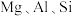 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾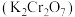 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
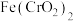 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为
(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近一年使用:0次
2 . 一定温度下,向三个容积不等的恒容密闭容器中分别投入2molNOCl,发生反应: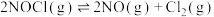 。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
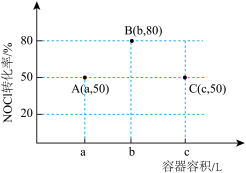
| A.A点加入适当催化剂,可以提高NOCl的转化率 |
| B.容积为aL的容器达到平衡后再投入1molNOCl、1molNO,平衡向左移动 |
| C.A、B两点的压强之比为25:28 |
| D.容积为cL的容器NOCl的平衡转化率大于80% |
您最近一年使用:0次
13-14高一下·山东济宁·阶段练习
名校
解题方法
3 . 在C(s)+CO2(g)=2CO(g)的反应中,其他条件不变的情况下,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③恒容下通入CO2 ④恒容下充入N2 ⑤恒压下充入N2,上述能够使反应速率增大的措施是
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
您最近一年使用:0次
2023-06-27更新
|
449次组卷
|
67卷引用:湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题
湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题(已下线)2013-2014山东省济宁市汶上一中高一5月质量检测化学试卷2015-2016学年山西省怀仁一中高一下第三次月考化学试卷2015-2016学年内蒙古包头九中高一6月月考化学试卷2016-2017学年天津市静海一中高二上9月调研化学试卷内蒙古北京八中乌兰察布分校2016-2017学年高一下学期第二次调考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题湖北省黄州中学2018-2019学年高二下学期5月月考化学试题黑龙江省大庆市铁人中学2019-2020学年高二上学期9月月考化学试题福建省福州市罗源第一中学2020-2021学年高二上学期10月月考化学试题安徽省桐城中学2020-2021学年高一上学期12月月考化学试题江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题广西钦州市浦北县浦北中学2020-2021学年高二3月月考化学试题天津市新华中学2020-2021学年高二上学期第一次月考化学试题江苏省连云港市赣榆智贤中学2021-2022学年高二上学期第一次月考化学试题吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题山西省大同市平城中学校2021-2022学年高二上学期10月月考化学试卷广东省珠海市第二中学2022-2023学年高二上学期10月月考化学试题广东省深圳实验学校高中部2022-2023学年高二上学期第一阶段考试化学试题山东菏泽市曹县一中2022-2023学年高一下学期5月月考化学试题陕西省延安中学新2022-2023学年高一下学期6月月考化学试题(已下线)同步君 人教版 选修4 第2章 第2节 影响化学反应速率的因素(已下线)同步君 必修2 第2章 第3节 化学反应速率湖北省宜昌市七校教学协作体2016-2017学年高二下学期期末考试化学试题黑龙江省大庆中学2016-2017学年高一下学期期末考试化学试题山西省怀仁县第一中学(两校区)2016-2017学年高一下学期期末考试化学试题(已下线)2.2 影响化学反应速率的因素山西省忻州市第一中学2016-2017学年高一下学期期末补考化学试题高中化学人教版 必修2 第二章 化学反应与能量 第三节 化学反应的速率和限度 化学反应速率高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第二节 影响化学反应速率的因素 影响化学反应速率的因素河南省三门峡市2017-2018学年高二上学期期末考试化学试题广东省揭西县河婆中学2018-2019学年高二上学期期中考试化学试题山西省运城市永济中学2019-2020学年高二上学期开学考试化学试题广东省蕉岭县蕉岭中学2019-2020学年高二上学期第一次段考化学试题江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中化学(统招班)试题江西省上饶中学2019-2020学年高二上学期期中考试(实验、重点班)化学试题第二节 化学反应的速率与限度 易错疑难集训(二)——A学习区 夯实基础(人教版(2019)第二册)第二章 化学反应与能量 易错疑难集训(二)——A学习区 夯实基础(人教版必修2)专题2 化学反应与能量转化 易错疑难集训(一)——A学习区 夯实基础(苏教版必修2)吉林省辽源市田家炳高级中学2019-2020学年高一下学期期中考试化学试题必修第二册RJ第6章易错疑难集训(二)福建省长泰县第一中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店第二中学2020-2021学年高二上学期期中考试化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题河北省张家口市宣化一中2020-2021学年高一下学期期初考试化学试题(已下线)第2章 化学反应与能量(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)(苏教版2019)必修第二册专题6 化学反应与能量变化 易错疑难集训(一)甘肃省永昌县第一高级中学2020-2021学年高一下学期期末考试化学试题甘肃省天水市秦安县第一中学2021-2022学年高一下学期期中考试化学试题 (已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)【期末复习】必刷题(2)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)吉林省长春市第二实验中学 2021-2022 学年高一下学期期中考试化学试题湖北省武汉市华中师范大学第一附属中学2021-2022学年高一下学期期中考试化学试题安徽省亳州市第二中学2021-2022学年高一下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题云南省砚山县第二高级中学2021-2022学年高二下学期期中(4月)考试化学试题黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题北京市第一六一中学2022-2023学年高一下学期期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高一下学期4月期中化学试题江西省景德镇市2022-2023学年高一下学期6月期末考试化学试题吉林省“BEST合作体”2022-2023学年高一下学期期末联考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高一下学期期末考试化学试题(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题江苏省扬州市广陵区红桥高级中学2023-2024学年高一下学期4月期中考试化学试题
4 . 氯化亚铜( )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下: 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤2是溶解过程,溶解时反应的离子方程式___________ 。
(3)步骤3为主反应, 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。___________ ;
②比较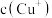 相对大小:A点
相对大小:A点___________ C点(填“>”、“<”或“=”);
③提高C点状态混合物中 沉淀率的措施是
沉淀率的措施是___________ ;
(4)步骤4进行的实验操作是___________ ;
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(6)产品纯度测定:称取 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。
① 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是___________ 。
②产品中 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为___________ 。
 )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下:
 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤2是溶解过程,溶解时反应的离子方程式
(3)步骤3为主反应,
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。
②比较
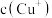 相对大小:A点
相对大小:A点③提高C点状态混合物中
 沉淀率的措施是
沉淀率的措施是(4)步骤4进行的实验操作是
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(6)产品纯度测定:称取
 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。①
 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是②产品中
 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为
您最近一年使用:0次
2023-05-31更新
|
709次组卷
|
7卷引用:湖南师范大学附属中学2024届高三上学期月考(二) 化学试题
名校
5 . 氨和硝酸是重要的化工原料,工业上常以N2为原料利用下列流程制备氨和硝酸。已知:“尾气处理”常用Na2CO3吸收含NOx尾气,发生的反应为:NO+NO2+Na2CO3=2NaNO2+CO2、2NO2+Na2CO3=NaNO2+NaNO3+CO2。下列说法正确的是
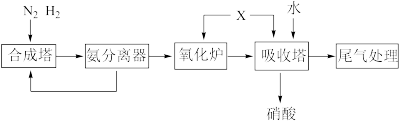

| A.氮元素在转化过程中均被氧化 |
| B.为提高“合成塔”平衡体系中NH3的百分含量,应选择高温、高压的条件 |
| C.HNO3中的氮原子采用的是sp3杂化形式 |
| D.将含NO和NO2共2mol的尾气通入Na2CO3溶液中,若NOx被完全吸收,则消耗的Na2CO3的物质的量为1mol |
您最近一年使用:0次
2023-05-18更新
|
204次组卷
|
2卷引用:湖南省新高考教学教研联盟(长郡十八校联盟)2022-2023学年高二下学期5月联考化学试题
名校
6 . 我国提出“ 排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发
排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发 的利用技术,降低空气中
的利用技术,降低空气中 的含量是实现该目标的重要途径。
的含量是实现该目标的重要途径。
(1)下面是用 捕捉
捕捉 时发生的两个反应:
时发生的两个反应:
I.

II.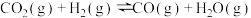

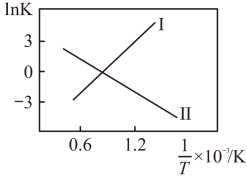
①反应I、II的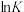 随
随 的变化如图所示,则
的变化如图所示,则
___________ 0(填“>”“<”或“=”)0;有利于该反应自发进行的温度是___________ (填“高温”或“低温”)。
②将一定量的 和
和 的混合气体充入密闭容器中,
的混合气体充入密闭容器中, 、
、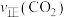 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低的原因是
降低的原因是___________ ,而速率仍然增大的可能原因是___________ 。

③220℃时,将4mol 与1mol
与1mol 的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,
的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡, 的转化率为80%,
的转化率为80%, 的选择性为33.3%,则生成的
的选择性为33.3%,则生成的 平均速率为
平均速率为___________ (保留两位有效数字),反应II的平衡常数 为
为___________ [已知: 的选择性
的选择性 ]
]
(2)利用化学链将高炉废气中的 转化为CO的示意图如下。
转化为CO的示意图如下。
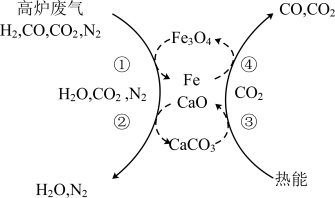
此过程中可循环利用的物质有___________ ,该化学链的总反应是___________ 。
 排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发
排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发 的利用技术,降低空气中
的利用技术,降低空气中 的含量是实现该目标的重要途径。
的含量是实现该目标的重要途径。(1)下面是用
 捕捉
捕捉 时发生的两个反应:
时发生的两个反应:I.


II.
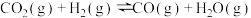

①反应I、II的
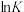 随
随 的变化如图所示,则
的变化如图所示,则

②将一定量的
 和
和 的混合气体充入密闭容器中,
的混合气体充入密闭容器中, 、
、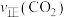 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低的原因是
降低的原因是
③220℃时,将4mol
 与1mol
与1mol 的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,
的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡, 的转化率为80%,
的转化率为80%, 的选择性为33.3%,则生成的
的选择性为33.3%,则生成的 平均速率为
平均速率为 为
为 的选择性
的选择性 ]
](2)利用化学链将高炉废气中的
 转化为CO的示意图如下。
转化为CO的示意图如下。
此过程中可循环利用的物质有
您最近一年使用:0次
2023-04-09更新
|
568次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三下学期4月份第八次月考化学试题
名校
解题方法
7 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| B | 改变反应物的浓度对平衡的影响 | 向5mL0.1mol/L,KSCN溶液中加入1mL0.1mol/LFeCl3溶液,达到平衡,然后再加入1mL0.1mol/LFeCl3,溶液红色加深 | 说明增加反应物浓度,化学平衡正向移动 |
| C | 比较Ksp(AgCl)和Ksp(AgI)的大小 | 取2mL0.1mol/LAgNO3溶液于试管中,加入1mL0.1mol/LNaCl溶液,再加入1mL0.1mol/LKI溶液,产生黄色沉淀 | 说明:Ksp(AgCl)>Ksp(AgI) |
| D | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-20更新
|
366次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三下学期月考试卷(七)化学试题
名校
解题方法
8 . 已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
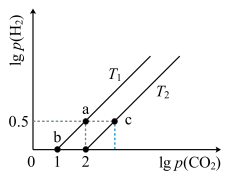
 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
A.a点时对应的Kp= (MPa) (MPa) |
| B.T1>T2 |
| C.c点对应的p(CO2)=1000MPa |
| D.当容器中CH4与CO的压强比为1∶2时,不能说明该反应达平衡状态 |
您最近一年使用:0次
2023-03-20更新
|
484次组卷
|
3卷引用:湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题
名校
9 . 变色硅胶干燥剂含有 ,根据颜色可判断干燥剂是否已经失效。已知
,根据颜色可判断干燥剂是否已经失效。已知 呈粉红色,
呈粉红色,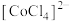 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: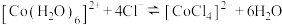
 ,将该溶液分为三份做实验,溶液的颜色变化如下:
,将该溶液分为三份做实验,溶液的颜色变化如下:
以下结论或解释正确的是
 ,根据颜色可判断干燥剂是否已经失效。已知
,根据颜色可判断干燥剂是否已经失效。已知 呈粉红色,
呈粉红色,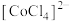 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: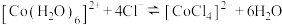
 ,将该溶液分为三份做实验,溶液的颜色变化如下:
,将该溶液分为三份做实验,溶液的颜色变化如下:| 装置 | 序号 | 操作 | 现象 |
 | ① | 将试管置于冰水浴中 | 溶液均呈粉红色 |
| ② | 加水稀释 | ||
| ③ | 加少量 固体 固体 |
A.由实验①可知: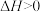 |
| B.由实验②可推知加水稀释,浓度商Q<K,平衡逆向移动 |
C.由实验③可知: 络合 络合 能力比 能力比 络合 络合 能力弱 能力弱 |
D.变色硅胶干燥剂含有 主要起干燥作用 主要起干燥作用 |
您最近一年使用:0次
2023-02-12更新
|
314次组卷
|
2卷引用:湖南省邵东市第一中学2022-2023学年高二下学期3月月考化学试题
9-10高二下·江西·期中
名校
10 . 有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
您最近一年使用:0次
2022-11-09更新
|
940次组卷
|
65卷引用:2016-2017学年湖南省长沙一中高一上月考三化学试卷
2016-2017学年湖南省长沙一中高一上月考三化学试卷(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学2015-2016学年河北省望都中学高二上学期第二次月考化学试卷2015-2016学年甘肃省张掖二中高二上学期10月月考化学试卷2015-2016学年海南省嘉积中学高二上12月段考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二上学期10月月考化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题四川省北大附中成都为明学校2019-2020学年高二9月月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题吉林省长春市第七中学2020-2021学年高二上学期第一次月考化学试题黑龙江省大庆中学2020-2021学年高二10月月考化学试题广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题湖北省老河口市一中2020-2021学年高二12月阶段性考试化学试题广东省广州市北师大附中为明学校2021-2022学年高二10月月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题河北省衡水市武强中学2021-2022学年高二上学期第三次月考化学试题山东省潍坊瀚声学校2021-2022学年高一下学期4月月考化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题天津市第八中学2021-2022学年高二上学期12月月考化学试题山东省滕州市第五中学2022-2023学年高一下学期5月月考化学试题天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题(已下线)09~10年江西四校高二下学期期中联考化学卷(已下线)2011届黑龙江省哈六中高三上学期期中考试化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(已下线)2014年高中化学人教版选修四模块质量检测练习卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷天津市武清区2017-2018学年高二上学期期中考试化学试题河北省唐山一中2017-2018学年高二上学期期中考试化学试题山东省日照黄海高级中学2017-2018学年高二上学期期中考试(理)化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2017-2018学年高一下学期期末考试化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题湖北省利川市第五中学2018-2019学年高二上学期期中模拟考试化学试题广东省揭阳市揭西县河婆中学2018-2019学年高二上学期期末化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题海南省海口市第四中学2019-2020学年高二上学期期末考试化学试题海南省琼山中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题浙江省台州市七校联盟2019-2020学年高二上学期期中联考化学试题重庆市沙坪坝区重庆市第七中学2020-2021高二上学期中考试化学试题宁夏海原第一中学2020-2021学年高二上学期第二次月考化学试题广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题内蒙古自治区土默特左旗第三中学2020-2021学年高二上学期期末考试化学试题内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题新疆阿克苏地区新和县实验中学2020-2021学年高二下学期期末考试化学试题云南省弥勒市第二中学2020-2021学年高二下学期期中考试化学试题(已下线)2.2.3 影响化学平衡的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)福建省永安市第九中学2022-2023学年高二上学期期中考试化学(选考)试题广东省揭阳普宁市普师高级中学2021-2022学年高二上学期期中考试化学试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题



