名校
解题方法
1 . 乙酰苯胺是一种无色有闪光的小叶状固体或白色晶性粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂。乙酰苯胺的一种制备原理为:
实验步骤:
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。
【步骤3】稍冷后,加入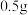 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。
【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称_____ 。
(2)【步骤1】加热可用_____ (填“水浴”或“油浴”)。
(3)制备过程中加入锌粉的作用为_____ 。
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在 左右的原因:
左右的原因:_____ 。
(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是_____ 。
(6)该实验最终得到纯品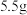 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为_____ (保留一位小数)。
(7)乙酰苯胺可以在 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:_____ 。
(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到_____ 现象时,反应基本结束。
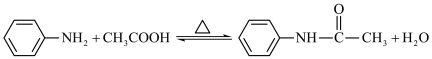
| 名称 | 相对分子质量 | 性状 | 密度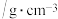 | 沸点/℃ | 溶解度 | 备注 |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚 | 易被氧化 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水,易溶于乙醇、乙醚 | |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺
 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。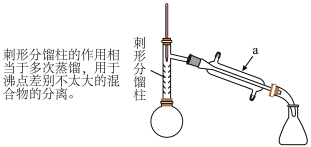
 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。【步骤3】稍冷后,加入
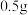 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称
(2)【步骤1】加热可用
(3)制备过程中加入锌粉的作用为
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在
 左右的原因:
左右的原因:(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是
(6)该实验最终得到纯品
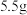 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为(7)乙酰苯胺可以在
 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到

您最近一年使用:0次
名校
解题方法
2 . 已知 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: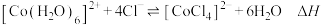 ,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是
,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是

 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: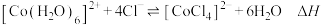 ,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是
,用该溶液做实验,溶液的颜色变化如图,以下结论和解释正确的是
A.等物质的量的 和 和 中 中 键数之比为 键数之比为 |
B.由实验①可推知 |
C. 中配体为 中配体为 ,它提供空轨道,配位数为6 ,它提供空轨道,配位数为6 |
D.由实验③可知配离子的稳定性: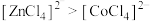 |
您最近一年使用:0次
2023-03-20更新
|
307次组卷
|
3卷引用:重庆市渝高中学校2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
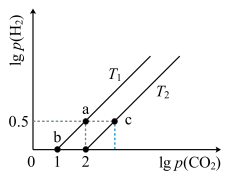
3 . 已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
A.a点时对应的Kp= (MPa) (MPa) |
| B.T1>T2 |
| C.c点对应的p(CO2)=1000MPa |
| D.当容器中CH4与CO的压强比为1∶2时,不能说明该反应达平衡状态 |
您最近一年使用:0次
2023-03-20更新
|
484次组卷
|
3卷引用:重庆市巴蜀中学校2023届高三适应性月考卷(七)化学试题
名校
解题方法
4 . 乙烯是制造塑料、合成橡胶和合成纤维等化学产品的基本原料,乙烷直接裂解、乙烷二氧化碳氧化裂解和乙烷氧气氧化裂解和乙烷氧气氧化裂解制备乙烯的反应如下:
(Ⅰ)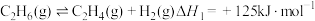
(II)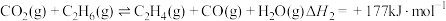
(III)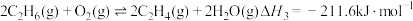
回答下列问题:
(1)已知键能: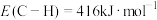 ,
,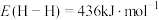 ,由此计算生成
,由此计算生成 碳碳
碳碳 键放出的能量为
键放出的能量为___________ kJ。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的是___________(填序号)。
(3)K为平衡常数, 与温度的倒数
与温度的倒数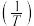 的变化如图所示,a,b两条直线中表示反应(II)的直线是
的变化如图所示,a,b两条直线中表示反应(II)的直线是___________ (填字母),理由是___________ 。

(4) 时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为
时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为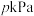 ,此时乙烷的平衡转化率为
,此时乙烷的平衡转化率为 ,反应的平衡常数
,反应的平衡常数 =
=___________  (用题中所给字母表示,并化简,分压=总压×物质的量分数)。
(用题中所给字母表示,并化简,分压=总压×物质的量分数)。
(5)已知Arrhenius经验公式 (
( 为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能
为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能 =
=___________  。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是
。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是___________ 。

(6)电有机合成是制备有机物的一种常用方法,相关研究团队利用电化学装置实现 和
和 两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为
两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为___________ 。若生成的乙烯和乙烷的体积比为3:1,则消耗的 和
和 ,物质的量之比为
,物质的量之比为___________ 。
(Ⅰ)
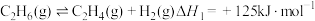
(II)
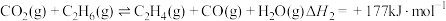
(III)
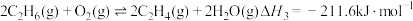
回答下列问题:
(1)已知键能:
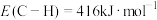 ,
,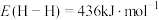 ,由此计算生成
,由此计算生成 碳碳
碳碳 键放出的能量为
键放出的能量为(2)上述反应体系在一定条件下建立平衡后,下列说法正确的是___________(填序号)。
| A.反应(I)加入催化剂,可降低反应的焓变 |
| B.恒压掺入Ar能提高反应(II)的平衡产率 |
| C.降低温度,反应(II)的正反应速率降低、逆反应速率增大 |
| D.增加乙烷的浓度,反应(I)和(II)的平衡均向右移动 |
(3)K为平衡常数,
 与温度的倒数
与温度的倒数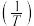 的变化如图所示,a,b两条直线中表示反应(II)的直线是
的变化如图所示,a,b两条直线中表示反应(II)的直线是
(4)
 时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为
时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为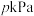 ,此时乙烷的平衡转化率为
,此时乙烷的平衡转化率为 ,反应的平衡常数
,反应的平衡常数 =
= (用题中所给字母表示,并化简,分压=总压×物质的量分数)。
(用题中所给字母表示,并化简,分压=总压×物质的量分数)。(5)已知Arrhenius经验公式
 (
( 为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能
为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能 =
= 。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是
。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是
(6)电有机合成是制备有机物的一种常用方法,相关研究团队利用电化学装置实现
 和
和 两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为
两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为 和
和 ,物质的量之比为
,物质的量之比为
您最近一年使用:0次
2022-12-16更新
|
273次组卷
|
2卷引用:重庆市第八中学校2023届高三上学期高考适应性月考卷(四)化学试题
名校
5 . 下列三个反应均可用:aA(g)+B(g)⇌cC(g)表示,条件改变时变化如图所示(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
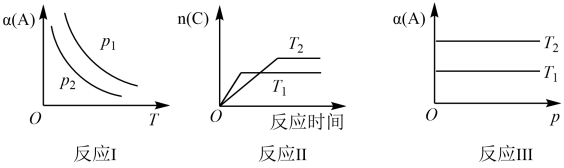

| A.反应I中,达平衡后升高温度,K值增大 |
| B.反应I中,若p2>p1,则有a+1<c |
| C.反应II中,达平衡后降低温度,C的体积分数减小 |
| D.反应III中,若T1>T2,则该反应一定不能自发进行 |
您最近一年使用:0次
2022-03-25更新
|
587次组卷
|
6卷引用:重庆市大足中学2022-2023学年高二上学期学期第一次月考化学试题
6 . 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌ N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
 N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
您最近一年使用:0次
2021-10-26更新
|
470次组卷
|
14卷引用:重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题
重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题广东省梅州市大埔县虎山中学2021-2022学年高二上学期第一次段考(10月)化学试题辽宁师范大学附属中学2021-2022学年高二上学期10月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题浙江省嘉兴市海盐第二高级中学2021-2022学年高二上学期(10月)阶段检测化学试题河南省新教材2022-2023学年高二上学期第三次阶段性模拟测试化学试题浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题西藏林芝市第二高级中学2021-2022学年高二上学期期中考试理综化学试题广东省广州市第二中学2022-2023学年高二上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题
名校
7 . 下列关于化学平衡的叙述,正确的是
A.2NO2(g)  N2O4(g) ΔH < 0,反应达平衡后,压缩体系体积,平衡正向移动,体系颜色变浅 N2O4(g) ΔH < 0,反应达平衡后,压缩体系体积,平衡正向移动,体系颜色变浅 |
B.H2(g)+I2(g)  2HI(g) ΔH < 0,反应达平衡后,增大体系体积,平衡不移动,体系颜色不变 2HI(g) ΔH < 0,反应达平衡后,增大体系体积,平衡不移动,体系颜色不变 |
C.FeCl3(aq)+3KSCN(aq)  Fe(SCN)3(aq)+3KCl(aq),反应达平衡后,向体系中加入少量 KCl 固体,平衡逆向移动,体系颜色变浅 Fe(SCN)3(aq)+3KCl(aq),反应达平衡后,向体系中加入少量 KCl 固体,平衡逆向移动,体系颜色变浅 |
D.N2(g)+3H2(g)  2NH3(g),反应达平衡后,保持体系压强不变,充入He,平衡逆向移动,体系中NH3的体积分数减小 2NH3(g),反应达平衡后,保持体系压强不变,充入He,平衡逆向移动,体系中NH3的体积分数减小 |
您最近一年使用:0次
2021-10-13更新
|
746次组卷
|
10卷引用:重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题
重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题四川省成都市第七中学2020-2021学年高二上学期十月阶段性考试化学试题四川省成都外国语学校2021-2022学年高二上学期10月月考化学试题江西省吉安市遂川中学2021-2022学年高二上学期第三次月考(B)化学试题宁夏石嘴山市第三中学2021-2022学年高二下学期第一次月考化学试题安徽省池州市第一中学2020-2021学年高二上学期期中考试化学试题江西省南昌市八一中学2020-2021学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题2021年辽宁高考化学试题变式题11-19黑龙江省牡丹江穆棱市第二中学2021-2022学年高二上学期期末考试化学试题
名校
8 . 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:aA(g)+bB(s) mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
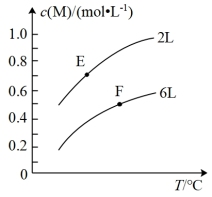
 mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
| A.a>m+n | B.达到平衡后,增大B的量将会提高A的转化率 |
| C.E点的平衡常数小于F点的平衡常数 | D.Q>0 |
您最近一年使用:0次
2021-09-27更新
|
994次组卷
|
8卷引用:重庆市朝阳中学2021-2022学年高二12月月考化学试题
名校
解题方法
9 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
II.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
III.CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=___________ (用含△H1、△H2、△H3的代数表示)。
(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
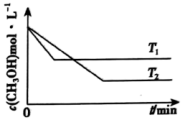
①△H___________ (填“>”“<”或“=”)0,说明理由___________ 。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为___________ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2III.CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3则3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
①△H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
您最近一年使用:0次
2021-07-02更新
|
1679次组卷
|
7卷引用:重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题
重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题广西河池市九校2020-2021学年高二下学期第二次联考化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.3 影响化学平衡的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南宏力学校2021-2022学年高二上学期期中考试化学试题浙江省杭师大附中2022-2023学年高二上学期期中考试 化学试题
名校
10 . 利用传感技术可以探究压强对2NO2(g)  N2O4(g)化学 平衡移动的影响。在室温、100kPa条件下,往针中筒充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、 t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
N2O4(g)化学 平衡移动的影响。在室温、100kPa条件下,往针中筒充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、 t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是

 N2O4(g)化学 平衡移动的影响。在室温、100kPa条件下,往针中筒充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、 t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
N2O4(g)化学 平衡移动的影响。在室温、100kPa条件下,往针中筒充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、 t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
| A.B点处NO2的转化率为3% |
| B.E点到H点的过程中,NO2的物质的量先增大后减小 |
| C.E、H两点对应的正反应速率大小为vH=vE |
| D.B、H两点气体的平均相对分子质量大小为MB=MH |
您最近一年使用:0次
2021-05-20更新
|
376次组卷
|
5卷引用:重庆市万州第二高级中学教育集团2023-2024学年高二上学期10月月考化学试题
重庆市万州第二高级中学教育集团2023-2024学年高二上学期10月月考化学试题天津市南开中学2023届高三5月月考化学试题天津市南开中学2021届高三年级第5次月考(二模)化学试题(已下线)第七章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)2.3.2 压强变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)



