解题方法
1 .  和
和 是两种常见的温室气体,利用
是两种常见的温室气体,利用 和
和 生成高附加值合成气CO和
生成高附加值合成气CO和 ,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
(1)已知: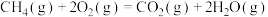
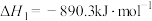 ;
;
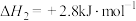 ;
;
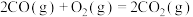
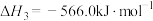 。
。
反应 的
的
________  ;对于该反应,有利于提高
;对于该反应,有利于提高 平衡转化率的条件是
平衡转化率的条件是________ (填字母)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)CO常用于工业冶炼金属,如图是在不同温度下CO还原三种金属氧化物达平衡后气体中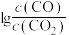 与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
(3)甲烷部分催化裂解制备乙烯的反应原理为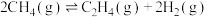
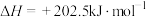 。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入
。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入 ,平衡时
,平衡时 转化率为40%,若温度、压强和
转化率为40%,若温度、压强和 初始量不变,充入
初始量不变,充入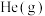 作为稀释气,平衡时
作为稀释气,平衡时 转化率为50%,则充入He的物质的量为
转化率为50%,则充入He的物质的量为________ mol。
(4)一定温度下,将 充入2L的固定容积容器中发生反应
充入2L的固定容积容器中发生反应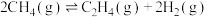
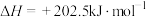 。实验测得容器内各气体分压与时间的关系如图所示。
。实验测得容器内各气体分压与时间的关系如图所示。 的平衡转化率为
的平衡转化率为________ 。
②反应的平衡常数
________ 。
③若在该温度下,向容器中再充入 ,达到平衡时,平衡混合物中
,达到平衡时,平衡混合物中 的物质的量分数
的物质的量分数________ (填“增大”“减小”或“不变”)。
 和
和 是两种常见的温室气体,利用
是两种常见的温室气体,利用 和
和 生成高附加值合成气CO和
生成高附加值合成气CO和 ,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:
,以及甲烷部分催化裂解制备乙烯是目前研究的热点之一。回答下列问题:(1)已知:
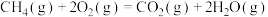
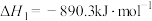 ;
;
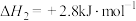 ;
;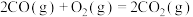
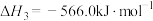 。
。反应
 的
的
 ;对于该反应,有利于提高
;对于该反应,有利于提高 平衡转化率的条件是
平衡转化率的条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)CO常用于工业冶炼金属,如图是在不同温度下CO还原三种金属氧化物达平衡后气体中
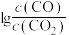 与温度(T)的关系曲线图。下列说法正确的是________(填字母)。
与温度(T)的关系曲线图。下列说法正确的是________(填字母)。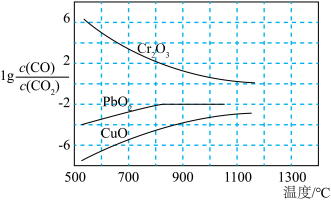
A.CO还原 的反应 的反应 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜时较低的温度有利于提高CO的利用率 |
| D.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
(3)甲烷部分催化裂解制备乙烯的反应原理为
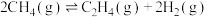
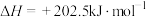 。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入
。温度为T℃,压强为100kPa时,向体积可变的密闭容器中加入 ,平衡时
,平衡时 转化率为40%,若温度、压强和
转化率为40%,若温度、压强和 初始量不变,充入
初始量不变,充入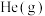 作为稀释气,平衡时
作为稀释气,平衡时 转化率为50%,则充入He的物质的量为
转化率为50%,则充入He的物质的量为(4)一定温度下,将
 充入2L的固定容积容器中发生反应
充入2L的固定容积容器中发生反应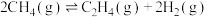
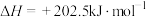 。实验测得容器内各气体分压与时间的关系如图所示。
。实验测得容器内各气体分压与时间的关系如图所示。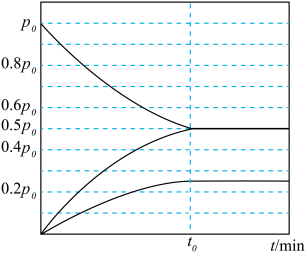
 的平衡转化率为
的平衡转化率为②反应的平衡常数

③若在该温度下,向容器中再充入
 ,达到平衡时,平衡混合物中
,达到平衡时,平衡混合物中 的物质的量分数
的物质的量分数
您最近一年使用:0次
解题方法
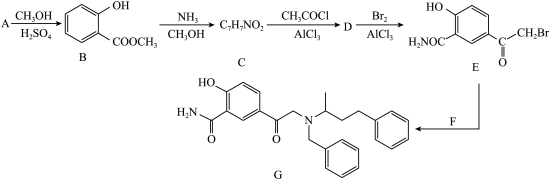
2 . 药物Labetalol适用于治疗轻度至重度高血压和心绞痛,化合物G是合成它的前体,其合成路线如图:
已知:苯胺( )与甲基吡啶(
)与甲基吡啶(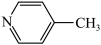 )互为同分异构体,吡啶(
)互为同分异构体,吡啶(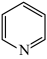 )是类似于苯的芳香化合物。回答下列问题:
)是类似于苯的芳香化合物。回答下列问题:
(1)A的化学名称为_______ 。
(2)在A→B的转化中,加入过量CH3OH的作用除作溶剂外还有_______ 。
(3)B中所含官能团的名称为_______ 。
(4)C→D的反应方程式为_______ 。
(5)由B生成C的反应类型为_______ 。
(6)F的结构简式为_______ 。
(7)C有多种同分异构体,其中满足以下条件的结构简式为______ 、______ 。
①含有六元芳香环
②能与NaHCO3溶液反应
③核磁共振氢谱的峰面积之比为2∶2∶2∶1

已知:苯胺(
 )与甲基吡啶(
)与甲基吡啶( )互为同分异构体,吡啶(
)互为同分异构体,吡啶( )是类似于苯的芳香化合物。回答下列问题:
)是类似于苯的芳香化合物。回答下列问题:(1)A的化学名称为
(2)在A→B的转化中,加入过量CH3OH的作用除作溶剂外还有
(3)B中所含官能团的名称为
(4)C→D的反应方程式为
(5)由B生成C的反应类型为
(6)F的结构简式为
(7)C有多种同分异构体,其中满足以下条件的结构简式为
①含有六元芳香环
②能与NaHCO3溶液反应
③核磁共振氢谱的峰面积之比为2∶2∶2∶1
您最近一年使用:0次
3 . I.等物质的量的A、B、C、D四种物质混合,发生如下反应:aA(?)+bB(?)cC(s)+dD(?),当反应达到平衡时,测得A减少nmol,B减少 mol,C增加
mol,C增加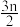 mol,D增加nmol。
mol,D增加nmol。
(1)该反应的各系数a=_______ ,b=_______ ,c=_______ ,d=_______ 。
(2)若只改变压强,反应速率发生变化,但平衡不移动,该反应中物质的聚集状是A_______ 态、B_______ 态、D_______ 态。
(3)若只升高温度,反应一段时间后,测得四种物质的量又达到相等,则ΔH_______ 0。(填“>”、“<”)
II.在一定条件下,xA+yB⇌zC的可逆反应达到平衡。
(4)已知A、B、C均为气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是_______ 。
(5)已知C是气体且x+y=z,在加压时如果平衡发生移动,则平衡必向_______ 方向移动(填“正反应”或“逆反应”)。
(6)①一定温度下,在密闭容器中充入1molN2和3molH2发生反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率a1=
,则N2的转化率a1=_______ ;
②若向该容器中再加入3molH2,达到平衡状态时,N2的转化率为a2,则a2_______ a1(填“>”、“<”或“=”)。
 mol,C增加
mol,C增加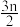 mol,D增加nmol。
mol,D增加nmol。(1)该反应的各系数a=
(2)若只改变压强,反应速率发生变化,但平衡不移动,该反应中物质的聚集状是A
(3)若只升高温度,反应一段时间后,测得四种物质的量又达到相等,则ΔH
II.在一定条件下,xA+yB⇌zC的可逆反应达到平衡。
(4)已知A、B、C均为气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是
(5)已知C是气体且x+y=z,在加压时如果平衡发生移动,则平衡必向
(6)①一定温度下,在密闭容器中充入1molN2和3molH2发生反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
 ,则N2的转化率a1=
,则N2的转化率a1=②若向该容器中再加入3molH2,达到平衡状态时,N2的转化率为a2,则a2
您最近一年使用:0次
4 . “加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题。工业生产产生的含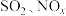 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
(1)在一定条件下,肼( )与
)与 反应能生成
反应能生成 和
和 。
。
已知:①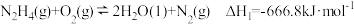 ;
;
②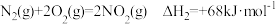 ;
;
③ ;
;
则反应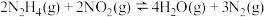 的
的
_______  。
。
(2)在一恒容密闭容器中发生反应: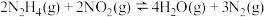 。当温度高于250℃时,正、逆反应速率分别为
。当温度高于250℃时,正、逆反应速率分别为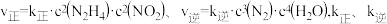 分别为正、逆反应速率常数,
分别为正、逆反应速率常数, 、
、 与该反应的平衡常数
与该反应的平衡常数 之间的关系为
之间的关系为_______ 。速率常数 随温度的升高而增大,则达到平衡后,仅升高温度,
随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“>”、“<”或“=”) 增大的倍数。
增大的倍数。
(3)在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为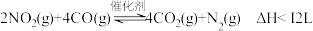 。向两个容积均为2L的恒容密闭容器中均分别充入
。向两个容积均为2L的恒容密闭容器中均分别充入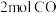 和
和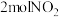 ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为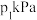 ,曲线II代表的体系平衡后气体的总压强为
,曲线II代表的体系平衡后气体的总压强为 。
。
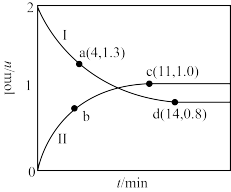
①代表220℃条件下的变化曲线为___ (填“I”或“II”);ad段 的平均反应速率为
的平均反应速率为__  。
。
②下列有关曲线II条件下的反应的说法正确的是_______ (填标号)。
A.当体系中 与
与 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
的转化率
③图中a、c、d三点对应的逆反应速率由大到小的顺序为_______ (用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp=_______  (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
(Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
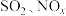 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。(1)在一定条件下,肼(
 )与
)与 反应能生成
反应能生成 和
和 。
。已知:①
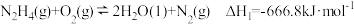 ;
;②
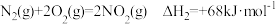 ;
;③
 ;
;则反应
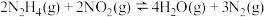 的
的
 。
。(2)在一恒容密闭容器中发生反应:
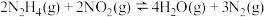 。当温度高于250℃时,正、逆反应速率分别为
。当温度高于250℃时,正、逆反应速率分别为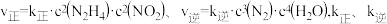 分别为正、逆反应速率常数,
分别为正、逆反应速率常数, 、
、 与该反应的平衡常数
与该反应的平衡常数 之间的关系为
之间的关系为 随温度的升高而增大,则达到平衡后,仅升高温度,
随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为
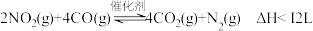 。向两个容积均为2L的恒容密闭容器中均分别充入
。向两个容积均为2L的恒容密闭容器中均分别充入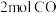 和
和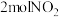 ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为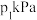 ,曲线II代表的体系平衡后气体的总压强为
,曲线II代表的体系平衡后气体的总压强为 。
。
①代表220℃条件下的变化曲线为
 的平均反应速率为
的平均反应速率为 。
。②下列有关曲线II条件下的反应的说法正确的是
A.当体系中
 与
与 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高
 的转化率
的转化率③图中a、c、d三点对应的逆反应速率由大到小的顺序为
 (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
(Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
2021-05-27更新
|
408次组卷
|
6卷引用:内蒙古自治区赤峰第四中学200-2021学年高三下学期五月月考理综试题
名校
解题方法
5 . I.(1)写出H2CO3的电离方程式:__________________________________________ 。
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①﹦②
①当它们物质的量浓度相等时,中和等体积、等物质的量浓度的烧碱溶液需两种酸溶液的体积关系为____________ 。
②当它们氢离子浓度相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为____________ 。
II.煤化工产业中常用合成气(主要成分是氢气和一氧化碳气体)合成氨和甲醇。请回答:
(1)工业合成氨的化学方程式为N2+3H2 2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为
2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________ 。
(2)合成甲醇的主要反应是2H2(g)+CO(g) CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
①该时间段内反应速率v(H2)=________ 。
②比较此时正、逆反应速率的大小:v正________ v逆(填“>”、“<”或“=”)。
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡______ (填“逆向”、“正向”或“不”)移动,平衡常数K_________ (填“增大”、“减小”或“不变”)。
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①﹦②
①当它们物质的量浓度相等时,中和等体积、等物质的量浓度的烧碱溶液需两种酸溶液的体积关系为
②当它们氢离子浓度相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
II.煤化工产业中常用合成气(主要成分是氢气和一氧化碳气体)合成氨和甲醇。请回答:
(1)工业合成氨的化学方程式为N2+3H2
 2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为
2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为(2)合成甲醇的主要反应是2H2(g)+CO(g)
 CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:| 物质 | H2 | CO | CH3OH |
| 浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=
②比较此时正、逆反应速率的大小:v正
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡
您最近一年使用:0次
名校
解题方法
6 . 将一定量的NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,各物质的浓度随时间的变化如图1所示,请回答下列问题:

(1)图1中,曲线_______ (填“X”或“Y”)表示NO2浓度随时间的变化情况,前10min内v(NO2)=_______ mol/(L· min);
(2)下列选项中不能说明该反应已达到平衡状态的是____ (填选项字母)
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为______________________ ,该反应的平衡常数K=_____________ ;
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1______ w2(填“>”“=”或“<”)
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)________________


(1)图1中,曲线
(2)下列选项中不能说明该反应已达到平衡状态的是
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)

您最近一年使用:0次
名校
解题方法
7 . 在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________ 。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________ 。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度________ (填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是____________ 。
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=_____________ 。
 CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度
(4)能判断该反应是否达到化学平衡状态的依据是
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=
您最近一年使用:0次
2019-05-26更新
|
375次组卷
|
3卷引用:【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题
【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题
解题方法
8 . I.研究CO2、CO的利用对促进低碳社会的构建具有重要意义,CO2、CO都可用于合成甲醇。CO2用于合成甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
①该反应的平衡常数表达式为K=____________________ 。
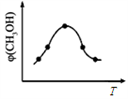
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH_______ 0(填“>”、“<”或“=”)。
Ⅱ.甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。
已知甲醇制备的有关化学反应如下
反应①:CO(g)+2H2(g)=CH3OH(g) △H1=﹣90.77kJ•mol—1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.19kJ•mol—1
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3
(1)反应③的△H3=__________________ 。
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=_____ (用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时 V正_____ V逆(填“>”、“=”或“<”).
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______ 。当通过改变压强使曲线Ⅰ变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为___________________ 。
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H①该反应的平衡常数表达式为K=
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH

Ⅱ.甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。
已知甲醇制备的有关化学反应如下
反应①:CO(g)+2H2(g)=CH3OH(g) △H1=﹣90.77kJ•mol—1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.19kJ•mol—1
反应③:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3
(1)反应③的△H3=
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线Ⅰ所示。若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
您最近一年使用:0次



