1 . 异丁烯是一种重要的化工原料,主要用于制备甲基叔丁基醚、丁基橡胶、甲基丙烯腈等。将异丁烷脱氢制备异丁烯,可提高异丁烷的附加值,具有良好的经济与社会效益。回答下列问题。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
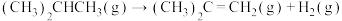 ∆H=
∆H=____________ kJ·mol-1。
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成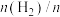 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。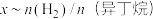 为曲线
为曲线_________ (填“M”或“N”),催化剂易被副反应产生的加聚产物__________ (填写结构简式)影响而失活。
(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是_____________ ,若生产过程中加入的空气过多,产生的主要问题是_____________ 。
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属_____________ (填元素符号)是酸性位点;而电负性较小的金属是碱性位点,吸附________________ (填“异丁烷”或“CO2”)。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
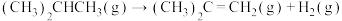 ∆H=
∆H=| 物质 | 异丁烷(g) | 异丁烯(g) | 氢气(g) |
| 燃烧热/(kJ·mol-1) | 2868 | 2700 | 286 |
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成
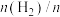 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
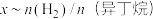 为曲线
为曲线(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属
您最近一年使用:0次
2024-03-22更新
|
112次组卷
|
2卷引用:江苏省南京市金陵中学2022-2023学年高二下学期期中考试 化学试卷
2 . 肼(N2H4)是一种应用广泛的化工原料。
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式___________ 。
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
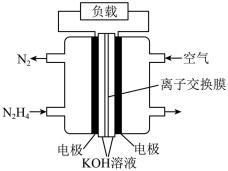
①负极的电极反应式为___________ 。
②电池工作时电子从___________ 电极经过负载后流向___________ 电极(填“左侧”或“右侧”)。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为___________ g。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):
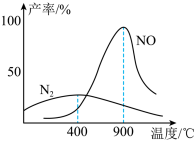
温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=________ 。
②1000℃,反应b达到平衡时,下列措施能使容器中 增大的是
增大的是________ 。
A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。

①负极的电极反应式为
②电池工作时电子从
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):

温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=
②1000℃,反应b达到平衡时,下列措施能使容器中
 增大的是
增大的是A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
您最近一年使用:0次
3 . 金属铬耐腐蚀,可做镀层金属, 致癌,国家对废水中Cr含量有严格的排放标准。已知:
致癌,国家对废水中Cr含量有严格的排放标准。已知: ;
; ;氧化性强弱:
;氧化性强弱: ;
;
(1)焦亚硫酸钠除铬法
①可以选择焦亚硫酸钠或亚硫酸钠( 在酸性条件下分解为
在酸性条件下分解为 、
、 )处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
)处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:

反应池中发生反应的离子方程式_____ 。
②其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是_____ 。
③室温下,加入石灰乳调节pH,当 时,pH>
时,pH>_____ 。
(2) Fe3O4/纳米Fe除铬法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
(ii)依据如下两个图示信息,上述实验3降解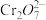 效率增大的原因是
效率增大的原因是_____ 。

(3)电解除铬法:
已知:电解除铬过程中主要反应: ;
;

①图3中气体a的主要成分是_____ 。
②在电解过程中,不同pH、通电时间与Cr元素的去除率关系如图4所示,其中pH=10比pH=4时Cr元素去除率低的原因可能是_____ 。
 致癌,国家对废水中Cr含量有严格的排放标准。已知:
致癌,国家对废水中Cr含量有严格的排放标准。已知: ;
; ;氧化性强弱:
;氧化性强弱: ;
;(1)焦亚硫酸钠除铬法
①可以选择焦亚硫酸钠或亚硫酸钠(
 在酸性条件下分解为
在酸性条件下分解为 、
、 )处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
)处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
反应池中发生反应的离子方程式
②其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
③室温下,加入石灰乳调节pH,当
 时,pH>
时,pH>(2) Fe3O4/纳米Fe除铬法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的
 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。| 实验编号 | 纳米Fe(g/L) | Fe3O4 (g/L) |  实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
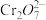 效率增大的原因是
效率增大的原因是
(3)电解除铬法:
已知:电解除铬过程中主要反应:
 ;
;
①图3中气体a的主要成分是
②在电解过程中,不同pH、通电时间与Cr元素的去除率关系如图4所示,其中pH=10比pH=4时Cr元素去除率低的原因可能是
您最近一年使用:0次
名校
4 . 硝基苯( )是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。
)是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。
(1) 与Fe、盐酸反应生成可生物降解的苯胺(
与Fe、盐酸反应生成可生物降解的苯胺( )、FeCl2和H2O。理论上,1mol
)、FeCl2和H2O。理论上,1mol 转化为
转化为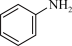 转移的电子的物质的量为
转移的电子的物质的量为___________ 。
(2)在酸性条件下,铁炭混合物处理污水中硝基苯时,硝基苯转化过程如下: 。
。 转化为
转化为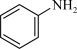 的电极反应式:
的电极反应式:___________ 。在其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是___________ 。 )的酸性溶液中加入双氧水,发生如下反应:Fe2++H++H2O2=Fe3++HO•+H2O
)的酸性溶液中加入双氧水,发生如下反应:Fe2++H++H2O2=Fe3++HO•+H2O
①HO•具有强氧化性,能将溶液中的苯胺氧化成CO2和N2.,该反应的离子方程式为___________ 。
②H2O2也具有氧化性,设计验证苯胺是被HO•氧化而不是被H2O2氧化的实验方案:___________ 。
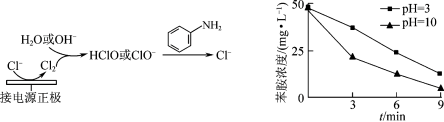
(4)利用电解原理也可以间接氧化处理含苯胺的污水,其原理如下图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是___________ 。(已知:ClO-随着pH减小,氧化性增强)
 )是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。
)是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。(1)
 与Fe、盐酸反应生成可生物降解的苯胺(
与Fe、盐酸反应生成可生物降解的苯胺( )、FeCl2和H2O。理论上,1mol
)、FeCl2和H2O。理论上,1mol 转化为
转化为 转移的电子的物质的量为
转移的电子的物质的量为(2)在酸性条件下,铁炭混合物处理污水中硝基苯时,硝基苯转化过程如下:
 。
。 转化为
转化为 的电极反应式:
的电极反应式: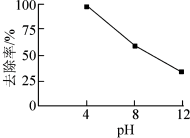
 )的酸性溶液中加入双氧水,发生如下反应:Fe2++H++H2O2=Fe3++HO•+H2O
)的酸性溶液中加入双氧水,发生如下反应:Fe2++H++H2O2=Fe3++HO•+H2O①HO•具有强氧化性,能将溶液中的苯胺氧化成CO2和N2.,该反应的离子方程式为
②H2O2也具有氧化性,设计验证苯胺是被HO•氧化而不是被H2O2氧化的实验方案:
(4)利用电解原理也可以间接氧化处理含苯胺的污水,其原理如下图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是
您最近一年使用:0次
5 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。硝基苯是一种具有稳定化学性质、高毒性、难生物降解的污染物。工业上采用吸附、还原、氧化等方法可有效降解废水中的硝基苯。
(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:______________________ (请从平衡移动角度解释)。

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:___________ 。
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯( ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:___________ 。
③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:___________ 。

(3)研究发现, 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:___________ 。
(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是___________ 。[已知氧化性: ]
]

(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯(
 ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:

(3)研究发现,
 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液
 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是 ]
]
您最近一年使用:0次
6 . 著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面所作出的贡献。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图(铈常见的化合价为+3和+4):
的一种工艺流程如图(铈常见的化合价为+3和+4):
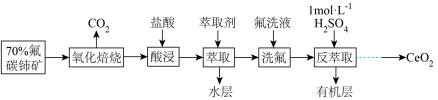
(1)氟碳铈矿“氧化焙烧”生成 ,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是
,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是___________ 。
(2)“酸浸”过程中产生大量黄绿色气体,写出 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:___________ 。
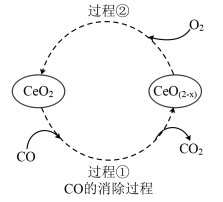
(3)有机物HT能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 (水层)+3HT(有机层)
(水层)+3HT(有机层)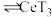 (有机层)
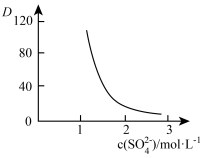
(有机层)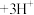 (水层)。保持其它条件不变时,分配比D(D表示
(水层)。保持其它条件不变时,分配比D(D表示 分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中
分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中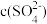 变化如图所示。“反萃取”时,工业上常选用
变化如图所示。“反萃取”时,工业上常选用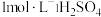 ,其作用为:
,其作用为:___________ ;同时还加入一定量的 的原因:
的原因:___________ 。
(4) 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式___________ 。尾气消除过程中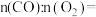
___________
 )为原料制备
)为原料制备 的一种工艺流程如图(铈常见的化合价为+3和+4):
的一种工艺流程如图(铈常见的化合价为+3和+4):
(1)氟碳铈矿“氧化焙烧”生成
 ,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是
,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是(2)“酸浸”过程中产生大量黄绿色气体,写出
 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:(3)有机物HT能将
 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 (水层)+3HT(有机层)
(水层)+3HT(有机层)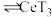 (有机层)
(有机层)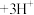 (水层)。保持其它条件不变时,分配比D(D表示
(水层)。保持其它条件不变时,分配比D(D表示 分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中
分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中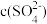 变化如图所示。“反萃取”时,工业上常选用
变化如图所示。“反萃取”时,工业上常选用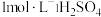 ,其作用为:
,其作用为: 的原因:
的原因:
(4)
 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式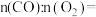

您最近一年使用:0次
名校
7 . 处理含铬[Cr(Ⅵ)]废水的方法有化学沉淀法、铝还原回收法等。
(1)钡盐沉铬法:
已知水溶液中 (橙色)可转化为
(橙色)可转化为 (黄色),该可逆反应用离子方程式可表示为
(黄色),该可逆反应用离子方程式可表示为___________ ;向含Cr(Ⅵ)的酸性废水中加入钡盐,生成难溶于水的 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是___________ ;
(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量 ,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。
,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。

①写出 将
将 还原为
还原为 的离子方程式
的离子方程式___________ ;
②实际生产中,还原反应控制pH为2.5左右的原因是___________ ;
(3)还原回收Cr(Ⅵ)法:
步骤1:向含Cr(Ⅵ)的酸性溶液中加入一定量的铝粉,充分反应,过滤。
步骤Ⅱ:利用步骤Ⅰ过滤后得到的溶液(含有 、
、 、
、 )获得
)获得 。
。
①研究发现,若步骤Ⅰ中pH偏低将会导致Cr(Ⅵ)的去除率下降,其原因是___________ ;
②获得 和
和 的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8,
的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8,___________ ,得到 和
和 的混合溶液。(实验中须用到的试剂:KOH溶液、
的混合溶液。(实验中须用到的试剂:KOH溶液、 溶液、稀硫酸)
溶液、稀硫酸)
已知:
ⅰ.常温下,体系中Al(Ⅲ)、Cr(Ⅲ)微粒的分布分数随溶液pH的变化如图下所示(部分无关粒子已略去)。
ⅱ.强碱性条件下Cr(Ⅲ)能被 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将Cr(Ⅵ)还原为Cr(Ⅲ)。
能将Cr(Ⅵ)还原为Cr(Ⅲ)。

(1)钡盐沉铬法:
已知水溶液中
 (橙色)可转化为
(橙色)可转化为 (黄色),该可逆反应用离子方程式可表示为
(黄色),该可逆反应用离子方程式可表示为 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量
 ,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。
,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。
①写出
 将
将 还原为
还原为 的离子方程式
的离子方程式②实际生产中,还原反应控制pH为2.5左右的原因是
(3)还原回收Cr(Ⅵ)法:
步骤1:向含Cr(Ⅵ)的酸性溶液中加入一定量的铝粉,充分反应,过滤。
步骤Ⅱ:利用步骤Ⅰ过滤后得到的溶液(含有
 、
、 、
、 )获得
)获得 。
。①研究发现,若步骤Ⅰ中pH偏低将会导致Cr(Ⅵ)的去除率下降,其原因是
②获得
 和
和 的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8,
的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8, 和
和 的混合溶液。(实验中须用到的试剂:KOH溶液、
的混合溶液。(实验中须用到的试剂:KOH溶液、 溶液、稀硫酸)
溶液、稀硫酸)已知:
ⅰ.常温下,体系中Al(Ⅲ)、Cr(Ⅲ)微粒的分布分数随溶液pH的变化如图下所示(部分无关粒子已略去)。
ⅱ.强碱性条件下Cr(Ⅲ)能被
 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将Cr(Ⅵ)还原为Cr(Ⅲ)。
能将Cr(Ⅵ)还原为Cr(Ⅲ)。
您最近一年使用:0次
8 . 某实验小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),设计实验如下表:
(1)若四组实验均反应1分钟(铁有剩余),则以上实验需要测出的数据是___________ 。
(2)实验___________ 和___________ (填实验编号)是研究盐酸的浓度对该反应速率的影响;实验1和2是研究___________ 对该反应速率的影响。
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是___________ 、___________ 。
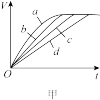
(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。
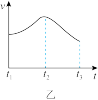
①其中t1~t2速率变化的主要原因是___________ 。
②t2~t3速率变化的主要原因是___________ 。
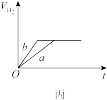
(5)实验1产生氢气的体积如图丙中的曲线a,添加某试剂能使曲线a变为曲线b的是___________(填序号)。
(6)在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
已知:2 min内v(Q)=0.075 mol/(L·min),v(Z):v(Y)=1:2。
请回答下列问题:
①2 min内Z的反应速率v(Z)=___________ 。
②起始时n(Y)=___________ 、n(Q)=___________ 。
③化学方程式中m=___________ 、n=___________ 、p=___________ 、q=___________ 。
④对于该反应,能增大正反应速率的措施是___________ (填序号)。
A.增大容器容积 B.移走部分Q C.通入大量X D.升高温度
| 实验编号 | 盐酸浓度/(mol/L) | 铁的形态 | 温度/K |
| 1 | 4.00 | 块状 | 293 |
| 2 | 4.00 | 粉末 | 293 |
| 3 | 2.00 | 块状 | 293 |
| 4 | 2.00 | 粉末 | 313 |
(2)实验
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是

(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。

①其中t1~t2速率变化的主要原因是
②t2~t3速率变化的主要原因是
(5)实验1产生氢气的体积如图丙中的曲线a,添加某试剂能使曲线a变为曲线b的是___________(填序号)。

| A.CuO粉末 | B.NaNO3固体 | C.NaCl溶液 | D.浓H2SO4 |
 pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:| 物质 | X | Y | Z | Q |
| n(起始)/mol | 0.7 | 1.0 | ||
| n(2 min末)/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| n(3 min末)/mol | 0.8 |
请回答下列问题:
①2 min内Z的反应速率v(Z)=
②起始时n(Y)=
③化学方程式中m=
④对于该反应,能增大正反应速率的措施是
A.增大容器容积 B.移走部分Q C.通入大量X D.升高温度
您最近一年使用:0次
2022-09-17更新
|
468次组卷
|
2卷引用:江苏省无锡市运河实验中学2021-2022学年高二上学期期初考试化学试题
9 . 肼(N2H4)是一种应用广泛的化工原料。
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式_______ 。
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。

①负极的电极反应式为_______ 。
②电池工作时电子从_______ 电极经过负载后流向_______ 电极(填“左侧”或“右侧”)。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为_______ g。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):

温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=_______ 。
②若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1_______ K2(填“<”、“>”或“=”)。
③1000℃,反应b达到平衡时,下列措施能使容器中 增大的是
增大的是_______ 。
A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。

①负极的电极反应式为
②电池工作时电子从
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):

温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=
②若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1
③1000℃,反应b达到平衡时,下列措施能使容器中
 增大的是
增大的是A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
您最近一年使用:0次
解题方法
10 . 尿素[ ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是___________ 。
②合成尿素的化学方程式是___________ 。该反应属于___________ 反应(填“氧化还原”或“非氧化还原”)。
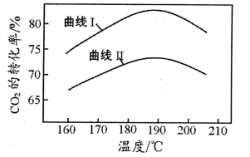
③合成中氨碳比[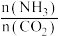 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为___________ ,反应最适宜温度为___________ 。
(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于___________ 晶体。
②尿素水解生成碳酸铵的化学方程式为___________ 。
 ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是
②合成尿素的化学方程式是
③合成中氨碳比[
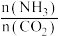 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于
②尿素水解生成碳酸铵的化学方程式为
您最近一年使用:0次



