1 . (一)某同学在实验室研究锌与酸的反应,实验数据如下:
分析上述数据,回答下列问题
(1)实验1和2表明,___________ 对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a=___________ g,实验3金属消失所用的时间比实验1要短,请用有效碰撞理论加以解释___________ 。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。该同学对产生这一现象的原因,提出两种假设:

a.氯离子对反应起促进作用,加快了反应的进行;
b.___________ ,减缓了反应的进行。
为进一步证实猜想b,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液于两支试管中,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___________ (结合化学方程式 作出合理解释)。
(二)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(5)该反应为___________ 反应(填“吸热”或“放热”)。
(6)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率___________ (填“大”、“小”或“不能确定”)。
| 实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
| 1 | 0.10 g | 颗粒 | 0.5mol/L | 50mL | 500s |
| 2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
| 3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
(1)实验1和2表明,
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a=
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。该同学对产生这一现象的原因,提出两种假设:

a.氯离子对反应起促进作用,加快了反应的进行;
b.
为进一步证实猜想b,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液于两支试管中,一份加入一定量的固体
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是
(二)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下: | t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(5)该反应为
(6)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率
您最近一年使用:0次
2023-10-28更新
|
85次组卷
|
2卷引用:新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
2 . 氢能是一种很有前景的新能源,CH4—CO2催化重整是目前制取氢气且同时减缓温室效应的重要方法。
已知:① CH4—CO2催化重整的反应如下:
反应Ⅰ:CH4(g) C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25
C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25
反应Ⅱ:CO2(g) + C(s) 2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8
2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8
② 工业上可用CO2与H2反应制取甲烷、甲醇等化工产品。
回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为_______ 。该反应的平衡常数K =_______ 。
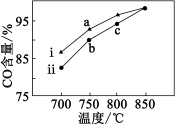
(2)在恒温恒压下,向甲、乙两个密闭容器中通入等物质的量的CH4和等物质的量的CO2,并分别加入两种不同催化剂ⅰ和ⅱ,测得相同时间内CO的百分含量随温度的变化关系如图所示,同时测得相同时间内甲烷和二氧化碳的转化率如下表所示。
① 催化剂_______ (填“ⅰ”或“ⅱ”)效果好,b点正反应速率_______ (填“>”“<”或“=”)b点逆反应速率;
② 从理论上讲,甲烷和二氧化碳的转化率应该相等,但从表格数据可知二氧化碳的转化率均大于甲烷,原因是_______ ;
③ 积碳是造成催化剂失活的主要原因,反应Ⅰ和反应Ⅱ均可能引起积碳,研究发现,如果反应Ⅰ不发生积碳过程,则反应Ⅱ也不会发生积碳过程。根据反应Ⅰ和反应Ⅱ分析,为保持催化剂的活性,应采取的措施是_______ 。
已知:① CH4—CO2催化重整的反应如下:
反应Ⅰ:CH4(g)
 C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25
C(s) + 2H2(g) ΔH1 = +75 kJ·mol−1 K1 = 0.25反应Ⅱ:CO2(g) + C(s)
 2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8
2CO(g) ΔH2 = +175 kJ·mol−1 K2 = 8② 工业上可用CO2与H2反应制取甲烷、甲醇等化工产品。
回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为
(2)在恒温恒压下,向甲、乙两个密闭容器中通入等物质的量的CH4和等物质的量的CO2,并分别加入两种不同催化剂ⅰ和ⅱ,测得相同时间内CO的百分含量随温度的变化关系如图所示,同时测得相同时间内甲烷和二氧化碳的转化率如下表所示。
 | 时间/小时 | 1 | 2 | 3 | 4 | 5 |
| 甲烷转化率/% | 65 | 71 | 80 | 87 | 92 | |
| 二氧化碳转化率/% | 66 | 73 | 83 | 89 | 94 |
② 从理论上讲,甲烷和二氧化碳的转化率应该相等,但从表格数据可知二氧化碳的转化率均大于甲烷,原因是
③ 积碳是造成催化剂失活的主要原因,反应Ⅰ和反应Ⅱ均可能引起积碳,研究发现,如果反应Ⅰ不发生积碳过程,则反应Ⅱ也不会发生积碳过程。根据反应Ⅰ和反应Ⅱ分析,为保持催化剂的活性,应采取的措施是
您最近一年使用:0次
2022-11-02更新
|
238次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三下学期2月月考化学试题
解题方法
3 . CH4—CO2重整技术是实现碳中和的一种CO2利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下:
主反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1=+247.3kJ·mol-1
2CO(g)+2H2(g) △H1=+247.3kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
回答下列问题:
(1)已知:CH4(g)、CO(g)和H2(g)的燃烧热(△H)分别为-890.3kJ·mol-1、-283.0kJ·mol-1、-285.8kJ·mol-1,H2O(l)=H2O(g) △H=+44kJ·mol-1。该副反应的△H2=___ kJ·mol-1。
(2)___ (填标号)有利于提高主反应中CO2的平衡转化率。
A.高温低压 B.低温高压 C.低温低压
(3)800℃,在容积为10L的恒容密闭容器中充入1molCO2和1molCH4,发生上述反应,4min后,反应达到平衡,此时测得反应前后总压强之比为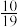 ,H2的物质的量为1.75mol。
,H2的物质的量为1.75mol。
①反应达到平衡时:v(CO2)=____ mol·L-1·min-1,CH4的平衡转化率为____ %,c(CO)=____ mol·L-1。
②副反应的平衡常数K=____ (保留三位有效数字)。
主反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1=+247.3kJ·mol-1
2CO(g)+2H2(g) △H1=+247.3kJ·mol-1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2回答下列问题:
(1)已知:CH4(g)、CO(g)和H2(g)的燃烧热(△H)分别为-890.3kJ·mol-1、-283.0kJ·mol-1、-285.8kJ·mol-1,H2O(l)=H2O(g) △H=+44kJ·mol-1。该副反应的△H2=
(2)
A.高温低压 B.低温高压 C.低温低压
(3)800℃,在容积为10L的恒容密闭容器中充入1molCO2和1molCH4,发生上述反应,4min后,反应达到平衡,此时测得反应前后总压强之比为
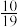 ,H2的物质的量为1.75mol。
,H2的物质的量为1.75mol。①反应达到平衡时:v(CO2)=
②副反应的平衡常数K=
您最近一年使用:0次
名校
解题方法
4 . 氨是最重要的氮肥,是产量最大的化工产品之一、其合成原理为:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4kJ·mol−1。
I.在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应:
(1)测得反应放出的热量_______ 92.4kJ(填“小于”“大于”或“等于”)。
(2)当反应达到平衡时,N2和H2的浓度比是_______ ;N2和H2的转化率比是_______
(3)升高平衡体系的温度(保持体积不变),平衡将_______ (填“正向”“逆向”或“不”)移动,混合气体的平均相对分子质量_______ (填“变大”“变小”或“不变”)。
(4)当达到平衡时,充入氩气并保持压强不变,平衡将_______ (填“正向”“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度_____ (填“小于”“大于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4kJ·mol−1在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
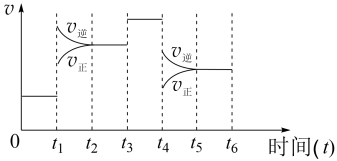
(6)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_______ ,t3_______ ,t4_______
(7)下列时间段中,氨的百分含量最高的是_______。
I.在密闭容器中,投入1molN2和3molH2在催化剂作用下发生反应:
(1)测得反应放出的热量
(2)当反应达到平衡时,N2和H2的浓度比是
(3)升高平衡体系的温度(保持体积不变),平衡将
(4)当达到平衡时,充入氩气并保持压强不变,平衡将
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
II.该反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4kJ·mol−1在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(6)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1
(7)下列时间段中,氨的百分含量最高的是_______。
| A.0~t1 | B.t2~t3 | C.t3~t4 | D.t4~t5 |
您最近一年使用:0次
解题方法
5 . 某化学兴趣小组对重铬酸铵[(NH4)2Cr2O7]的部分性质及组成进行探究。已知: (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。
(黄色)+2H+。
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量的浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、___________ 、___________ 。
(2)为探究(NH4)2Cr2O7(摩尔质量252g/mol)的分解产物,按如下图连接好装置,在A中加入5.040g样品进行实验

①仪器B的名称是___________ 。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g。写出重铬酸铵热分解的化学方程式___________
③C的作用是___________ 。
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。
(黄色)+2H+。(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量的浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、
(2)为探究(NH4)2Cr2O7(摩尔质量252g/mol)的分解产物,按如下图连接好装置,在A中加入5.040g样品进行实验

①仪器B的名称是
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g。写出重铬酸铵热分解的化学方程式
③C的作用是
您最近一年使用:0次
名校
解题方法
6 . 氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。

回答下列问题:
(1)CeFCO3中Ce的化合价为___________ 。
(2)氧化培烧时不能使用陶瓷容器,原因是_________________ 。氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________________ 。操作Ⅰ的名称为_________ 。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________ 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________ 。
(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?__________________ {列式计算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 视为沉淀完全}。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_______________________ 。

回答下列问题:
(1)CeFCO3中Ce的化合价为
(2)氧化培烧时不能使用陶瓷容器,原因是
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:
您最近一年使用:0次
2017-10-31更新
|
571次组卷
|
4卷引用:新疆维吾尔自治区乌鲁木齐市第一中学 2020 届高三第一次理科综合能力测试化学试题



