解题方法
1 . 过氧化钙晶体(CaO2⋅8H2O,微溶于水,不溶于乙醇、乙醚)是重要的化学品,常用作杀菌剂、防腐剂、化妆品的添加剂等。实验室以石灰石(含有少量铁、硅的氧化物)为原料制备CaO2的实验流程如下:
(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、 溶液沉钙等步骤。
溶液沉钙等步骤。
①“调pH除铁”后,需用如图所示的热抽滤装置除去 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是___________ 。 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为___________ 。
(2)“制备”过程所用装置如下图所示:___________ ,若用乙装置制备NH3,,写出反应的化学方程式:___________ 。
②仪器X的名称为___________ 。
③“制备” 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是___________ 。生成 的离子方程式为
的离子方程式为___________ ;CaCl2与H2O2直接反应不易发生,制备时加入适量氨水有利于CaO2生成,其原因可能是___________ 。
(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。

(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、
 溶液沉钙等步骤。
溶液沉钙等步骤。①“调pH除铁”后,需用如图所示的热抽滤装置除去
 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是
 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为(2)“制备”过程所用装置如下图所示:

②仪器X的名称为
③“制备”
 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是 的离子方程式为
的离子方程式为(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。
| A.滴定时应一直观察滴定管中溶液体积的变化 |
| B.当滴入半滴酸性KMnO4溶液后,溶液颜色从无色刚好变为浅红色,且半分钟内不变色,表示已经到达滴定终点 |
| C.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测定结果偏小 |
| D.读取KMnO4溶液体积时,滴定前俯视读数,滴定后仰视读数,则测定结果偏大 |
您最近一年使用:0次
名校
2 .  与
与 反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:
反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:
(1)HCOOH中碳原子的杂化类型为______ 。
(2)已知: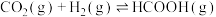
______ 。
(3)在催化作用下,温度为 时,将一定量
时,将一定量 和
和 充入密闭容器中发生如下反应:
充入密闭容器中发生如下反应:
主反应Ⅰ: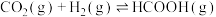

副反应Ⅱ:
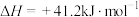 。
。
①下图是不同催化剂电化学还原 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。 生产HCOOH,使用
生产HCOOH,使用______ 作催化剂较优。
②实验测得反应Ⅰ: ,
, ,
, 、
、 为速率常数。温度为
为速率常数。温度为 时,
时,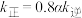 ,则
,则
______  (填“大于”“小于”“等于”),判断依据是
(填“大于”“小于”“等于”),判断依据是______ 。
③实验测得平衡时 的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的
的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的 的比值)随温度变化如图所示。
的比值)随温度变化如图所示。______ ,200℃~360℃,升高温度曲线b对应纵坐标值减小的原因是______ 。240℃时,平衡体系中氢气的分压为 kPa,主反应Ⅰ的
kPa,主反应Ⅰ的
______  (用x、y、
(用x、y、 表示)。
表示)。
 与
与 反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:
反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:(1)HCOOH中碳原子的杂化类型为
(2)已知:
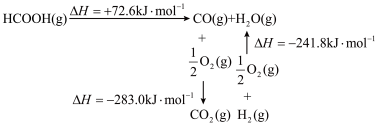
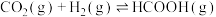
(3)在催化作用下,温度为
 时,将一定量
时,将一定量 和
和 充入密闭容器中发生如下反应:
充入密闭容器中发生如下反应:主反应Ⅰ:
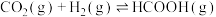

副反应Ⅱ:

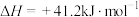 。
。①下图是不同催化剂电化学还原
 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。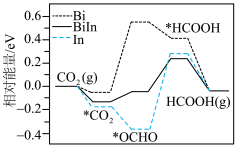
 生产HCOOH,使用
生产HCOOH,使用②实验测得反应Ⅰ:
 ,
, ,
, 、
、 为速率常数。温度为
为速率常数。温度为 时,
时,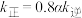 ,则
,则
 (填“大于”“小于”“等于”),判断依据是
(填“大于”“小于”“等于”),判断依据是③实验测得平衡时
 的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的
的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的 的比值)随温度变化如图所示。
的比值)随温度变化如图所示。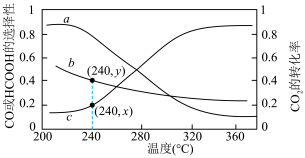
 kPa,主反应Ⅰ的
kPa,主反应Ⅰ的
 (用x、y、
(用x、y、 表示)。
表示)。
您最近一年使用:0次
2024-04-01更新
|
248次组卷
|
2卷引用:江西省九江市2024届高三下学期二模考试化学试题
名校
解题方法
3 . 杭州亚运会主火炬的燃料首次使用废碳再生的绿色甲醇,甲醇火炬被称为“零碳”火炬。目前,我国在相关设备及技术方面全球领先。请回答:
(1)二氧化碳催化加氢制甲醇的反应可表示为: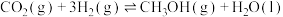 。
。
①已知: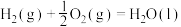
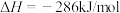


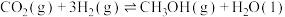
 =
=______ kJ/mol。该反应能自发进行的条件是______ 。
②在恒容条件下能加快二氧化碳催化加氢制甲醇的反应速率,并提高 转化率的措施是
转化率的措施是______ 。
③若二氧化碳催化加氢制甲醇的反应在恒温恒容的密闭容器中进行,能说明反应达到平衡状态的是______ ,(填字母)。
A.容器内压强不随时间变化 B.容器内各物质的浓度相等
C.单位时间消耗1mol ,同时生成3mol
,同时生成3mol D.混合气体的密度不再改变
D.混合气体的密度不再改变
(2)电催化法是制备甲醇的途径之一,原理如图所示。

①室温下, 溶液
溶液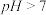 ,
, 水解的离子方程式为
水解的离子方程式为______ 。
② 电极的电极反应式为
电极的电极反应式为______ 。
③与其他有机合成相比,电有机合成的优点是______ 。
(1)二氧化碳催化加氢制甲醇的反应可表示为:
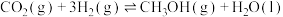 。
。①已知:
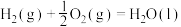
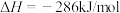


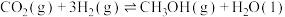
 =
=②在恒容条件下能加快二氧化碳催化加氢制甲醇的反应速率,并提高
 转化率的措施是
转化率的措施是③若二氧化碳催化加氢制甲醇的反应在恒温恒容的密闭容器中进行,能说明反应达到平衡状态的是
A.容器内压强不随时间变化 B.容器内各物质的浓度相等
C.单位时间消耗1mol
 ,同时生成3mol
,同时生成3mol D.混合气体的密度不再改变
D.混合气体的密度不再改变(2)电催化法是制备甲醇的途径之一,原理如图所示。

①室温下,
 溶液
溶液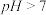 ,
, 水解的离子方程式为
水解的离子方程式为②
 电极的电极反应式为
电极的电极反应式为③与其他有机合成相比,电有机合成的优点是
您最近一年使用:0次
名校
解题方法
4 . 丙烯是一种重要的化工原料。可在一固定容积的密闭容器中由丙烷催化脱氢制备。
(1)已知:
①C3H8(g)=C3H6(g)+H2(g)
②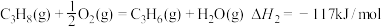
③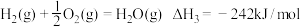
反应①的
________________ 。
(2)欲提高①反应中 的平衡转化率,可采取的措施有________________(填标号)。
的平衡转化率,可采取的措施有________________(填标号)。
(3)能表明该反应①达到平衡状态的是_______________(填字母)。
(4)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为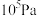 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为__________________ 。该反应的平衡常数
________________ Pa。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)反应④:
在不同催化剂作用下合成甲醇,相同时间内 的转化率随温度变化如图所示,
的转化率随温度变化如图所示,

其中活化能最高,反应速率最慢的所用的催化剂是______ (填“A”、“B”或“C”);请解释温度 之前催化剂不同转化率不同,高于
之前催化剂不同转化率不同,高于 后转化率相同且下降的原因
后转化率相同且下降的原因________________
(1)已知:
①C3H8(g)=C3H6(g)+H2(g)

②
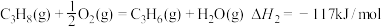
③
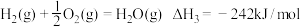
反应①的

(2)欲提高①反应中
 的平衡转化率,可采取的措施有________________(填标号)。
的平衡转化率,可采取的措施有________________(填标号)。A.增大 的浓度 的浓度 | B.提高温度 | C.恒容下通入惰性气体 | D.使用高效催化剂 |
| A.C3H8的转化率等于H2的产率 | B.混合气体的平均相对分子质量不变 |
C.v(C3H8)与 的比值不变 的比值不变 | D.混合气体的密度不变 |
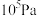 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为
(5)反应④:

在不同催化剂作用下合成甲醇,相同时间内
 的转化率随温度变化如图所示,
的转化率随温度变化如图所示,
其中活化能最高,反应速率最慢的所用的催化剂是
 之前催化剂不同转化率不同,高于
之前催化剂不同转化率不同,高于 后转化率相同且下降的原因
后转化率相同且下降的原因
您最近一年使用:0次
2023-02-22更新
|
202次组卷
|
2卷引用:江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题
名校
5 . 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一、
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
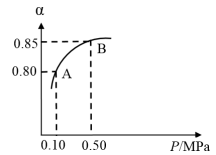
(1)写出该反应的化学平衡常数表达式:___________ 。
(2)将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于___________ 。
(3)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(4)Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH =-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为___________ ,放出的热量为:___________ kJ。
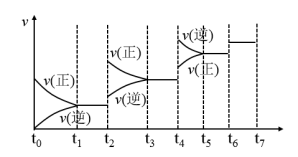
(5)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是___________ ;图中表示平衡混合物中CO的含量最高的一段时间是___________ 。
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
(1)写出该反应的化学平衡常数表达式:
(2)将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于
(3)平衡状态由A变到B时,平衡常数K(A)
(4)Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH =-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为
(5)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
您最近一年使用:0次
2021-12-04更新
|
154次组卷
|
4卷引用:江西省抚州市金溪县第一中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
6 . 二氧化钛和三氧化钨(TiO2/WO3)纳米异质结薄膜广泛应用于光催化、光电催化和传感器等领域。从废弃薄膜中回收钛和钨等稀缺金属既有利于资源综合利用又避免污染环境,以下是TiO2/WO3纳米异质结薄膜回收的工艺流程:

已知:
Ⅰ.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2,呈碱性,与酸发生反应:CH3CH2NH2+H+=CH3CH2NH
Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2CH3CH2NH +WO
+WO
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4
Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2,室温时,Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:
(1)TiOSO4中Ti的化合价是___ 。
(2)为了达到最佳萃取效果,应该在萃取前将滤液Ⅰ的pH调节至___ 。(填“弱酸性”或“弱碱性”)
(3)写出“反萃取”步骤中生成(NH4)2WO4的化学方程式:___ 。
(4)“过滤Ⅲ”所得滤液中,溶质的主要成分是___ (填物质名称)。
(5)将“酸煮”所得TiOSO4溶液稀释到0.001mol·L-1,冷却至室温时恰好产生沉淀,此时溶液的pH为___ 。
(6)最新研究发现,可以用如图所示装置由TiO2获得金属钛,电解质为熔融CaO,在制备金属钛前后,装置中CaO的质量___ (填“增大”“减小”或“不变”)。

若将熔融状态的CaO换成Ca(NO3)2溶液___ (填“可以”或“不可以”)达到相同的目的,解释原因:___ 。

已知:
Ⅰ.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2,呈碱性,与酸发生反应:CH3CH2NH2+H+=CH3CH2NH

Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2CH3CH2NH
 +WO
+WO
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2,室温时,Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:
(1)TiOSO4中Ti的化合价是
(2)为了达到最佳萃取效果,应该在萃取前将滤液Ⅰ的pH调节至
(3)写出“反萃取”步骤中生成(NH4)2WO4的化学方程式:
(4)“过滤Ⅲ”所得滤液中,溶质的主要成分是
(5)将“酸煮”所得TiOSO4溶液稀释到0.001mol·L-1,冷却至室温时恰好产生沉淀,此时溶液的pH为
(6)最新研究发现,可以用如图所示装置由TiO2获得金属钛,电解质为熔融CaO,在制备金属钛前后,装置中CaO的质量

若将熔融状态的CaO换成Ca(NO3)2溶液
您最近一年使用:0次
名校
解题方法
7 . 二氧化碳的资源化利用一直是科学研究的热点领域,工业上可利用反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)制备甲醇。回答下列问题:
(1)已知:H2的燃烧热为ΔH1=-285.8kJ·mol-1
H2O(g)=H2O(1) ΔH2=-44.0 kJ·mol-1
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-676.0 kJ·mol-1
则反应I的ΔH=______ 。
(2)T℃下,将6mol CO2和8mol H2组成的气态混合物充入2L密闭容器中发生反应I,容器中n(H2)随时间的变化如图中实线所示。

①从反应开始至a点,用CO2表示的平均反应速率v(CO2)=______ ,氢气的转化率为______ 。
②该温度下,达到平衡时容器的总压为p总kPa,则此反应的化学平衡常数Kp=______ (kPa)-2。(用平衡分压代替平衡浓度计算,气体分压=气体总压x体积分数)
(3)①若图中虚线表示仅改变温度时n(H2)随时间的变化,则升高温度对应的是曲线______ (填“I”或“II”),判断的依据是______ 。
②a点的正反应速率______ b点的逆反应速率(填“>”、“<”或“=”)。
(4)在T℃下,提高CO2平衡转化率的一种措施是______ 。
(1)已知:H2的燃烧热为ΔH1=-285.8kJ·mol-1
H2O(g)=H2O(1) ΔH2=-44.0 kJ·mol-1
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-676.0 kJ·mol-1
则反应I的ΔH=
(2)T℃下,将6mol CO2和8mol H2组成的气态混合物充入2L密闭容器中发生反应I,容器中n(H2)随时间的变化如图中实线所示。

①从反应开始至a点,用CO2表示的平均反应速率v(CO2)=
②该温度下,达到平衡时容器的总压为p总kPa,则此反应的化学平衡常数Kp=
(3)①若图中虚线表示仅改变温度时n(H2)随时间的变化,则升高温度对应的是曲线
②a点的正反应速率
(4)在T℃下,提高CO2平衡转化率的一种措施是
您最近一年使用:0次
2021-04-04更新
|
333次组卷
|
2卷引用:江西省峡江中学2021-2022学年高二上学期第一次月考化学(理科)试题
8 . I.在25 ℃、101 kPa下:①2Na(s)+ O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为______ 。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=______ 。
(2)如图中表示NO2的变化的曲线是______ 。用O2表示从0~2s内该反应的平均速率v=______
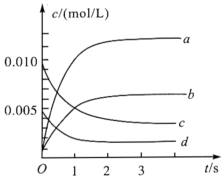
(3)能说明该反应已达到平衡状态的是______ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1molNO2,热量变化为56.4kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为______ 。
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是______ 。
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
 O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1;②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1;25℃、101 kPa下,Na2O2(s)与Na(s)反应生成Na2O(s)的热化学方程式为II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=
(2)如图中表示NO2的变化的曲线是

(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1molNO2,热量变化为56.4kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
您最近一年使用:0次
20-21高二上·江西南昌·期中
解题方法
9 . 元素铬Cr在溶液中主要以Cr3+(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似, 在Cr2(SO4) 3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________ 。
(2) 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应________ 。
②由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率______ ( 填“增大“减小”或“不变")。
③升高温度,溶液中 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H__________ (填“大于”“小于”或“等于”)0。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为___________ 。
 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: (1)Cr3+与Al3+的化学性质相似, 在Cr2(SO4) 3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应
②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的
 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为
您最近一年使用:0次
名校
10 . 一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:
(1)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将__ (填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数___ (填“增大”、“减小”或“不变”)。
(2)下列能说明该反应已达到平衡状态的有( )
A.混合气体的颜色不再改变
B.c(N2)与c(H2)的比值为1:3
C.容器中气体的密度不再改变
D.混合气体总分子数不随时间变化而变化
E.容器内压强不随时间变化而变化
(3)在A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x___ y(“>”“<”或“=”)。
 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:(1)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将
(2)下列能说明该反应已达到平衡状态的有
A.混合气体的颜色不再改变
B.c(N2)与c(H2)的比值为1:3
C.容器中气体的密度不再改变
D.混合气体总分子数不随时间变化而变化
E.容器内压强不随时间变化而变化
(3)在A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x
您最近一年使用:0次
2020-11-04更新
|
50次组卷
|
2卷引用:江西省奉新县第一中学2020-2021学年高二上学期第二次月考化学试题



