名校
解题方法
1 . 甲烷是最简单的烃,可用来作为燃料,也是一种重要的化工原料。
(1) A.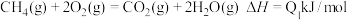
B.
C.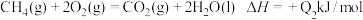
D.
上述热化学方程式中的反应热能正确表示甲烷燃烧热的是___________ 。
(2)以甲烷为原料通过以下反应可以合成甲醇: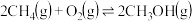
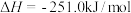
现将 和
和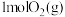 充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
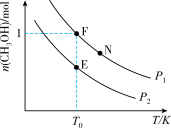
① 时升高温度,
时升高温度,
___________ (填“增大”、“减小”或“不变”);
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为___________ (用 表示);
表示);
③下列能提高 平衡转化率的措施是
平衡转化率的措施是___________ (填序号);
a.选择高效催化剂 b.增大 投料比 c.及时分离产物
投料比 c.及时分离产物
④若 点,
点, ,总压强为
,总压强为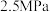 ,则
,则 时
时 点用分压强代替浓度表示的平衡常数
点用分压强代替浓度表示的平衡常数
___________ 。
(1) A.
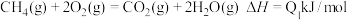
B.

C.
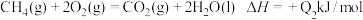
D.

上述热化学方程式中的反应热能正确表示甲烷燃烧热的是
(2)以甲烷为原料通过以下反应可以合成甲醇:
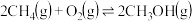
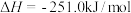
现将
 和
和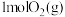 充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①
 时升高温度,
时升高温度,

 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②E、F、N点对应的化学反应速率由大到小的顺序为
 表示);
表示);③下列能提高
 平衡转化率的措施是
平衡转化率的措施是a.选择高效催化剂 b.增大
 投料比 c.及时分离产物
投料比 c.及时分离产物④若
 点,
点, ,总压强为
,总压强为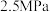 ,则
,则 时
时 点用分压强代替浓度表示的平衡常数
点用分压强代替浓度表示的平衡常数
您最近一年使用:0次
2023-12-15更新
|
223次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期1月期末化学试题
名校
解题方法
2 . 硫酸的消费量常用来衡量一个国家工业发展水平。其中 的催化氧化是重要的一步,其反应为:
的催化氧化是重要的一步,其反应为: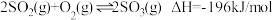 。回答下列问题:
。回答下列问题:
(1) 催化氧化反应在
催化氧化反应在_______ 温下自发(填“高”或“低”,下同),_______ 压有利于提高反应速率,_______ 压有利于提高平衡转化率。根据下表数据( 条件下测得)阐述实际工业生产选择
条件下测得)阐述实际工业生产选择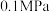 的理由:
的理由:_______ 。
(2)科研人员使用 为基础固硫材料,复合不同的催化剂
为基础固硫材料,复合不同的催化剂 催化
催化 向
向 的转化。同时研究了不同温度下使用三种催化剂对
的转化。同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响,结论如下图:
转化率表示)的影响,结论如下图:
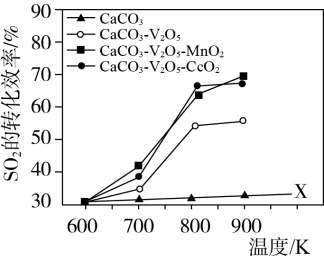
①仅使用 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是_______ 。
②下列有关说法正确的是_______ 。
a.三种催化剂中 催化剂效率最低
催化剂效率最低
b.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
c.温度越高一定越有利于催化剂催化效率的提升
(3)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: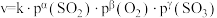 ,根据表中数据,
,根据表中数据,
_______ 。
 的催化氧化是重要的一步,其反应为:
的催化氧化是重要的一步,其反应为: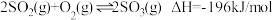 。回答下列问题:
。回答下列问题:(1)
 催化氧化反应在
催化氧化反应在 条件下测得)阐述实际工业生产选择
条件下测得)阐述实际工业生产选择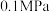 的理由:
的理由:| 压强 | 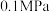 | 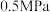 | 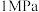 | 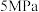 | 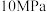 |
平衡时 的转化率 的转化率 | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
(2)科研人员使用
 为基础固硫材料,复合不同的催化剂
为基础固硫材料,复合不同的催化剂 催化
催化 向
向 的转化。同时研究了不同温度下使用三种催化剂对
的转化。同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响,结论如下图:
转化率表示)的影响,结论如下图:
①仅使用
 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是②下列有关说法正确的是
a.三种催化剂中
 催化剂效率最低
催化剂效率最低b.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率c.温度越高一定越有利于催化剂催化效率的提升
(3)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: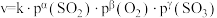 ,根据表中数据,
,根据表中数据,
| 实验 | 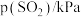 | 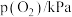 | 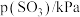 | 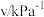 |
| 1 | m | n | p | q |
| 2 | 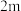 | n | p |  |
| 3 | m | n |  | 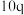 |
| 4 | m |  | p | 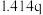 |
您最近一年使用:0次
名校
3 . 我国科学家实现了喹啉并内酯的高选择性制备。合成路线如下图。

已知:
i. R―Br+R'CHO

ii. ROH+R'Br ROR'
ROR'
iii.碳碳双键直接与羟基相连不稳定
(1)试剂a为_______ ;B中官能团的电子式为_______ 。
(2)B(苯胺)具有碱性,B转化为C的反应中,使B过量可以提高ClCH2COOC2H5的平衡转化率,其原因是_______ (写出一条即可)。
(3)C→D的化学方程式为_______ 。
(4)H的结构简式为_______ ;H→I的反应类型为_______ 。
(5)K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有_______ 种(不考虑立体异构)。
(6)D和I转化成J的反应过程中还生成水,理论上该过程中消耗的 与生成的J的物质的量之比为
与生成的J的物质的量之比为_______ 。

已知:
i. R―Br+R'CHO


ii. ROH+R'Br
 ROR'
ROR'iii.碳碳双键直接与羟基相连不稳定
(1)试剂a为
(2)B(苯胺)具有碱性,B转化为C的反应中,使B过量可以提高ClCH2COOC2H5的平衡转化率,其原因是
(3)C→D的化学方程式为
(4)H的结构简式为
(5)K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有
(6)D和I转化成J的反应过程中还生成水,理论上该过程中消耗的
 与生成的J的物质的量之比为
与生成的J的物质的量之比为
您最近一年使用:0次
4 . 已知2NO2(g)=N2O4(g) △H=﹣52.7kJ•mol﹣1,常温下N2O4为无色气体。某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
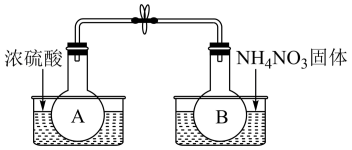
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体(NH4NO3固体溶解吸收大量的热)。请回答:
(1)A中的现象___________ ,B中的现象___________ ;
(2)由此可知,降低温度,该化学平衡向___________ (填“正”或“逆”)反应方向移动;
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3相同浓度的NO2与N2O4的混合气体,将针筒前端封闭。
(3)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后气体颜色变深的原因是___________ ;
②一段时间后气体颜色又变浅的原因是___________ ;
(4)将第三支针筒活塞拉至20cm3处,此时气体的颜色___________ ,一段时间后气体颜色___________ ,但仍比第一支针筒气体的颜色___________ 。
①在此过程中,该反应的化学平衡常数___________ (填“增大”、“减小”或“不变”)。
②NO2的转化率___________ (填“增大”、“减小”或“不变”)。
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体(NH4NO3固体溶解吸收大量的热)。请回答:

(1)A中的现象
(2)由此可知,降低温度,该化学平衡向
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3相同浓度的NO2与N2O4的混合气体,将针筒前端封闭。
(3)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后气体颜色变深的原因是
②一段时间后气体颜色又变浅的原因是
(4)将第三支针筒活塞拉至20cm3处,此时气体的颜色
①在此过程中,该反应的化学平衡常数
②NO2的转化率
您最近一年使用:0次
名校
解题方法
5 . Ⅰ 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题。
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式___________ 。

(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如下表所示:
已知:破坏1molN2(g)和3molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量。
①则T1___________ T2 (填“>”“<”或“=”)
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率υ(H2)=___________ 。
Ⅱ.在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

(1)能说明该反应已达平衡状态的是___________ 。
A.CO2的体积分数在混合气体中保持不变
B.体系中n(CO2)/n(H2)=1:1,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n molH−H键断裂,同时又n mol O−H键生成
(2)下列措施能使n(CH3OH)/n(CO2)增大的是___________ 。
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入2molCO2、3molH2
(3)计算该温度下此反应的平衡常数K=___________ (L/mol)2;若使K的值变为1,则应采取的措施是___________ 。
A.增大压强 B.恒压加入一定量H2 C.降低温度 D.升高温度
(4)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1 mol∙L−1Na2CO3溶液完全捕捉224mL(已换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液中:]
①c( )+c(
)+c( )+c(H2CO3)=
)+c(H2CO3)=___________ mol∙L−1 (填数字)
②c( )+2c(
)+2c( )=
)=___________ (用相关离子浓度表示)
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式

(2)在体积为3L的恒容密闭容器中,投入4molN2和9molH2,在一定条件下合成氨,不同温度下测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1
②在T2K下,经过5min达到化学平衡状态,则0~5min内H2的平均速率υ(H2)=
Ⅱ.在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
(1)能说明该反应已达平衡状态的是
A.CO2的体积分数在混合气体中保持不变
B.体系中n(CO2)/n(H2)=1:1,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n molH−H键断裂,同时又n mol O−H键生成
(2)下列措施能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入2molCO2、3molH2
(3)计算该温度下此反应的平衡常数K=
A.增大压强 B.恒压加入一定量H2 C.降低温度 D.升高温度
(4)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1 mol∙L−1Na2CO3溶液完全捕捉224mL(已换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液中:]
①c(
 )+c(
)+c( )+c(H2CO3)=
)+c(H2CO3)=②c(
 )+2c(
)+2c( )=
)=
您最近一年使用:0次
2021-01-12更新
|
58次组卷
|
2卷引用:吉林省长春市第一中学2021届高三上学期期末考试化学试题
名校
解题方法
6 . 甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式___________ 。
(2)甲醇可采用煤的气化、液化制取(CO+2H2 CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图所示。
的关系如图所示。
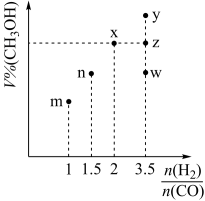
①当起始 =2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为
=2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为___________ ;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是___________ (填标号)
A.33% B.30% C.25% D.20%
②当 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“y”、“z”或“w”)。
(3)制甲醇的CO和H2可用天然气来制取: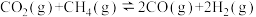 。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH___________ 0.(选填>、<或=,下同).当压强为p2时,在y点:V(正)___________ V(逆)。若p2=1.2Mpa,则T℃时该反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为 [反应Ⅰ]。
[反应Ⅰ]。
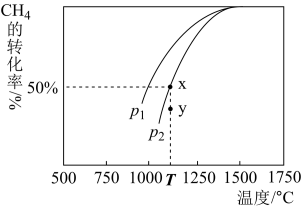
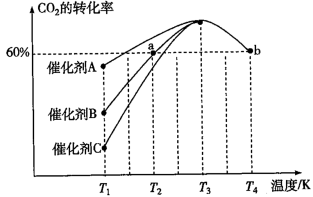
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是___________ (填“A”、“B”或“C”)。
②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应 [反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是________ 。
(1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1③CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol
写出表示甲醇CH3OH(l)燃烧热的热化学方程式
(2)甲醇可采用煤的气化、液化制取(CO+2H2
 CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 的关系如图所示。
的关系如图所示。
①当起始
 =2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为
=2,经过5min达到平衡,0~5min内平均反应速率v(H2) = 0.1mol⋅L-1⋅min-1,则该条件CO的平衡转化率为A.33% B.30% C.25% D.20%
②当
 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的(3)制甲醇的CO和H2可用天然气来制取:
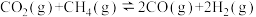 。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为
 [反应Ⅰ]。
[反应Ⅰ]。①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最低的反应所用的催化剂是

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应
 [反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
您最近一年使用:0次
7 . 1773年瑞典化学家舍勒发现氮气,随着科学和技术的发展进步,氮及其化合物在生产生活中应用广泛。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1
②2NO(g)+O2(g)⇌2NO2(g) ΔH=-112 kJ·mol-1
③2NO2(g)⇌N2O4(g) ΔH=-57 kJ·mol-1
④2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1136 kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________ 。
(2)CO、NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。已知:2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH<0,T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
2CO2(g)+N2(g) ΔH<0,T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
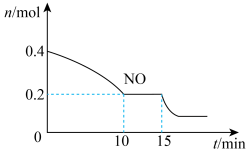
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20 MPa,则T℃时该反应的压力平衡常数Kp=______ ;
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是________ (选填字母)。
A.增大CO的浓度
B.升温
C.减小容器体积
D.加入催化剂
(3)氮的+4价氧化物可以发生可逆反应:2NO2(g)⇌N2O4(g),100℃时,若将0.100mol N2O4气体放入1L密闭容器中,c(N2O4)随时间的变化如表所示。回答下列问题:
①在0~40s时段,化学反应速率v(NO2)为_______ 。
②100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)________ v逆(N2O4)。(填“>”、“=”或“<”)
③在一定温度下,v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆只是温度的函数)。升高温度,k正增大的倍数________ (填“>”、“=”或“<”)k逆增大的倍数。
(4)肼(N2H4)暴露在空气中容易爆炸,但是以其为燃料的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示:
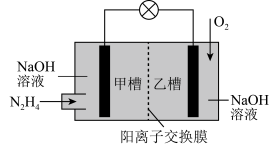
若反应前甲乙两槽中溶液质量相等,当电池中有1mole-发生转移时乙槽与甲槽溶液的质量之差为________ g(假设反应物耗尽,忽略气体的溶解)。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1
②2NO(g)+O2(g)⇌2NO2(g) ΔH=-112 kJ·mol-1
③2NO2(g)⇌N2O4(g) ΔH=-57 kJ·mol-1
④2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1136 kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为
(2)CO、NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。已知:2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH<0,T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
2CO2(g)+N2(g) ΔH<0,T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20 MPa,则T℃时该反应的压力平衡常数Kp=
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A.增大CO的浓度
B.升温
C.减小容器体积
D.加入催化剂
(3)氮的+4价氧化物可以发生可逆反应:2NO2(g)⇌N2O4(g),100℃时,若将0.100mol N2O4气体放入1L密闭容器中,c(N2O4)随时间的变化如表所示。回答下列问题:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L﹣1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
②100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)
③在一定温度下,v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆只是温度的函数)。升高温度,k正增大的倍数
(4)肼(N2H4)暴露在空气中容易爆炸,但是以其为燃料的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示:

若反应前甲乙两槽中溶液质量相等,当电池中有1mole-发生转移时乙槽与甲槽溶液的质量之差为
您最近一年使用:0次
8 . 一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
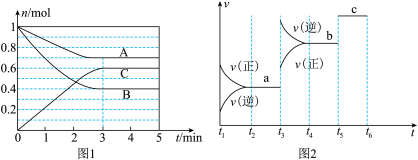
(1)该反应的化学方程式为___________ 。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______ 。
②a、b、c三点中,C的体积分数最大的是________ 。
③各阶段的平衡常数如下表所示:
K1、K2、K3之间的大小关系为________ (用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。

(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为_______ 。
(3)图中M点的平衡常数Kp =____ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

(1)该反应的化学方程式为
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是
②a、b、c三点中,C的体积分数最大的是
③各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g)
 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
(1)△H
(2)图中压强(p1、p2、p3)的大小顺序为
(3)图中M点的平衡常数Kp =
您最近一年使用:0次
2020-07-22更新
|
205次组卷
|
5卷引用:吉林省长春市部分高中2022-2023学年高二上学期10月月考化学试题
名校
解题方法
9 . Ⅰ.已知:N2(g)+3H2(g) 2NH3(g)∆H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)∆H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
(1)此条件下该反应的化学平衡常数K=_______________ ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正____________ v(N2)逆(填写“>”、“=”或“<”=)。
(2)若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________ 。
Ⅱ.已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c( )>c(H+)>c(OH-) B.c(Cl-)>c(
)>c(H+)>c(OH-) B.c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c( )>c(OH-) D.c(
)>c(OH-) D.c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
(3)若溶液中只溶解了一种溶质,该溶质的名称是__________ ,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________ 。
(4)若上述关系中C是正确的,则溶液中溶质的化学式是______________
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____ c(NH3·H2O),混合后溶液中c( )与c(Cl-)的关系c(
)与c(Cl-)的关系c( )
)______ c(Cl-)。
 2NH3(g)∆H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)∆H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(1)此条件下该反应的化学平衡常数K=
(2)若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是
| A.平衡可能正向移动 | B.可能是向容器中加入了一定量的H2气体 |
| C.可能是降低了容器的温度 | D.可能是增大了容器的体积 |
Ⅱ.已知某溶液中只存在OH-、H+、
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:A.c(Cl-)>c(
 )>c(H+)>c(OH-) B.c(Cl-)>c(
)>c(H+)>c(OH-) B.c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)C.c(Cl-)>c(H+)>c(
 )>c(OH-) D.c(
)>c(OH-) D.c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)(3)若溶液中只溶解了一种溶质,该溶质的名称是
(4)若上述关系中C是正确的,则溶液中溶质的化学式是
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)
 )与c(Cl-)的关系c(
)与c(Cl-)的关系c( )
)
您最近一年使用:0次



