解题方法
1 .  是一种用途极为广泛的稀土化合物。以二氧化铈
是一种用途极为广泛的稀土化合物。以二氧化铈 废渣为原料制备
废渣为原料制备 ,实验过程如下
,实验过程如下
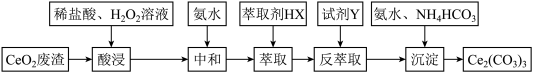
已知: 能被有机萃取剂
能被有机萃取剂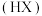 萃取,其萃取原理可表示为:
萃取,其萃取原理可表示为: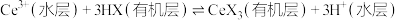 。下列说法正确的是
。下列说法正确的是
 是一种用途极为广泛的稀土化合物。以二氧化铈
是一种用途极为广泛的稀土化合物。以二氧化铈 废渣为原料制备
废渣为原料制备 ,实验过程如下
,实验过程如下
已知:
 能被有机萃取剂
能被有机萃取剂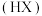 萃取,其萃取原理可表示为:
萃取,其萃取原理可表示为: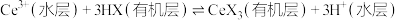 。下列说法正确的是
。下列说法正确的是A.“酸浸”过程中 做氧化剂 做氧化剂 |
| B.试剂Y一定是盐酸 |
C.加氨水“中和”去除过量盐酸,有利于平衡向萃取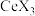 (有机层)的方向移动 (有机层)的方向移动 |
D.“沉淀”时反应的离子方程式为 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
一种从该钒精矿中提取五氧化二钒的流程如下:
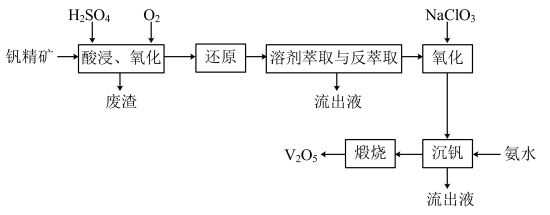
(1)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用___________ (填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是___________
(2)“溶剂萃取与反萃取”可表示为:VO2++(HR2PO4)2(O) (VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
(VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈___________ 性(填“酸”“碱”或“中”)。
| 物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
| 质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |

(1)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用
(2)“溶剂萃取与反萃取”可表示为:VO2++(HR2PO4)2(O)
 (VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
(VOR2PO4)2(O)+2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈
您最近一年使用:0次
解题方法
3 . 工业上以铬铁矿(主要成分为 ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
,含Al、Si氧化物等杂质)为主要原料制备红矾钠 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:

(1) 中Fe元素的化合价
中Fe元素的化合价___________ ,焙烧的目的是将 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是___________ 。
(2)滤渣2的成分___________ (填化学式)滤渣提纯后的用途___________ 。
(3)加入 酸化的作用是
酸化的作用是___________ (结合化学用语简述)。
(4)蒸发结晶时,过度蒸发将导致___________
(5)该小组用 铬铁矿(
铬铁矿( 的质量分数60%)制备
的质量分数60%)制备 ,最终得到产品
,最终得到产品 ,产率为
,产率为___________ (列出计算式)
 ,含Al、Si氧化物等杂质)为主要原料制备红矾钠
,含Al、Si氧化物等杂质)为主要原料制备红矾钠 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:
(1)
 中Fe元素的化合价
中Fe元素的化合价 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是(2)滤渣2的成分
(3)加入
 酸化的作用是
酸化的作用是(4)蒸发结晶时,过度蒸发将导致
(5)该小组用
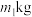 铬铁矿(
铬铁矿( 的质量分数60%)制备
的质量分数60%)制备 ,最终得到产品
,最终得到产品 ,产率为
,产率为
您最近一年使用:0次
解题方法
4 . 下列解释事实的离子方程式不正确的是
A.在重铬酸钾溶液中滴入氢氧化钠溶液,溶液变为黄色: |
B.牙齿表面薄层釉质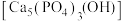 易被有机酸溶解从而导致龋齿,含氟牙膏能起到预防龋齿的作用的原理: 易被有机酸溶解从而导致龋齿,含氟牙膏能起到预防龋齿的作用的原理: |
C. 化学性质非常稳定,在工业上有着广泛用途,可用 化学性质非常稳定,在工业上有着广泛用途,可用 制备 制备 : : |
D.纯碱溶于水显碱性: |
您最近一年使用:0次
5 . 铬是硬度最高的金属,具有良好的抗腐蚀性的耐磨性,常用于制造不锈钢和仪器仪表的金属表面镀铬,用途十分广泛。
(1)铬的常见的氧化——三氧化二铬( ),既能与KOH溶液反应生成
),既能与KOH溶液反应生成 ,又能与硫酸反应生成
,又能与硫酸反应生成 。
。 是
是___________ (填“酸性”“碱性”或“两性”)氧化物, 与过量KOH溶液反应的离子方程式为
与过量KOH溶液反应的离子方程式为___________ 。
(2)已知: ,Cr(Ⅲ)体现还原性生成
,Cr(Ⅲ)体现还原性生成 或
或 。在碱性介质中Cr(Ⅲ)有较强的还原性,可使
。在碱性介质中Cr(Ⅲ)有较强的还原性,可使 —淀粉溶液褪色,反应过程中铬元素由
—淀粉溶液褪色,反应过程中铬元素由___________ 转化为___________ (填离子符号);在酸性介质中Cr(Ⅲ)还原性较差,可与强氧化剂反应,可将 还原为
还原为 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(3) 中铬元素的化合价为
中铬元素的化合价为___________ ;将 溶液滴加到淀粉——KI溶液中,溶液变蓝;可使
溶液滴加到淀粉——KI溶液中,溶液变蓝;可使 、
、 和
和 在不同酸碱性条件下氧化性的大小关系是
在不同酸碱性条件下氧化性的大小关系是___________ 。
(1)铬的常见的氧化——三氧化二铬(
 ),既能与KOH溶液反应生成
),既能与KOH溶液反应生成 ,又能与硫酸反应生成
,又能与硫酸反应生成 。
。 是
是 与过量KOH溶液反应的离子方程式为
与过量KOH溶液反应的离子方程式为(2)已知:
 ,Cr(Ⅲ)体现还原性生成
,Cr(Ⅲ)体现还原性生成 或
或 。在碱性介质中Cr(Ⅲ)有较强的还原性,可使
。在碱性介质中Cr(Ⅲ)有较强的还原性,可使 —淀粉溶液褪色,反应过程中铬元素由
—淀粉溶液褪色,反应过程中铬元素由 还原为
还原为 ,其反应的离子方程式为
,其反应的离子方程式为(3)
 中铬元素的化合价为
中铬元素的化合价为 溶液滴加到淀粉——KI溶液中,溶液变蓝;可使
溶液滴加到淀粉——KI溶液中,溶液变蓝;可使 、
、 和
和 在不同酸碱性条件下氧化性的大小关系是
在不同酸碱性条件下氧化性的大小关系是
您最近一年使用:0次
6 . 重金属元素钒(V)性能优良,用途广泛,有金属“维生素”之称,以硅藻土为载体的五氧化二钒(V2O5)是接触法制备硫酸的催化剂。
废钒催化剂的主要成分为:
以下是一种废钒催化剂回收 工艺路线:
工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为 ,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:
,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:_______ 。
(2)“氧化”中VO2+转变为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由小到大的顺序是
、Cl-、VO2+还原性由小到大的顺序是_______ 。
(4)“中和”作用之一是使钒以 形式存在于溶液中,“废渣2”中含有
形式存在于溶液中,“废渣2”中含有_______ 。
(5)“离子交换”和“洗脱”可简单表示为: (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ 性(填“酸”“碱”“中”)。
(6)“煅烧”中使用的主要实验仪器名称为(写3种)_______ 。
废钒催化剂的主要成分为:
| 物质 |  |  | 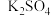 |  |  |  |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
 工艺路线:
工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为
 ,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:
,V2O4转化为VO2+,写出V2O4转化为VO2+反应的离子方程式:(2)“氧化”中VO2+转变为
 ,反应的离子方程式为
,反应的离子方程式为(3)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由小到大的顺序是
、Cl-、VO2+还原性由小到大的顺序是(4)“中和”作用之一是使钒以
 形式存在于溶液中,“废渣2”中含有
形式存在于溶液中,“废渣2”中含有(5)“离子交换”和“洗脱”可简单表示为:
 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(6)“煅烧”中使用的主要实验仪器名称为(写3种)
您最近一年使用:0次
名校
解题方法
7 . 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。

(1)还原沉淀法是处理含Cr2O 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
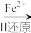 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第Ⅰ步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①若平衡体系的pH=0,该溶液显___________ 色。
②根据2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为___________ ,图中右侧电极连接电源的___________ 极,其电极反应式为___________ 。
③第Ⅱ步反应的离子方程式:___________ 。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□_______

(1)还原沉淀法是处理含Cr2O
 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
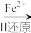 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第Ⅰ步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①若平衡体系的pH=0,该溶液显
②根据2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为③第Ⅱ步反应的离子方程式:
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□
您最近一年使用:0次
8 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)

b)

c)

d)

e)

(1)已知相关物质的燃烧热(25℃、101 kPa):
则△H1=___________ 。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a)


b)


c)


d)


e)


(1)已知相关物质的燃烧热(25℃、101 kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热(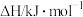 ) ) |  |  |  |
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.移去部分C(s),反应c、d、e的平衡均向右移动 |
| B.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
9 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
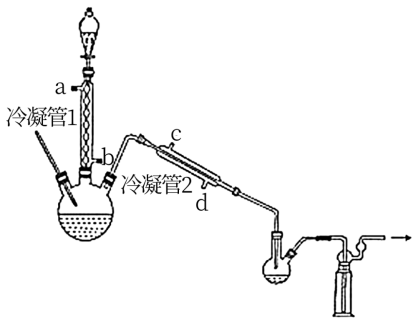
(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为___ 、___ 。(填字母)
②加热温度不宜超过60℃的原因是___ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2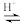
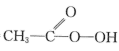 +H2O)
+H2O)
①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是___ ;浓硫酸的作用是___ 。
②充分搅拌的目的是___ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mLH2SO4溶液、3滴MnSO4溶液、5.0mL溶液A,摇匀,用0.01mol•L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(CH3COOOH+2H++2I-=I2+CH3COOH+H2O),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol•L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2O =2I-+S4O
=2I-+S4O )。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
)。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要____ 。
②设计步骤b的目的是___ 。
③过氧乙酸的质量分数为___ %。

(1)浓缩H2O2
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% H2O2溶液,最终得到质量分数约68%的H2O2溶液。
①冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%H2O2溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
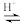
 +H2O)
+H2O)①用浓缩的68%H2O2溶液代替常见的30%H2O2溶液的目的是
②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mLH2SO4溶液、3滴MnSO4溶液、5.0mL溶液A,摇匀,用0.01mol•L-1的KMnO4溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(CH3COOOH+2H++2I-=I2+CH3COOH+H2O),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol•L-1的Na2S2O3标准溶液滴定至蓝色刚好褪去(I2+2S2O
 =2I-+S4O
=2I-+S4O )。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。
)。重复步骤b、步骤c三次,测得平均消耗Na2S2O3标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
10 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
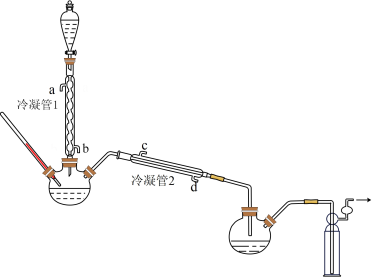
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
①冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母);冷凝效果更好的是___________ (填“冷凝管1”或“冷凝管2”)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知: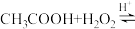

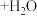 )
)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 浴液的目的是
浴液的目的是___________ ;浓硫酸的作用是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入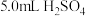 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI ( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b、步骤c三次,测得平均消耗
)。重复步骤b、步骤c三次,测得平均消耗 标准溶液的体积为20.00mLml。
标准溶液的体积为20.00mLml。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要___________ 。
②设计步骤b的目的是___________ 。
③过氧乙酸的质量分数为___________ %。

(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。①冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:
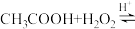

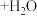 )
)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 浴液的目的是
浴液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入
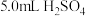 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI (
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b、步骤c三次,测得平均消耗
)。重复步骤b、步骤c三次,测得平均消耗 标准溶液的体积为20.00mLml。
标准溶液的体积为20.00mLml。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次



