名校
解题方法
1 . 某同学研究浓度对化学平衡的影响,下列说法正确的是
已知: ΔH=+13.8kJ/mol ΔH=+13.8kJ/mol | |
步骤: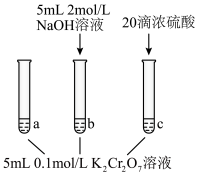 | 现象:待试管b中颜色不变后与试管a比较,溶液颜色变浅。 滴加浓硫酸、试管c温度略有升高,溶液颜色与试管a相比,变深。 |
| A.该实验不能证明减小生成物浓度,平衡正向移动 |
B.待试管b中溶液颜色不变的目的是使 完全反应 完全反应 |
| C.该反应是一个氧化还原反应 |
D.试管c中的现象说明影响平衡的主要因素是 浓度 浓度 |
您最近一年使用:0次
2 . 重铬酸钾溶液中存在如下平衡: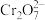 (橙色)+H2O
(橙色)+H2O 2H++2Cr
2H++2Cr (黄色)
(黄色)
①向2mL0.1mol•L-1K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴6mol/LH2SO4,溶液由黄色变为橙色。②向2mL0.1mol•L-1酸化的K2Cr2O7溶液中滴入适量的(NH4)2Fe(SO4)2溶液,发生反应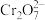 +14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O。
+14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O。
下列分析正确的是
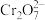 (橙色)+H2O
(橙色)+H2O 2H++2Cr
2H++2Cr (黄色)
(黄色)①向2mL0.1mol•L-1K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴6mol/LH2SO4,溶液由黄色变为橙色。②向2mL0.1mol•L-1酸化的K2Cr2O7溶液中滴入适量的(NH4)2Fe(SO4)2溶液,发生反应
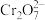 +14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O。
+14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
B.实验②能说明氧化性: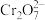 >Fe3+ >Fe3+ |
| C.实验②的反应中电子转移总数为6 |
D.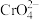 和Fe2+在酸性溶液中可以大量共存 和Fe2+在酸性溶液中可以大量共存 |
您最近一年使用:0次
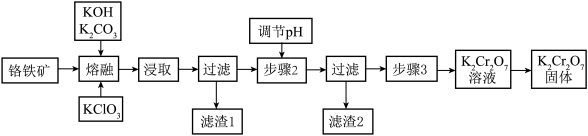
3 . 工业中,通过铬铁矿(主要成分为 ,含一定量的杂质
,含一定量的杂质 、
、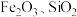 )制备
)制备 ,流程如图所示。下列说法不正确的是
,流程如图所示。下列说法不正确的是
已知: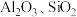 可转化为
可转化为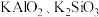 ;
;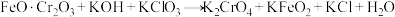
 ,含一定量的杂质
,含一定量的杂质 、
、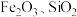 )制备
)制备 ,流程如图所示。下列说法不正确的是
,流程如图所示。下列说法不正确的是
已知:
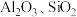 可转化为
可转化为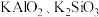 ;
;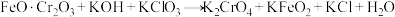
| A.熔融过程中氧化剂与还原剂物质的量之比为7:6 |
B.滤渣1的成分为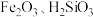 ,滤渣2的成分为 ,滤渣2的成分为 |
C.步骤3的操作为滤液酸化,向滤液中滴加 至观察到溶液颜色为黄色时停止滴加 至观察到溶液颜色为黄色时停止滴加 |
D.向一定量 溶液中加入乙醇,可观察到 溶液中加入乙醇,可观察到 溶液变色 溶液变色 |
您最近一年使用:0次
解题方法
4 . 一定条件下,1-苯基丙炔(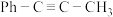 )可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
)可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
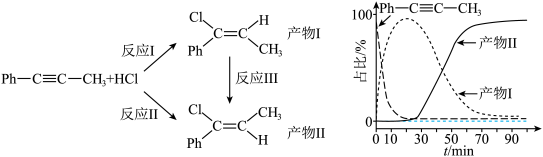
下列说法错误的是
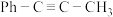 )可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
)可与HCl发生催化加成。反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应)。
下列说法错误的是
| A.反应焓变:反应Ⅰ>反应Ⅱ |
| B.反应活化能:反应Ⅰ>反应Ⅱ |
| C.增加HCl浓度可增大平衡时产物Ⅱ和产物Ⅰ的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近一年使用:0次
2023-10-11更新
|
138次组卷
|
2卷引用:山东省潍坊市五县区2023-2024学年高三上学期10月阶段监测化学试题
名校
5 . 工业制硫酸中的一步重要反应是SO2在400~500℃下发生的催化氧化反应2SO2+O2 2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
 2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.达到平衡时,SO2的浓度与SO3的浓度一定相等 |
| C.为了提高SO2的转化率,可适当提高SO2的浓度 |
| D.在上述条件下,SO2不可能100%地转化为SO3 |
您最近一年使用:0次
名校
解题方法
6 . 肌肉中大量肌红蛋白 Mb 可以结合 O2形成 MbO2维持人体的生理活动,发生反应: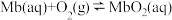 ΔH,该过程可自发进行。温度为 T 时, 平衡常数 K=
ΔH,该过程可自发进行。温度为 T 时, 平衡常数 K= 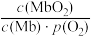 =2.0 kPa-1(气体分压=气体总压×体积分数),下列说法中不正确的是
=2.0 kPa-1(气体分压=气体总压×体积分数),下列说法中不正确的是
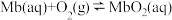 ΔH,该过程可自发进行。温度为 T 时, 平衡常数 K=
ΔH,该过程可自发进行。温度为 T 时, 平衡常数 K= 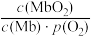 =2.0 kPa-1(气体分压=气体总压×体积分数),下列说法中不正确的是
=2.0 kPa-1(气体分压=气体总压×体积分数),下列说法中不正确的是| A.ΔH<0 |
| B.提高 p(O2),K 值变小 |
| C.提高氧气浓度,有利于 Mb(aq)的转化 |
D.当  =4.0 时, 吸入的空气中 p(O2)=21 kPa ,该反应逆向进行 =4.0 时, 吸入的空气中 p(O2)=21 kPa ,该反应逆向进行 |
您最近一年使用:0次
2023-08-22更新
|
232次组卷
|
2卷引用:四川省成都市石室中学2022-2023学年高二下学期5月月考化学试题
真题
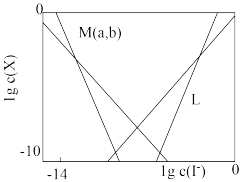
7 . 在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系: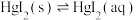 ;
;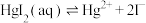 ;
;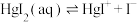 ;
; ;
; ,平衡常数依次为
,平衡常数依次为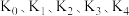 。已知
。已知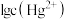 、
、 ,
, 、
、 随
随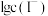 的变化关系如图所示,下列说法错误的是
的变化关系如图所示,下列说法错误的是
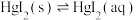 ;
;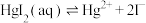 ;
;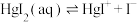 ;
; ;
; ,平衡常数依次为
,平衡常数依次为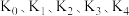 。已知
。已知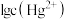 、
、 ,
, 、
、 随
随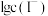 的变化关系如图所示,下列说法错误的是
的变化关系如图所示,下列说法错误的是
A.线 表示 表示 的变化情况 的变化情况 |
B.随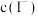 增大, 增大,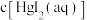 先增大后减小 先增大后减小 |
C.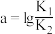 |
D.溶液中I元素与 元素的物质的量之比始终为 元素的物质的量之比始终为 |
您最近一年使用:0次
2023-06-19更新
|
7209次组卷
|
8卷引用:山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题
山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(不定项选择题)(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点1 电离平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
名校
8 . 相同温度和压强下,研究Cl2在不同溶液中的溶解度(用溶解Cl2的物质的量浓度表示)随溶液浓度的变化。在NaCl溶液和盐酸中Cl2的溶解度以及各种含氯微粒的浓度变化如下图。

下列说法不正确的是

下列说法不正确的是
A.由图1可知,Cl2溶于NaCl溶液时还发生了反应Cl2+Cl-=Cl |
B.随NaCl溶液浓度增大,Cl2+H2O H++Cl-+HClO平衡逆移,Cl2溶解度减小 H++Cl-+HClO平衡逆移,Cl2溶解度减小 |
| C.随盐酸浓度增加Cl2与H2O的反应被抑制,生成Cl3-为主要反应从而抑制Cl2溶解 |
| D.由上述实验可知,H+浓度增大促进 Cl2溶解,由此推知在稀硫酸中,随硫酸浓度增大Cl2的溶解度会增大 |
您最近一年使用:0次
名校
9 . 用如图所示的装置提纯难挥发的TaS2晶体,发生的反应为TaS2(s)+2I2(g)⇌TaI4(g)+S2(g) ΔH>0,将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中,下列说法不正确 的是


| A.温度:T1<T2 |
| B.在温度T1端得到纯净TaS2晶体 |
| C.提纯过程中I2的量在不断减少 |
| D.该反应的平衡常数与TaI4和S2的浓度乘积成反比 |
您最近一年使用:0次
2021-01-20更新
|
414次组卷
|
3卷引用:广东省“百越名校联盟”2021届高三12月普通高中学业质量检测化学试题
10 . 利用含钴废料(主要成分为Co3O4,还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如图:

已知:萃取Co2+的反应原理:Co2++2HR(有机磷) CoR2+2H+。下列说法错误的是
CoR2+2H+。下列说法错误的是

已知:萃取Co2+的反应原理:Co2++2HR(有机磷)
 CoR2+2H+。下列说法错误的是
CoR2+2H+。下列说法错误的是| A.“滤液Ⅰ”中溶质的主要成分是NaAlO2 |
| B.“酸溶”中H2O2的作用是将Co2+氧化为Co3+ |
| C.“反萃取”中可加入H2SO4分离出Co2+ |
| D.“沉钴”时增大Na2CO3溶液的浓度或滴加速率,能够提高产品的纯度 |
您最近一年使用:0次



