1 . CH3COOH+CH3CH2OH CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
 CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是
CH3COOC2H5+H2O △H<0是实验室合成乙酸乙酯的原理,下列有关合成乙酸乙酯的说法,错误的是| A.让乙醇过量,能提高乙酸的转化率 |
| B.合理调节乙醇、乙酸、浓硫酸的比例,能有效节约成本 |
| C.反应过程中适当提高加热温度,既能提高反应速率,又能提高酯的平衡产率 |
| D.加入的浓硫酸能吸收反应过程中产生的水,使平衡正向移动 |
您最近半年使用:0次
2023-11-03更新
|
146次组卷
|
3卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题
名校
2 . 兴趣小组为探究FeCl3在溶液中显黄色的原因,进行如下实验。
下列说法不正确 的是
| 序号 | 操作 | 试剂a | 试剂b | 现象 |
| ① | 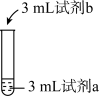 | 0.2mol/L FeCl3 | 蒸馏水 | 溶液为黄色 |
| ② | 0.2mol/L FeCl3 | 2mol/L盐酸 | 溶液为浅黄色 | |
| ③ | 0.2mol/L Fe(NO3)3 | 蒸馏水 | 溶液为浅黄色 | |
| ④ | 0.2mol/L Fe(NO3)3 | 2mol/L硝酸 | 溶液接近无色 |
| A.②中的溶液颜色比①中的浅,主要是因为Fe3+的水解平衡逆向移动 |
| B.由③④可知,Fe(NO3)3溶液显浅黄色与Fe3+水解有关 |
| C.由以上实验可推知,FeCl3溶液显黄色与Fe3+水解、Cl-存在均有关 |
| D.由以上实验可推知,导致②③溶液均为浅黄色的原因相同 |
您最近半年使用:0次
2023-11-02更新
|
370次组卷
|
6卷引用:北京市海淀区2023-2024学年高三上学期期中测试化学试题
名校
解题方法
3 . 有研究表明,铜和稀 反应后的溶液中有
反应后的溶液中有 。取铜丝和过量稀
。取铜丝和过量稀 反应一段时间后的蓝色溶液分别进行实验①~④,操作和现象如下表。
反应一段时间后的蓝色溶液分别进行实验①~④,操作和现象如下表。
已知: 为弱酸,受热发生分解反应:
为弱酸,受热发生分解反应: ;
; 在溶液中呈绿色。
在溶液中呈绿色。
下列推断或分析不合理 的是
 反应后的溶液中有
反应后的溶液中有 。取铜丝和过量稀
。取铜丝和过量稀 反应一段时间后的蓝色溶液分别进行实验①~④,操作和现象如下表。
反应一段时间后的蓝色溶液分别进行实验①~④,操作和现象如下表。| 序号 | 操作 | 现象 |
| ① | 向2mL该溶液中加入几滴浓NaOH溶液,振荡 | 溶液变为浅绿色 |
| ② | 向2mL该溶液中滴加酸性 溶液 溶液 | 紫红色褪去 |
| ③ | 将2mL该溶液充分加热后冷却,再滴加酸性 溶液 溶液 | …… |
| ④ | 用玻璃棒蘸取该溶液滴到淀粉碘化钾试纸上 | 溶液变蓝 |
 为弱酸,受热发生分解反应:
为弱酸,受热发生分解反应: ;
; 在溶液中呈绿色。
在溶液中呈绿色。下列推断或分析
A.①说明 存在电离平衡: 存在电离平衡: |
B.②说明 具有还原性 具有还原性 |
| C.③中,紫红色不褪去 |
D.④说明 具有氧化性 具有氧化性 |
您最近半年使用:0次
2023-11-02更新
|
225次组卷
|
2卷引用:北京市海淀区2023-2024学年高三上学期期中测试化学试题
解题方法
4 . 碘化钾用作制有机物及制药原料,医疗上用于防治甲状腺肿大,作祛痰药,还可用于照相制版等。实验小组设计实验制备KI并探究相关性质。
(一)制备KI
某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如下:
反应I:
反应Ⅱ: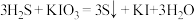
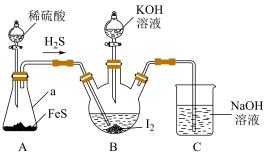
(1)实验开始前,先进行装置气密性检查:将C中导管下端管口浸入液面以下,塞紧瓶塞,微热A装置,若___________ ,则气密性良好。
(2)在装置B中先滴入KOH溶液,待观察到三颈烧瓶中溶液颜色由___________ 色变为___________ 色,停止滴入KOH溶液;然后打开装置A中分液漏斗活塞,待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气,反应完成。
(3)实验中不能用稀硝酸代替稀硫酸的根本原因是___________ 。
(4)装置B中所得KI溶液经分离提纯后得到KI粗产品,为测定KI的纯度,称取1.0g样品溶于水,然后用0.0500mol·L-1酸性KMnO4标准溶液滴定( ),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液20.00mL,则样品的纯度为
),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液20.00mL,则样品的纯度为___________ (保留两位有效数字)。
(二)实验探究:FeCl3与KI的反应
(5)证明实验I中有I2生成,加入的试剂为(有机溶剂除外)___________ 。
(6)已知在酸性较强的条件下,I-可被空气氧化为I2,为探究实验I中20min后棕黄色变深的原因,甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验I中溶液棕黄色变深。甲同学设计的实验为:___________ ,若20min后溶液不变蓝,证明该假设不成立。(可选试剂:0.1mol·L-1KI溶液、0.1mol·L-1FeCl3溶液、淀粉溶液、稀硫酸)
(7)乙同学查阅资料可知:①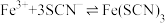 ;②FeCl3与KI反应的平衡体系中还存在反应
;②FeCl3与KI反应的平衡体系中还存在反应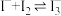 ,
, 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:___________ 。
(一)制备KI
某实验小组设计制备一定量KI的实验(加热及夹持装置已省略)如下:
反应I:

反应Ⅱ:
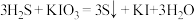

(1)实验开始前,先进行装置气密性检查:将C中导管下端管口浸入液面以下,塞紧瓶塞,微热A装置,若
(2)在装置B中先滴入KOH溶液,待观察到三颈烧瓶中溶液颜色由
(3)实验中不能用稀硝酸代替稀硫酸的根本原因是
(4)装置B中所得KI溶液经分离提纯后得到KI粗产品,为测定KI的纯度,称取1.0g样品溶于水,然后用0.0500mol·L-1酸性KMnO4标准溶液滴定(
 ),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液20.00mL,则样品的纯度为
),杂质不与酸性KMnO4溶液反应。平行滴定三次,滴定到终点平均消耗酸性KMnO4标准溶液20.00mL,则样品的纯度为(二)实验探究:FeCl3与KI的反应
| 序号 | 操作 | 现象 |
| 实验I | 取5mL0.1mol·L-1KI溶液,滴加0.1mol·L-1 FeCl3溶液5~6滴(混合溶液的pH=5) | 溶液变为棕黄色,20min后棕黄色变深 |
| 实验Ⅱ | 取少量实验I中棕黄色溶液于试管中,滴加2滴KSCN溶液 | 溶液变红,20min后红色变浅 |
(5)证明实验I中有I2生成,加入的试剂为(有机溶剂除外)
(6)已知在酸性较强的条件下,I-可被空气氧化为I2,为探究实验I中20min后棕黄色变深的原因,甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验I中溶液棕黄色变深。甲同学设计的实验为:
(7)乙同学查阅资料可知:①
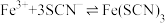 ;②FeCl3与KI反应的平衡体系中还存在反应
;②FeCl3与KI反应的平衡体系中还存在反应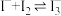 ,
, 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20min后溶液红色变浅的原因:
您最近半年使用:0次
5 . 回答下列问题:
(1)影响化学平衡移动的因素有________ 、_______ 、_______ 。
(2)温度对反应速率的影响(提高了反应物分子的能量),升高温度,反应速率变_______ ,降低温度,反应速率变_______ 。
(3)化学反应中化学键断裂_______ 热,化学键生成______ 热(吸、放)。
(4)化学反应速率的数学表达式为v=________ 。
(5)浓度变化对化学平衡移动的影响规律:
增大反应物浓度或减小生成物浓度,平衡向________ 方向移动。
减小反应物浓度或增大生成物浓度,平衡向_______ 方向移动。
(1)影响化学平衡移动的因素有
(2)温度对反应速率的影响(提高了反应物分子的能量),升高温度,反应速率变
(3)化学反应中化学键断裂
(4)化学反应速率的数学表达式为v=
(5)浓度变化对化学平衡移动的影响规律:
增大反应物浓度或减小生成物浓度,平衡向
减小反应物浓度或增大生成物浓度,平衡向
您最近半年使用:0次
6 . 氯化法制备 TiCl4 的原理为:TiO2(s)+2Cl2(g)+2C(s)  TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是
TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是
 TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是
TiCl4(g)+2CO(g) △H<0,下列有关该反应的说法正确的是A.其他条件不变,平衡后升温,会导致 |
| B.恒容条件下,将平衡体系中的 TiCl4(g)液化分离,体系的颜色不变 |
| C.该反应的反应物的总键能大于生成物的总键能 |
| D.恒温、恒压条件下,通入氩气会导致该平衡正向移动 |
您最近半年使用:0次
名校
7 . 从下列实验事实所引出的相应结论正确的是
| 选项 | 实验事实 | 结论 |
| A | 溴水中有平衡:Br2+H2O HBr+HBrO,当加入AgNO3固体后,溶液颜色变浅 HBr+HBrO,当加入AgNO3固体后,溶液颜色变浅 | 生成物浓度降低,平衡逆向移动 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | K2Cr2O7溶液中存在 (橙)+H2O (橙)+H2O 2 2 (黄)+2H+。加水稀释后,溶液颜色变黄 (黄)+2H+。加水稀释后,溶液颜色变黄 | 加水稀释使该反应的Q<K |
| D | H+浓度相同的盐酸和硫酸分别与等质量的形状相同的锌粒反应 | 硫酸反应速率快 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . 25℃时,下列有关电解质溶液的说法正确的是
| A.氯水存在Cl2(g)+H2O(l)⇌HClO(aq)+H+(aq)+Cl-(aq),向平衡体系加水,c(Cl-)/c(HClO)不变 |
B.室温下向10mL0.1mo1•L-1的氨水中加水稀释后,溶液中 的值增大 的值增大 |
| C.等体积等浓度的盐酸、硫酸、醋酸三种溶液中,c(H+)相等 |
| D.向醋酸溶液中加入少量冰醋酸,醋酸电离平衡向右移动,电离程度增大 |
您最近半年使用:0次
2023-10-26更新
|
859次组卷
|
3卷引用:广东省广州市铁一中学2023-2024学年高二上学期10月月考化学试题
9 . 近年来,出于资源利用和环境保护的目的,CO2催化加氢制CH3OH引起了科学界和工业界的极大兴趣,某科研团队开发的一种具有边反应边分离的双功能的分子筛膜催化反应器用于CO2高效催化加氢制备CH3OH的示意图如图。下列说法错误的是
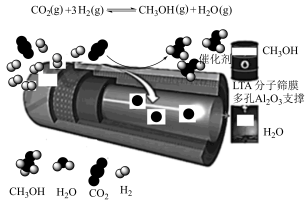

| A.反应过程中有极性键的断裂和形成 | B. 与乙醇互为同分异构体 与乙醇互为同分异构体 |
C. 中的官能团为羟基 中的官能团为羟基 | D.使用分子筛膜可提高 的平衡转化率 的平衡转化率 |
您最近半年使用:0次
名校
10 . 煤气绿色电加热技术对于工业领域用能结构优化具有积极意义。煤气中的有效成分为 和
和 ,通常含有
,通常含有 、
、 、
、 、
、 等杂质。煤气加热过程中,发生的主要气相反应有:
等杂质。煤气加热过程中,发生的主要气相反应有:
Ⅰ.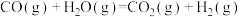

Ⅱ.

Ⅲ.

(1)反应Ⅲ为 转化为
转化为 和
和 的更要反应,该反应在
的更要反应,该反应在___________ (填“高温”或“低温”)下进行有利于提高 的平衡转化率。
的平衡转化率。
(2)煤气电加热过程的析碳是制约该技术发展的关键问题之一,加热过程中主要的析碳副反应如下:
Ⅳ.

Ⅴ.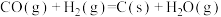

某研究组利用管式反应器开展煤气电加热实验,以 、
、 、
、 的混合气体模拟实际煤气组成,三种组分的物质的武分数比为
的混合气体模拟实际煤气组成,三种组分的物质的武分数比为 。煤气以
。煤气以 的流率通过管式反应器,
的流率通过管式反应器, 后基于反应器的质量变化计算析碳量。通过改变反应器温度及压力,得到
后基于反应器的质量变化计算析碳量。通过改变反应器温度及压力,得到 、
、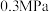 和
和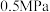 三个压力下的实验结果如图所示:
三个压力下的实验结果如图所示:
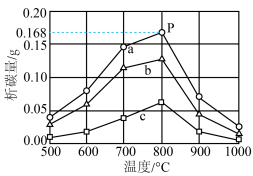
①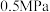 下实验对应的析碳曲线为
下实验对应的析碳曲线为___________ (填“a”“b”或“c”)。
②反应器中通过单位体积煤气产生的析碳量为析碳速率。在P点对应的温度、压力条件下,析碳速率为___________  (结果保留2位小数)。
(结果保留2位小数)。
③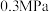 实验中,某温度下测得反应器出口处
实验中,某温度下测得反应器出口处 、
、 、
、 的物质的具分数分别为50%、27%、2%,已知反应V的平衡常数
的物质的具分数分别为50%、27%、2%,已知反应V的平衡常数 ,则出口处反应V
,则出口处反应V___________ (填“达到”或“未达到”)平衡,判断依据为___________ 。
④根据图示实验结果,一定压力下析碳量随温度升高呈现先增大后降低的趋势,其原因为___________ 。
(3)针对煤气电加热析碳问题,研究者提出在煤气中加入一定比例的 或
或 来抑制析碳,某研究组用一定比例的
来抑制析碳,某研究组用一定比例的 或
或 代替
代替 掺入煤气中进行实验,得到析碳量随
掺入煤气中进行实验,得到析碳量随 和
和 掺入比例变化如图所示。
掺入比例变化如图所示。
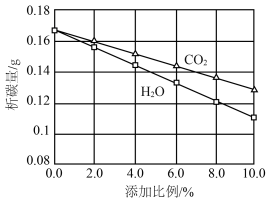
①析碳量随加入 和
和 添加比例增加而降低,请结合反应方程式解释原因:
添加比例增加而降低,请结合反应方程式解释原因:___________ 。
②结合反应速率及反应平衡分析,请再写出一条減少管式反应器煤气加热过程析碳的方法:___________ 。
 和
和 ,通常含有
,通常含有 、
、 、
、 、
、 等杂质。煤气加热过程中,发生的主要气相反应有:
等杂质。煤气加热过程中,发生的主要气相反应有:Ⅰ.
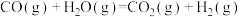

Ⅱ.


Ⅲ.


(1)反应Ⅲ为
 转化为
转化为 和
和 的更要反应,该反应在
的更要反应,该反应在 的平衡转化率。
的平衡转化率。(2)煤气电加热过程的析碳是制约该技术发展的关键问题之一,加热过程中主要的析碳副反应如下:
Ⅳ.


Ⅴ.
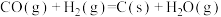

某研究组利用管式反应器开展煤气电加热实验,以
 、
、 、
、 的混合气体模拟实际煤气组成,三种组分的物质的武分数比为
的混合气体模拟实际煤气组成,三种组分的物质的武分数比为 。煤气以
。煤气以 的流率通过管式反应器,
的流率通过管式反应器, 后基于反应器的质量变化计算析碳量。通过改变反应器温度及压力,得到
后基于反应器的质量变化计算析碳量。通过改变反应器温度及压力,得到 、
、 和
和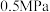 三个压力下的实验结果如图所示:
三个压力下的实验结果如图所示:
①
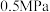 下实验对应的析碳曲线为
下实验对应的析碳曲线为②反应器中通过单位体积煤气产生的析碳量为析碳速率。在P点对应的温度、压力条件下,析碳速率为
 (结果保留2位小数)。
(结果保留2位小数)。③
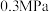 实验中,某温度下测得反应器出口处
实验中,某温度下测得反应器出口处 、
、 、
、 的物质的具分数分别为50%、27%、2%,已知反应V的平衡常数
的物质的具分数分别为50%、27%、2%,已知反应V的平衡常数 ,则出口处反应V
,则出口处反应V④根据图示实验结果,一定压力下析碳量随温度升高呈现先增大后降低的趋势,其原因为
(3)针对煤气电加热析碳问题,研究者提出在煤气中加入一定比例的
 或
或 来抑制析碳,某研究组用一定比例的
来抑制析碳,某研究组用一定比例的 或
或 代替
代替 掺入煤气中进行实验,得到析碳量随
掺入煤气中进行实验,得到析碳量随 和
和 掺入比例变化如图所示。
掺入比例变化如图所示。
①析碳量随加入
 和
和 添加比例增加而降低,请结合反应方程式解释原因:
添加比例增加而降低,请结合反应方程式解释原因:②结合反应速率及反应平衡分析,请再写出一条減少管式反应器煤气加热过程析碳的方法:
您最近半年使用:0次



