名校
解题方法
1 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
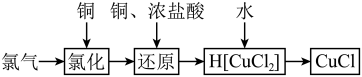
 的装置如图所示:
的装置如图所示: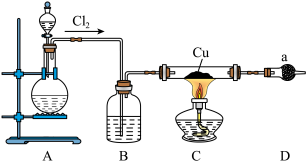
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
名校
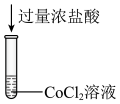
2 . 化学小组探究 与
与 是否存在反应,实验过程如下图所示。
是否存在反应,实验过程如下图所示。
 与
与 是否存在反应,实验过程如下图所示。
是否存在反应,实验过程如下图所示。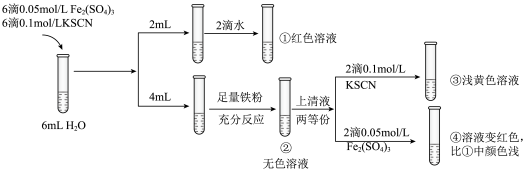
A.②中溶液无色是因为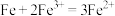 ,导致平衡 ,导致平衡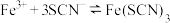 逆向移动 逆向移动 |
B.③中溶液略显黄色,可能是因为②→③过程中 被空气氧化 被空气氧化 |
C.④中溶液颜色比①浅,说明 与 与 反应导致 反应导致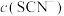 减小 减小 |
D.将向①中加入的2滴水改为2滴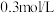  溶液,两次实验后的溶液颜色相同 溶液,两次实验后的溶液颜色相同 |
您最近一年使用:0次
解题方法
3 . 下列实验方案设计、现象和结论正确的是
| 选项 | 实验目的 | 方案与现象 | 结论 |
| A | 探究反应物浓度对化学平衡的影响 | 向 的 的 溶液,再滴加10滴 溶液,再滴加10滴 的 的 溶液,溶液由黄色变为橙色 溶液,溶液由黄色变为橙色 | 说明增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
| B | 探究其他离子对化学平衡的影响 | 向 溶液中加入2滴 溶液中加入2滴 溶液,产生血红色,再加入少量 溶液,产生血红色,再加入少量 溶液后血红色变浅 溶液后血红色变浅 | 说明钾离子对该平衡有一定的抑制作用 |
| C | 判断水解常数大小: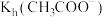 与 与 | 室温下,用 计分别测量等浓度的 计分别测量等浓度的 和 和 溶液的 溶液的 ,前者大于后者 ,前者大于后者 | 水解常数大小: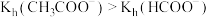 |
| D | 探究 和 和 在水溶液中的反应 在水溶液中的反应 | 向 溶液中滴加 溶液中滴加 溶液,有白色浑浊出现,并产生气体 溶液,有白色浑浊出现,并产生气体 | 说明 和 和 在相互促进水解 在相互促进水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 下列事实不能用平衡移动原理解释的是
A.镁条在水中产生少量气泡后反应停止,在1mol/L 溶液中持续产生气泡 溶液中持续产生气泡 |
| B.二氧化锰与稀盐酸共热不产生氯气,与浓盐酸共热产生氯气 |
| C.在硫酸铜溶液中加入氯化钠固体,充分溶解后溶液变为蓝绿色 |
| D.在氯水中加入少量碳酸钙,可以增强氯水的氧化性 |
您最近一年使用:0次
名校
5 . 某小组对 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是
资料:
 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是资料:
| 物质 |  |  |  |
| 溶液中的颜色 | 粉红色 | 蓝色 | 无色 |
| 操作 |
| 将a中得到的蓝色溶液均分为3份,分别倒入试管 、 、 、 、 中 中 | ||
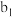 |
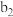 |
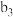 | ||
| 现象 | a中现象:加入浓盐酸后,溶液由粉红色变为蓝色 | 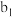 中现象:溶液变为粉红色 中现象:溶液变为粉红色 | 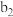 中现象 中现象 | 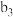 中现象 中现象 |
A.试管a中存在平衡: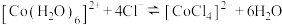 |
B.由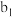 中现象可推测稳定性: 中现象可推测稳定性: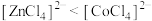 |
C.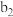 中现象可能为产生白色沉淀 中现象可能为产生白色沉淀 |
D.推测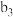 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 |
您最近一年使用:0次
2024-05-31更新
|
174次组卷
|
2卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题
名校
6 . 在1373K、100kPa反应条件下,H2S可以发生热解反应: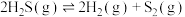 △H>0。对于
△H>0。对于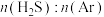 分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。下列说法错误的是
分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。下列说法错误的是
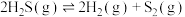 △H>0。对于
△H>0。对于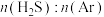 分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。下列说法错误的是
分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。下列说法错误的是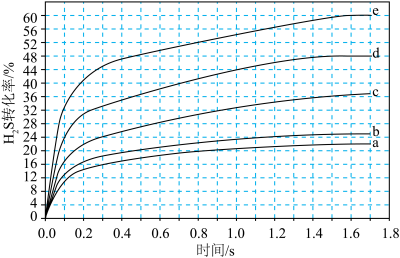
| A.H2S热分解反应的正反应活化能大于逆反应活化能 |
B.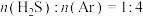 时,在0~0.9s之间,H2S分压的平均变化率为35.6 时,在0~0.9s之间,H2S分压的平均变化率为35.6 |
| C.生成a mol S2,同时形成4a mol H-S键,说明反应已达平衡 |
| D.等温等压下加入惰性气体越多,H2S平衡转化率会提高 |
您最近一年使用:0次
名校
7 . 某研究小组试探究1,6-己二硫醇(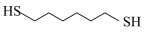 ,用HDT表示)与铜的反应历程。
,用HDT表示)与铜的反应历程。
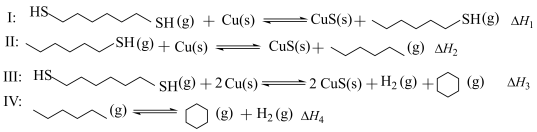
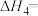
化学键 | C-H | C-C | H-H |
键能/ | 413 | 347 | 436 |
(2)温度一定时,在隔绝空气的条件下使HDT(g)以恒定的流速通过如甲图所示的反应器,仅发生反应Ⅰ、Ⅱ、Ⅲ,在反应器出口处实时检测各物质的相对含量如图乙所示。
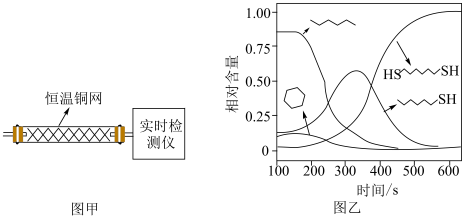
②推测
 在该实验条件下与Cu反应生成烃类产物的名称为
在该实验条件下与Cu反应生成烃类产物的名称为(3)向恒温刚性容器M中充入己烷(g)和HDT(g),初始总压为2.5Pa,己烷的体积分数为80%。容器M中只发生反应Ⅳ,达平衡时,己烷的转化率为50%,则反应Ⅳ的

(
 )
)
您最近一年使用:0次
2024-05-30更新
|
76次组卷
|
2卷引用:湖北省黄冈中学2024届高三下学期5月第三次模拟考试化学试题
8 . 研究 的综合利用具有重要的意义。
的综合利用具有重要的意义。
Ⅰ. 催化重整制氢气
催化重整制氢气
一种 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为 ,进行步骤Ⅱ。
,进行步骤Ⅱ。___________ 。
(2)步骤Ⅱ中还存在少量副反应: ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是___________ 。
②反应进行 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是___________ 。
Ⅱ. 用于烟气脱硝
用于烟气脱硝
(3) 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:
反应Ⅰ

反应Ⅱ

反应Ⅲ
①反应Ⅲ的
___________  。
。
②反应Ⅰ和反应II的平衡常数分别为 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
___________ (用 、
、 表示)。
表示)。
(4)模拟烟气脱硝:一定条件下,将 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是___________ 。
②当温度高于 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是___________ 。
 的综合利用具有重要的意义。
的综合利用具有重要的意义。Ⅰ.
 催化重整制氢气
催化重整制氢气一种
 与
与 催化重整制取
催化重整制取 的过程如图1所示。在反应管中加入
的过程如图1所示。在反应管中加入 和催化剂,先通入
和催化剂,先通入 ,待步骤Ⅰ完成后,再将
,待步骤Ⅰ完成后,再将 以一定流速通入,并控制温度为
以一定流速通入,并控制温度为 ,进行步骤Ⅱ。
,进行步骤Ⅱ。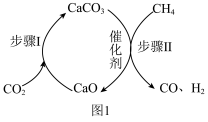
(2)步骤Ⅱ中还存在少量副反应:
 ,测得出口处
,测得出口处 和
和 的流量随时间变化如图2所示。
的流量随时间变化如图2所示。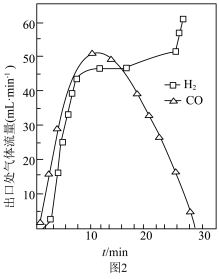
 时出口处气体流量
时出口处气体流量 略高于
略高于 的原因是
的原因是②反应进行
 后,反应管中仍残留较多
后,反应管中仍残留较多 ,但
,但 流量迅速降低,
流量迅速降低, 流量升高,可能的原因是
流量升高,可能的原因是Ⅱ.
 用于烟气脱硝
用于烟气脱硝(3)
 烟气脱硝相关反应如下:
烟气脱硝相关反应如下:反应Ⅰ


反应Ⅱ
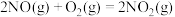

反应Ⅲ

①反应Ⅲ的

 。
。②反应Ⅰ和反应II的平衡常数分别为
 、
、 ,则相同温度下反应Ⅲ的
,则相同温度下反应Ⅲ的
 、
、 表示)。
表示)。(4)模拟烟气脱硝:一定条件下,将
 、
、 和
和 按
按 匀速通过催化脱硝反应器,测得
匀速通过催化脱硝反应器,测得 去除率和
去除率和 转化率随反应温度的变化如图3所示。
转化率随反应温度的变化如图3所示。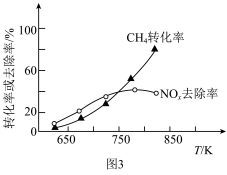
 时,
时, 的去除率随温度升高而升高,可能原因是
的去除率随温度升高而升高,可能原因是②当温度高于
 时,
时, 的去除率随温度升高而降低,可能原因是
的去除率随温度升高而降低,可能原因是
您最近一年使用:0次
名校
解题方法
9 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 探究Fe和S反应特点 | 将适量硫粉和铁粉混合堆成条状。用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒。 | 混合物继续保持红热并持续扩散,粉末呈黑色 | 该反应为放热反应 |
| B | 比较沉淀的Ksp大小 | 向相同浓度和体积的浓氨水中,分别加入等量AgCl和AgI固体,充分搅拌 | 氯化银溶解,碘化银无变化 | Ksp:AgCl>AgI |
| C | 判断平衡移动的方向 | 将装有NO2气体的注射器的活塞缓慢向外拉 | 红棕色逐渐变浅 | 可逆反应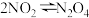 平衡正向移动 平衡正向移动 |
| D | 检验Na2S2O3样品是否含有Na2SO4杂质 | 取少量样品溶于水,先加入过量稀盐酸,过滤,向滤液中滴加少量BaCl2溶液 | 滤液中出现浑浊 | 该样品中含有Na2SO4杂质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
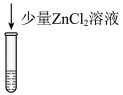
10 . 以 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
资料:i.水溶液中: 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。
ii. ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。
将等体积的溶液a分别加到等量铜粉中,实验记录如下:
(1)Ⅰ中产生白色沉淀的离子方程式是____________ 。
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将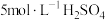 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。
依据电极反应式,分析产生 的原因
的原因____________ 。
②Ⅱ中溶液变为黄色,用离子方程式解释可能原因____________ 。
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1: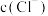 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因____________ 。
②假设2: 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:______ (填操作和现象),证实假设2不合理。
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因______ 。
(5)结合现象和化学反应原理解释选择 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因____________ 。
 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。资料:i.水溶液中:
 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。ii.
 ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。将等体积的溶液a分别加到等量铜粉中,实验记录如下:
实验 | 溶液a | 现象 |
Ⅰ |  溶液( 溶液( ) ) | 产生白色沉淀,溶液蓝色变浅,5h时铜粉剩余 |
Ⅱ | 浓盐酸(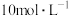 ) ) | 产生无色气泡,溶液无色;继而溶液变为黄色;较长时间后溶液变为棕色,5h时铜粉剩余 |
Ⅲ |  溶液( 溶液( )和浓盐酸( )和浓盐酸(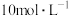 ) ) | 溶液由黄绿色变为棕色,无气泡;随着反应进行,溶液颜色变浅,后接近于无色,5h时铜粉几乎无剩余 |
(1)Ⅰ中产生白色沉淀的离子方程式是
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为
 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将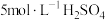 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。依据电极反应式,分析产生
 的原因
的原因②Ⅱ中溶液变为黄色,用离子方程式解释可能原因
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1:
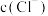 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因
②假设2:
 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因
(5)结合现象和化学反应原理解释选择
 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因
您最近一年使用:0次