解题方法
1 . 人体内血红蛋白分子(Hb)与O2形成氧合血红蛋白,人体生命维持取决于血红蛋白与氧的结合及其对氧的释放。反应方程式如下所示,下列叙述不正确 的是
Hb(aq)(血红蛋白)+O2(aq) PbO2(aq)(氧合血红蛋白)
PbO2(aq)(氧合血红蛋白)
Hb(aq)(血红蛋白)+O2(aq)
 PbO2(aq)(氧合血红蛋白)
PbO2(aq)(氧合血红蛋白)| A.人体大量运动时肌肉需氧量上升平衡逆向移动 |
| B.人体吸氧越多有利于氧合血红蛋白形成,对人体健康越有利 |
| C.突然进入高海拔的高山上出现高山病时是由于上述平衡逆移导致 |
| D.长时间在高山区生活人群血液中血红蛋白含量比生活在平原地区人多 |
您最近一年使用:0次
2 . 二氧化硫的催化氧化反应: 是工业制硫酸中的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正确的是
是工业制硫酸中的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正确的是
 是工业制硫酸中的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正确的是
是工业制硫酸中的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正确的是A.加入合适催化剂可以提高 的平衡产率 的平衡产率 |
| B.缩小容器容积可以增大活化分子百分含量 |
C.扩大容器容积可以提高 的平衡产率 的平衡产率 |
| D.缩小容器容积可以增大反应速率 |
您最近一年使用:0次
解题方法
3 . 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。
(1)在含 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是___ 。
(2)用NaClO可以将氨氮(NH3、NH )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式___ 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
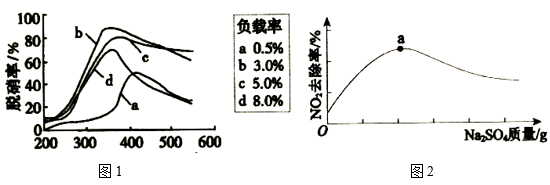
为达到最佳的脱硝效果,应采取的反应条件为___ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+ (aq)
(aq) CaSO4(s)+
CaSO4(s)+ (aq)
(aq)
Ⅱ. (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是___ 。
(1)在含
 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是(2)用NaClO可以将氨氮(NH3、NH
 )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

为达到最佳的脱硝效果,应采取的反应条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+
 (aq)
(aq) CaSO4(s)+
CaSO4(s)+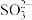 (aq)
(aq)Ⅱ.
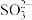 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq) 浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是
您最近一年使用:0次
2021-06-30更新
|
142次组卷
|
2卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
名校
4 . I.现有下列物质①熔化的NaCl②盐酸③氯气④冰醋酸⑤铜⑥酒精⑦硫酸氢钠⑧液氨⑨SO2⑩Al2O3,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
II.工业合成氨N2(g)+3H2(g) 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
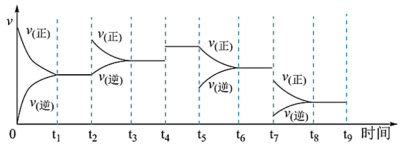
(4)其中 t4时刻所对应的实验条件改变是_____ ,t5时刻所对应的实验条件改变是_____ ,平衡常数最大的时间段是_____ 。
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
(6)实际生产中一般采用的反应条件为400~500℃,原因是_______ 。
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于非电解质,但溶于水后的水溶液能导电的是
II.工业合成氨N2(g)+3H2(g)
 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
(4)其中 t4时刻所对应的实验条件改变是
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
您最近一年使用:0次
解题方法
5 . 研究CO和 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。
(1)用CO和 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
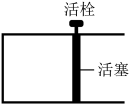
①能够说明反应已经处于平衡状态的是:_________ 。
A.容器内CO的物质的量浓度不变
B.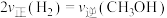
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内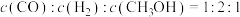
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时 的体积百分含量将
的体积百分含量将_________ (填“增大”、“减少”或“不变”)
(2)二氧化碳是潜在的碳资源,可以与 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。
①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为: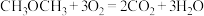 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为_________ 。

②以二氧化钛表面覆盖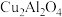 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:_________ 。

 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。(1)用CO和
 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
①能够说明反应已经处于平衡状态的是:
A.容器内CO的物质的量浓度不变
B.
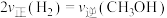
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内
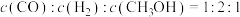
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时
 的体积百分含量将
的体积百分含量将(2)二氧化碳是潜在的碳资源,可以与
 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为:
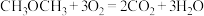 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为
②以二氧化钛表面覆盖
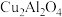 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
您最近一年使用:0次
6 . 许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(1)亚氯酸钠 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在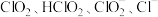 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
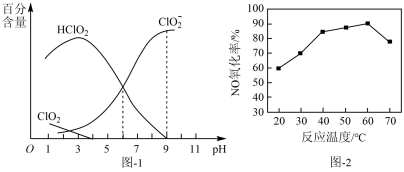
①25℃时,
_______  。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,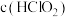
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②酸性条件下,NaClO2能将烟气中的NO氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
③温度高于60℃时,NO氧化率下降,其原因是_______ 。
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当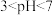 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是_______ 。
②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是_______ 。
(1)亚氯酸钠
 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在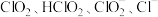 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
①25℃时,

 。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,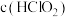
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②酸性条件下,NaClO2能将烟气中的NO氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③温度高于60℃时,NO氧化率下降,其原因是
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当
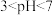 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是
您最近一年使用:0次
7 . 在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一、甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应I CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0
反应II CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0
反应III CO(g) +H2O(g) CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3
(1)已知部分化学键的键能数据如下表:
则ΔH3=___________ ,若反应III的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= ____ kJ·mol-1。
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有___________ 。
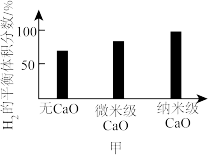
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是___________ 。
③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是___________ (填字母)。
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是___________ ,CH4的平衡转化率随温度升高而增大的原因是___________ 。
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为___________ mol·L-1·min-1,反应III的压强平衡常数Kp=___________ 。(用含m,n,t的代数式表示)
反应I CH4(g) +H2O(g)
 CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0反应II CH4(g) +2H2O(g)
 CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0反应III CO(g) +H2O(g)
 CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3(1)已知部分化学键的键能数据如下表:
| 化学键 | O-H | H-H | C=O | C≡O( CO) |
| 键能/(kJ·mol -1) | 463 | 436 | 803 | 1075 |
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是

③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为
您最近一年使用:0次
解题方法
8 . 金属铬坚硬,耐腐蚀,可做镀层金属,并且在制皮革,羊毛,火柴,颜料等方面均有其应用。但是Cr(Ⅵ)致癌,因此国家对废水中Cr含量有严格的排放标准。已知: Ksp[Cr(OH)3]= 1 ×10-32。
(1)基态Cr原子外围电子排布式为_______ 。
(2)还原法
①可以选择焦亚硫酸钠或硫代硫酸钠(Na2S2O3在酸性条件下分解为HSO 、SO
、SO )处理含铬(VI)废水,处理费用低。其工艺流程如图:
)处理含铬(VI)废水,处理费用低。其工艺流程如图:

反应池中发生反应的离子方程式_______ 。
②Cr2O 在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是 _______ 。
③室温下,加入石灰乳调节pH,当Cr3+完全沉淀时[c(Cr3+)≤1 ×10-6mol/L],溶液pH范围是_______ 。
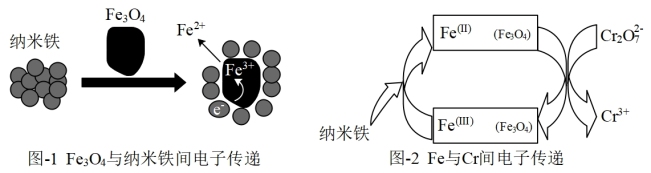
(3)Fe3O4/纳米Fe去除法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的Cr2O 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
(ii)依据如下两个图示信息,上述实验3降解Cr2O 效率增大的原因是
效率增大的原因是 _______ 。
(1)基态Cr原子外围电子排布式为
(2)还原法
①可以选择焦亚硫酸钠或硫代硫酸钠(Na2S2O3在酸性条件下分解为HSO
 、SO
、SO )处理含铬(VI)废水,处理费用低。其工艺流程如图:
)处理含铬(VI)废水,处理费用低。其工艺流程如图:
反应池中发生反应的离子方程式
②Cr2O
 在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
在酸性条件下氧化性强,其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是 ③室温下,加入石灰乳调节pH,当Cr3+完全沉淀时[c(Cr3+)≤1 ×10-6mol/L],溶液pH范围是
(3)Fe3O4/纳米Fe去除法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的Cr2O
 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。| 实验编号 | 纳米 Fe(g/L) | Fe3O4(g/L) | Cr2O 实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
 效率增大的原因是
效率增大的原因是 
您最近一年使用:0次
名校
9 . 某种工业废水中含有一定量的Cr2O 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。
I.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
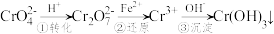
(1)已知第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①Cr2O 中Cr的化合价是
中Cr的化合价是___________ 。
②常温下,若平衡体系的pH=12,则溶液显___________ 色。
(2)第②步发生反应的离子方程式为___________ 。
(3)往FeCl3+3KSCN 3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动
3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动___________ (向逆反应方向、向正反应方向、不移动)
II.取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O 的物质的量为
的物质的量为___________ mol。
 和CrO
和CrO ,它们易被人体吸收积累而导致肝癌。
,它们易被人体吸收积累而导致肝癌。I.污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
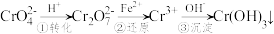
(1)已知第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①Cr2O
 中Cr的化合价是
中Cr的化合价是②常温下,若平衡体系的pH=12,则溶液显
(2)第②步发生反应的离子方程式为
(3)往FeCl3+3KSCN
 3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动
3KCl+Fe(SCN)3的平衡体系中加少量的KCl固体,平衡向哪个方向移动II.取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,充分反应后滴入几滴淀粉作指示剂。
步骤Ⅲ:用0.1000mol·L-1的Na2S2O3溶液测定上面产生的碘单质。(I2+2Na2S2O3=2NaI+Na2S4O6)当溶液由蓝色变无色时为滴定终点,消耗Na2S2O3溶液18.00mL
(4)求所取25.00mL废水经酸化后,含有Cr2O
 的物质的量为
的物质的量为
您最近一年使用:0次
21-22高三下·上海浦东新·阶段练习
名校
解题方法
10 . 在恒温恒容的容器中发生反应X(g)+nY(g)⇌2M(g)+N(?),下列说法正确的是
| A.若n≠1,X,Y的转化率一定不相等 |
| B.转移走部分N,X的转化率一定增大 |
| C.增大压强,X的转化率减小,N一定为气体 |
| D.增加M的量,M的百分含量一定增大 |
您最近一年使用:0次
2022-04-01更新
|
302次组卷
|
3卷引用:上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022年高三下学期3月等级考化学试题四川省遂宁市射洪中学校2021-2022学年高二下学期期中考试化学试题上海市七宝中学2022-2023学年高二下学期期末考试化学试题



