1 . 在一定温度下,将X和Y各0.16mol加入10L恒容密闭容器中,发生下列反应: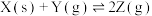
 。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
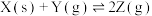
 。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.2min末的反应速率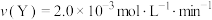 |
| B.7min时该反应恰好达到化学平衡状态 |
C.此反应的平衡常数表达式为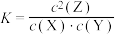 |
| D.其他条件不变,再充入0.1mol X、0.1mol Y、0.2mol Z,此时v(逆)>v(正) |
您最近一年使用:0次
2 . 在一定条件下,某反应达到平衡时,平衡常数 。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是
 。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,D的浓度增加。下列说法正确的是| A.该反应的焓变为正值 | B.降低温度,平衡向正反应方向移动 |
C.若增大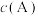 ,K值增大 ,K值增大 | D.若增大压强,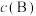 不变 不变 |
您最近一年使用:0次
3 . 在一密闭容器中发生反应: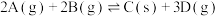
 ,达到平衡时采取下列措施,可以使正反应速率增大、D的物质的量浓度增大的是
,达到平衡时采取下列措施,可以使正反应速率增大、D的物质的量浓度增大的是
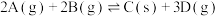
 ,达到平衡时采取下列措施,可以使正反应速率增大、D的物质的量浓度增大的是
,达到平衡时采取下列措施,可以使正反应速率增大、D的物质的量浓度增大的是| A.移走少量C | B.升高温度 |
| C.缩小容积,增大压强 | D.容积不变,充入氦气 |
您最近一年使用:0次
2023-08-12更新
|
163次组卷
|
2卷引用:浙江省宁波市三锋联盟2022-2023学年高二上学期11月期中考试化学试题
名校
4 . 二氧化碳的转化和利用成为实现“碳达峰”、“碳中和”的重要研究课题。回答下列问题。
利用CO2和H2可生产乙烯。相关热化学方程式为:
反应Ⅰ:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) ∆H1=-246.4kJ∙mol-1
CH2=CH2(g)+4H2O(g) ∆H1=-246.4kJ∙mol-1
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H2=-166.8kJ∙mol-1
CH4(g)+2H2O(g) ∆H2=-166.8kJ∙mol-1
(1)某催化剂作用下,在容积为2.0L的恒容密闭容器中充入2mol CO2和6mol H2,体系中主要发生上述反应Ⅰ和反应Ⅱ两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如图所示,该催化剂在840℃时主要选择反应_______ (填“Ⅰ”或“Ⅱ”);840℃之后,C2H4产量下降的原因是_______ 。

(2)520℃时,0~tmin内用氢气表示反应Ⅱ的平均反应速率v(H2)=_______ mol/(L·min)(用含t的代数式表示)。
(3)利用工业废气CO2制甲醇,发生反应Ⅲ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H3。可以一定程度摆脱当下对化石燃料的依赖。
CH3OH(g)+H2O(g) ∆H3。可以一定程度摆脱当下对化石燃料的依赖。
①上述反应自发的条件是_______ 。
②在aL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生反应Ⅲ,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势_______ 。

③一定条件下,将1mol CO2和1mol H2置于恒容密闭容器中,发生反应Ⅲ,下列能说明反应达到平衡状态的是_______ 。
A.混合气体的密度保持不变 B.CO2的消耗速率与H2O的消耗速率相等
C.CO2的体积分数保持不变 D.混合气体的平均相对分子质量保持不变
④现向2L恒温密闭容器中充入2mol CO2和4mol H2,上述反应达平衡时,测得CO2的转化率为50%,则反应Ⅲ的K=_______ 。
利用CO2和H2可生产乙烯。相关热化学方程式为:
反应Ⅰ:2CO2(g)+6H2(g)
 CH2=CH2(g)+4H2O(g) ∆H1=-246.4kJ∙mol-1
CH2=CH2(g)+4H2O(g) ∆H1=-246.4kJ∙mol-1反应Ⅱ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H2=-166.8kJ∙mol-1
CH4(g)+2H2O(g) ∆H2=-166.8kJ∙mol-1(1)某催化剂作用下,在容积为2.0L的恒容密闭容器中充入2mol CO2和6mol H2,体系中主要发生上述反应Ⅰ和反应Ⅱ两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如图所示,该催化剂在840℃时主要选择反应

(2)520℃时,0~tmin内用氢气表示反应Ⅱ的平均反应速率v(H2)=
(3)利用工业废气CO2制甲醇,发生反应Ⅲ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H3。可以一定程度摆脱当下对化石燃料的依赖。
CH3OH(g)+H2O(g) ∆H3。可以一定程度摆脱当下对化石燃料的依赖。①上述反应自发的条件是
②在aL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生反应Ⅲ,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势

③一定条件下,将1mol CO2和1mol H2置于恒容密闭容器中,发生反应Ⅲ,下列能说明反应达到平衡状态的是
A.混合气体的密度保持不变 B.CO2的消耗速率与H2O的消耗速率相等
C.CO2的体积分数保持不变 D.混合气体的平均相对分子质量保持不变
④现向2L恒温密闭容器中充入2mol CO2和4mol H2,上述反应达平衡时,测得CO2的转化率为50%,则反应Ⅲ的K=
您最近一年使用:0次
5 . 某物质A由三种常见的元素组成,某兴趣小组进行了如下实验:
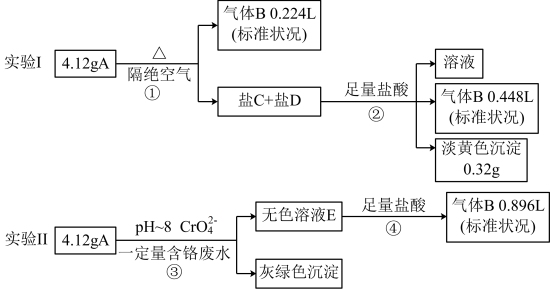
已知:A的摩尔质量在200~300g/mol之间,焰色为紫色;盐C和盐D的组成元素和A相同,①②④处气体体积均在充分加热挥发后经干燥测定。
(1)组成A的元素有_______ ;A的化学式_______ ;
(2)无色溶液E中所有阴离子结合H+的能力由强到弱的顺序_______ ;
(3)一种生产A的方法:在35~45℃下气体B与锌粉—水悬浮液反应生成中间产物;然后加入相应的碱溶液,充分反应,压滤分离得A溶液。写出该过程的总反应方程式_______ ;
(4)A可除去废水(pH~8)中的Cr(VI),且处理后pH变化不大,则反应③的离子方程式_______ ;
(5)设计实验确定溶液E中所含溶质的阴离子_______ ;

已知:A的摩尔质量在200~300g/mol之间,焰色为紫色;盐C和盐D的组成元素和A相同,①②④处气体体积均在充分加热挥发后经干燥测定。
(1)组成A的元素有
(2)无色溶液E中所有阴离子结合H+的能力由强到弱的顺序
(3)一种生产A的方法:在35~45℃下气体B与锌粉—水悬浮液反应生成中间产物;然后加入相应的碱溶液,充分反应,压滤分离得A溶液。写出该过程的总反应方程式
(4)A可除去废水(pH~8)中的Cr(VI),且处理后pH变化不大,则反应③的离子方程式
(5)设计实验确定溶液E中所含溶质的阴离子
您最近一年使用:0次
名校
解题方法
6 . 工业合成氨反应:N2(g)+3H2(g)  2NH3(g) △H= -92.4kJ/mol。下列措施有利于提高H2平衡转化率的是
2NH3(g) △H= -92.4kJ/mol。下列措施有利于提高H2平衡转化率的是
 2NH3(g) △H= -92.4kJ/mol。下列措施有利于提高H2平衡转化率的是
2NH3(g) △H= -92.4kJ/mol。下列措施有利于提高H2平衡转化率的是| A.升高温度 | B.增大压强 |
| C.使用铁触媒做催化剂 | D.增大H2的浓度 |
您最近一年使用:0次
2022-04-16更新
|
1116次组卷
|
5卷引用:浙江省宁波市三锋联盟2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
7 . 侯式制碱法工艺流程及反应原理如图。

下列相关说法不正确的是

下列相关说法不正确的是
| A.使用饱和食盐水,c(Na+)可以达到最大,有利于NaHCO3沉淀 |
B.沉淀池中先通入NH3,再持续通入CO2,有利于增大c(HCO ) ) |
| C.母液中加入细小食盐颗粒,c(Cl-)提高,有利于NH4Cl更多地析出 |
D.母液中通入NH3,c(CO )和c(NH )和c(NH )提高,有利于NH4Cl更多地析出但纯度降低 )提高,有利于NH4Cl更多地析出但纯度降低 |
您最近一年使用:0次
2022-01-23更新
|
464次组卷
|
4卷引用:浙江省宁波市金兰教育合作组织2022-2023学年高二上学期期中联考化学试题
8 . 室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述不正确 的是
 C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述| A.加入NaOH,可增大乙醇的物质的量 |
| B.将氢溴酸改成NaBr(s)和浓硫酸,可能有利于生成C2H5Br |
| C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变 |
| D.若起始温度提高至60℃,可缩短反应达到平衡的时间 |
您最近一年使用:0次
2021-12-10更新
|
239次组卷
|
3卷引用:浙江省余姚市2022-2023学年高三上学期适应性测试化学试题
浙江省余姚市2022-2023学年高三上学期适应性测试化学试题浙江省余姚市慈溪市2021-2022学年高三上学期适应性测试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)



