名校
解题方法
1 . 反应mX(g) nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
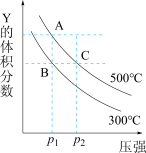
 nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
| A.该反应的ΔH>0 | B.m<n+p |
| C.B、C两点化学平衡常数:KB>KC | D.A、C两点的反应速率v(A)<v(C) |
您最近一年使用:0次
2022-09-15更新
|
2039次组卷
|
47卷引用:福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题
福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题山东省泰安市宁阳县复圣中学2022-2023学年高二上学期期末考试化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题四川省宜宾市第四中学校2023-2024学年高二上学期9月月考化学试题四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题重庆市荣昌中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期期中考试化学(理科)试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题 贵州省遵义市仁怀市第六中学2023-2024学年高二上学期期中考试化学试题河南省驻马店市环际大联考2023-2024学年高二上学期11月期中考试化学试题2015-2016学年浙江台州中学高二上第三次统练化学试卷内蒙古自治区北京八中乌兰察布分校2018-2019学年高二下学期第一次月考化学试题湖北省随州二中2019-2020学年高二上学期9月份月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题甘肃省镇原县镇原中学2019-2020学年高二上学期期中考试化学(理)试题甘肃省镇原县镇原中学2019-2020学年高一上学期期中考试化学(理)试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)2020年北京高二下学期 复习模拟试题二(选修4人教版)安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)重庆市暨华中学校2021-2022学年高二上学期第一次月考化学试题四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题天津市武清区崔黄口中学2021-2022学年高二上学期第一次练习化学试题重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题四川省广安市2021-2022学年高二上学期期末考试化学试题河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题吉林省长春市第六中学2021-2022学年高二上学期第三学程考试(理)化学试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题山东省滕州市第一中学2022-2023学年高二上学期11月月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题 重庆市育才中学校2022-2023学年高二上学期期中考试化学试题陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期1月期末化学试题
2 . 工业上用接触法制备浓硫酸的原理如下:
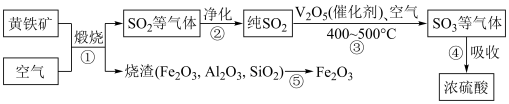
已知: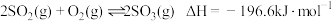
下列说法错误的是

已知:
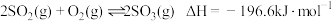
下列说法错误的是
| A.增大反应容器的体积可以提高煅烧速率 |
| B.步骤④中产生的尾气经净化后循环利用可以提高原料利用率 |
C.温度过高不利于 的催化氧化反应 的催化氧化反应 |
D.步骤③中充入适当过量的空气能提高 的转化率 的转化率 |
您最近一年使用:0次
2022-05-09更新
|
222次组卷
|
3卷引用:福建省福清西山学校2023-2024学年高二上学期12月月考化学试题
3 . 下列有关事实和解释均正确的是
| 选项 | 事实 | 解释 |
| A | 分别向K3[Fe(CN)6]溶液和Fe(SCN)3溶液中滴加等浓度的氢氧化钠溶液,只有Fe(SCN)3溶液中有黄色沉淀生成 | CN-对Fe3+的配位能力比SCN-更强,溶液中没有Fe3+ |
| B | 向碘的四氯化碳溶液中加入适量浓KI溶液,振荡试管,溶液紫色变浅 | c(I-)增大,I2+I- I I 平衡向右移动 平衡向右移动 |
| C | 向酸式滴定管中加入蒸馏水,打开活塞让水缓缓流下,可看到水呈直线状垂直流入烧杯中。若用头发摩擦过的气球靠近,水流会向一侧偏转 | 水分子中含有极性键,会受到带电物体的吸引 |
| D | 向盛有AgCl沉淀的试管中滴入足量1mol/L氨水,振荡,溶液变澄清 | AgCl+2NH3=[Ag(NH3)2]Cl,NH3的N接受电子对 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-20更新
|
122次组卷
|
2卷引用:福建省莆田锦江中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
4 . 下列有关实验现象的解释或所得结论正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某补血口服液中滴加几滴酸性 溶液 溶液 | 酸性 溶液紫色褪去 溶液紫色褪去 | 该补血口服液中一定含有 |
| B | 用蒸馏水溶解 固体,并继续加水稀释 固体,并继续加水稀释 | 溶液由绿色逐渐变为蓝色 | 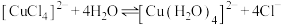 正向移动 正向移动 |
| C | 将25℃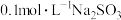 溶液加热到40℃,用传感器监测溶液pH变化 溶液加热到40℃,用传感器监测溶液pH变化 | 溶液的pH逐渐减小 | 温度升高, 水解平衡正向移动 水解平衡正向移动 |
| D | 将铜与浓硫酸反应产生的气体通入 溶液中 溶液中 | 产生白色沉淀 | 该气体中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-01更新
|
1273次组卷
|
8卷引用:福建省福州格致中学2023-2024学年高三上学期期中考试化学试题
名校
5 . 向一体积为2L的恒容密闭容器里充入1molN2和4molH2,在一定温度下发生反应:N2(g)+3H2(g) 2NH3(g)ΔH<0.10s时达到平衡,c(NH3)为0.4mol·L-1。下列说法正确的是
2NH3(g)ΔH<0.10s时达到平衡,c(NH3)为0.4mol·L-1。下列说法正确的是
 2NH3(g)ΔH<0.10s时达到平衡,c(NH3)为0.4mol·L-1。下列说法正确的是
2NH3(g)ΔH<0.10s时达到平衡,c(NH3)为0.4mol·L-1。下列说法正确的是| A.该反应达到平衡时H2的转化率为40% |
| B.降低温度能使混合气体的密度增大 |
| C.向该容器中充入N2,平衡正向移动 |
| D.研发高效催化剂可大大提高NH3的产率 |
您最近一年使用:0次
2021-12-01更新
|
111次组卷
|
2卷引用:福建省泉州市南安市侨光中学2023-2024学年高二上学期11月月考化学试题
6 . NO2和N2O4存在平衡:2NO2(g)⇌N2O4(g) △H<0。下列分析正确的是
| A.1 mol平衡混合气体中含1 mol N原子 |
| B.断裂2 mol NO2中的共价键所需能量小于断裂1 mol N2O4中的共价键所需能量 |
| C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 |
| D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅 |
您最近一年使用:0次
2021-09-03更新
|
7995次组卷
|
29卷引用:福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题
福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题北京市房山区2022-2023学年高三二模化学试题天津市第一中学2022-2023学年高三上学期1月期末质量检测化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省佛山市顺德区郑裕彤中学2023-2024学年上学期高一10月月考化学试题云南省中央民族大学附属中学昆明五华实验学校2023-2024学年高二上学期期中考试化学试题北京市西城外国语学校2023-2024学年高二上学期期中考试化学试题河北省滦州市第二中学2023-2024学年高二上学期期中考试 化学试题天津市武清区黄花店中学2023-2024学年高三上学期第二次练习化学试题山东省菏泽市郓城县第一中学2023-2024学年高二上学期第一次阶段测试化学试题2021年新高考北京化学高考真题(已下线)专题23 化学平衡的移动和化学反应进行的方向(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练山东省潍坊市第四中学2021-2022学年高二上学期10月检测化学试卷2021年北京高考化学试题变式题1-10浙江省吴兴高级中学2021-2022学年高二上学期12月月考化学试题北京市第八中学2021-2022学年高二上学期期末考试化学试题(已下线)卷05 化学能与热能-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)专题9 平衡移动专练北京市第一六一中学2022-2023学年高三上学期开学测试化学试题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题广东省佛山市顺德区卓越高中(李兆基中学、华侨中学、顺德一中西南学校、郑裕彤中学)2022-2023学年高二上学期期中联考化学试题山东省青岛第十九中学2022-2023学年高二上学期期中考试化学试题辽宁省本溪市高级中学2022-2023学年高三上学期期中测试化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷云南省保山市腾冲市第八中学2021-2022学年高二上学期期中考试化学试题
7 . 反应Fe3++3SCN- Fe(SCN)3达到平衡后,其他条件不变时,下列措施能使平衡向正反应方向移动的是
Fe(SCN)3达到平衡后,其他条件不变时,下列措施能使平衡向正反应方向移动的是
 Fe(SCN)3达到平衡后,其他条件不变时,下列措施能使平衡向正反应方向移动的是
Fe(SCN)3达到平衡后,其他条件不变时,下列措施能使平衡向正反应方向移动的是| A.增大Fe3+浓度 | B.减小SCN-浓度 |
| C.增大Fe(SCN)3浓度 | D.滴加NaOH溶液 |
您最近一年使用:0次
2021-06-27更新
|
870次组卷
|
7卷引用:福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题
福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题福建省平潭翰英中学2022-2023学年高二上学期第一次月考化学试题贵州省2020年12月学业水平考试化学试题(已下线)第二章 第三节化学平衡(第2课时 化学平衡的影响因素)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(原卷版)(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)课前-2.4 化学反应的调控-课前、课中、课后(人教版2019选择性必修1)(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
名校
8 . 恒容条件下进行反应 ,下列措施会造成平衡逆向移动的是
,下列措施会造成平衡逆向移动的是
 ,下列措施会造成平衡逆向移动的是
,下列措施会造成平衡逆向移动的是A.充入 | B.升高温度 | C.充入 | D.移出 |
您最近一年使用:0次
2021-01-22更新
|
173次组卷
|
2卷引用:福建省厦门市海沧中学2023-2024学年高二上学期期中考试化学试题
名校
9 . 如图是FeCl3溶液与KSCN溶液反应的实验示意图。下列分析不正确 的是


A.溶液中存在平衡:Fe3++3SCN- Fe(SCN)3 Fe(SCN)3 |
| B.滴加FeCl3溶液达平衡后,c(SCN-)降低 |
| C.滴加FeCl3溶液达平衡后,观察到溶液红色加深 |
| D.滴加FeCl3溶液,平衡正向移动,体系中c(Fe3+)降低 |
您最近一年使用:0次
2021-01-20更新
|
265次组卷
|
8卷引用:福建省华安县第一中学2023-2024学年高二上学期12月月考化学试题
10 . 天然气净化过程中产生有毒的 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。
(1)工业上用克劳斯工艺处理含 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应: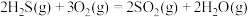 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1
催化转化器中的反应: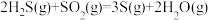 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______ 。
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是______ 。
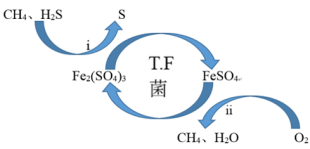
A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3) 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
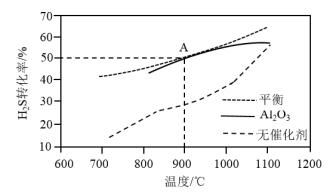
①在约1100℃时,有无 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为______ 。
②在压强p、温度T, 催化条件下,将
催化条件下,将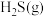 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实______ ,平衡常数Kp=______ (以分压表示,分压=总压×物质的量分数)
(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:
纯碱溶液吸收少量  的离子方程式为
的离子方程式为______ 。
 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。(1)工业上用克劳斯工艺处理含
 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应:
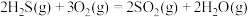 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1催化转化器中的反应:
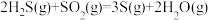 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1克劳斯工艺中获得气态硫黄的总反应的热化学方程式:
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是

A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3)
 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
①在约1100℃时,有无
 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为②在压强p、温度T,
 催化条件下,将
催化条件下,将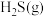 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知
 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:| 电离平衡常数 | 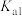 | 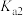 |
 |  | 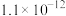 |
 | 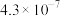 | 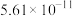 |
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2021-01-03更新
|
1241次组卷
|
9卷引用:福建省福州第三中学2023届高三下学期第一次质量检测化学试题
福建省福州第三中学2023届高三下学期第一次质量检测化学试题(已下线)03 化学反应原理综合题型集训之Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题 八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2022年浙江省6月高考真题变式题26-31(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)



