名校
1 . 对于平衡体系mA(g)+nB(g)⇌pC(g)+qD(g) △H=b kJ·mol-1,下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C.保持其它条件不变,升高温度,D的体积分数增大说明该反应的△H<0。 |
| D.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
您最近一年使用:0次
2018-07-25更新
|
289次组卷
|
7卷引用:河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题
名校
2 . 反应H2(g) + I2(g) 2HI(g)的逆反应速率随时间变化的曲线如下图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是
2HI(g)的逆反应速率随时间变化的曲线如下图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是
 2HI(g)的逆反应速率随时间变化的曲线如下图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是
2HI(g)的逆反应速率随时间变化的曲线如下图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是 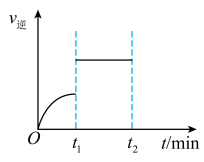
| A.①② | B.③④ | C.②④ | D.①④ |
您最近一年使用:0次
2017-11-11更新
|
762次组卷
|
18卷引用:河北定州中学2023-2024学年高二上学期12月月考化学试题
河北定州中学2023-2024学年高二上学期12月月考化学试题甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题贵州省北京师范大学遵义附属学校2019-2020学年高二下学期第二次月考化学试题山东省新泰一中北校2020-2021学年高二上学期第二次阶段性考试化学试题河北省唐山十县一中联盟2022-2023学年高二上学期期中考试化学试题福建省德化一中、永安一中、漳平一中三校协作2022-2023学年高二上学期12月联考化学试题山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题甘肃省会宁县第一中学2017-2018学年高二上学期期中考试(理)化学试题湖南省衡阳市26中2017-2018学年高二上学期期中考试化学试题湖南省衡阳二十六中2017-2018学年高二上学期期中考试化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)福建省南靖县第一中学、兰水中学2022-2023学年高二上学期期中联考化学试题云南昆明市昆明行知中学2021-2022学年高二上学期期中考试化学试题河南省潢川第一中学2022-2023学年高二上学期期末考试化学试题陕西师范大学附属中学2022-2023学年高一下学期6月期末考试化学试题浙江省宁波市金兰教育合作组织2023-2024学年高二上学期期中联考化学试题江西省宜春市2024-2025学年高二上学期开学考试 化学试题
名校
3 . 一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入lmolN2和3molH2,达平衡时放出热量为QlkJ;向另一体积相同的容器中通入0.5molN2和l.5molH2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是
| A.2Q2l<92.4kJ | B.2Q2=Q1=92.4kJ |
| C.2Q2>Q1=92.4kJ | D.2Q2=Q1<92.4kJ |
您最近一年使用:0次
名校
4 . 一定量的混合气体,在密闭容器中发生如下反应:xA(g) +yB(g)  zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是
 zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为lmol • L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.4 mol • L-1,则下列叙述正确的是| A.平衡向正反应方向移动 | B.A + B  C C |
| C.C的体积分数降低 | D.B的转化率降低 |
您最近一年使用:0次
名校
5 . 反应C(s)+H2O(g)⇌CO(g)+H2(g)在一密闭容器中进行,下列说法或结论能够成立的是( )
| A.当 v(CO)(正)=v(H2)(正)时,反应达平衡状态 |
| B.其他条件不变仅将容器的体积缩小一半,再次平衡时H2O(g)的平衡浓度可能是原来的2.1倍 |
| C.保持体积不变,充入少量He使体系压强增大,反应速率一定增大 |
| D.其他条件不变,适当增加C(s)质量会使平衡正向移动 |
您最近一年使用:0次
2017-09-28更新
|
317次组卷
|
2卷引用:河北省定州中学2018届高三上学期第二次月考化学试题1
名校
6 . 在密闭容器中发生 2CO(g)+SO2(g)  2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是
2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是
 2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是
2CO2(g)+S(s) △H=-akJ·mol-1(a>0)的反应,下列叙述正确的是| A.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ |
| B.达到化学平衡后加入C18O,达新平衡前SO2中不含有18O |
| C.增大压强或升高温度都可以加快化学反应速率并能提高SO2的转化率 |
| D.达到化学平衡后,其它条件不变,容器体积缩小为原来的一半,CO的浓度增大 |
您最近一年使用:0次
2017-09-25更新
|
681次组卷
|
3卷引用:河北省定州中学2018届高三上学期第二次月考化学试题2
河北省定州中学2018届高三上学期第二次月考化学试题2湖南省永州市2018届高三上学期第一次模拟考试化学试题(已下线)第10单元 化学反应速率与化学平衡(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
名校
7 . 在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是| A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 |
| B.该反应在任何条件下都能自发进行 |
| C.再加入一定量氨基甲酸铵,可加快反应速率 |
| D.保持温度不变,压缩体积,达到新的平衡时,NH3的浓度不变 |
您最近一年使用:0次
2017-08-30更新
|
1134次组卷
|
12卷引用:河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题
河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题河南省南阳市第一中学校2023-2024学年高二上学期第一次月考化学试题山东省东明县第一中学2023-2024学年高二上学期10月月考化学试题辽宁省六校协作体2018届高三期初联考化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过模拟(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)山东省2022-2023学年高二上学期学业水平测试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题6-10)福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题
名校
8 . 氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________ 。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________ 。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是_________________ ;测得B(X,60)点时N2的转化率为50%,则X=________ 。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________ 。
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g)
 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1③4NO(g)+6H2O(g)
 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式
(二)工业合成氨的原理为:N2(g)+3H2(g)
 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。(1)下列反应条件的控制不能用勒夏特列原理解释的是
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是

(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:
您最近一年使用:0次
2017-04-25更新
|
866次组卷
|
3卷引用:河北省邢台市第二中学2021届高三上学期第四次月考化学试题
9-10高三·江苏连云港·阶段练习
名校
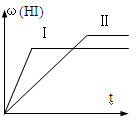
9 . 将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g) 2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
 2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
| A.恒温恒容条件下,加入适当催化剂 |
| B.恒温条件下,缩小反应容器体积 |
| C.恒温条件下,扩大反应容器体积 |
| D.恒容条件下升高温度 |
您最近一年使用:0次
2016-12-05更新
|
239次组卷
|
17卷引用:2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷
2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2016-2017学年河北省卓越联盟高二上第一次月考化学试卷(已下线)2011届江苏赣榆高中高三第一次月考化学卷(已下线)2010—2011学年浙江省海盐元济高级中学高二3月月考化学试卷(已下线)2011-2012学年安徽省泗县双语中学高二第二次月考理科综合试题(化学部分)(已下线)2011-2012学年福建省四地六校高二第二次月考化学试卷(已下线)2011-2012学年浙江省余姚中学高二下学期第一次质检化学试卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2016-2017学年四川省成都市树德中学高二10月阶段性考试化学试卷云南普洱景东彝族自治县第一中学2020-2021学年高二上学期12月月考化学试题(已下线)2011-2012学年广西桂林中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012年浙江永嘉县普高联合体高二下学期期中联考化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷2016-2017学年山东省桓台二中高二上学期期中化学试卷高二人教版选修4 期末学业测评(二)湖南省常德市石门县第一中学2021-2022学年高一下学期期中考试化学试题
10-11高三上·黑龙江·期中
名校
10 . 对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是| A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n |
| C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
D.若温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的 要小 要小 |
您最近一年使用:0次
2015-06-11更新
|
485次组卷
|
11卷引用:河北省故城县高级中学2017-2018学年高二9月月考化学试题
河北省故城县高级中学2017-2018学年高二9月月考化学试题河北省黄骅中学2020-2021学年高二上学期第一次月考化学试题山西省晋中市平遥县第二中学2018-2019学年高二上学期12月月考化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题(已下线)2011届黑龙江省哈六中高三上学期期中考试化学试卷2014-2015安徽省安庆市第一中学高二下学期期中考试化学试卷【校级联考】湖北省孝感市七校教学联盟2018-2019学年高二上学期期中联合考试化学试题甘肃省张掖市山丹县第一中学2019-2020学年高二下学期期中考试化学试题福建省建瓯市芝华中学2021-2022学年高二上学期期中考试化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题



