名校
1 . 向密闭容器中通入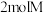 和
和 ,发生反应
,发生反应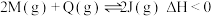 ,温度和压强对
,温度和压强对 平衡转化率的影响如图所示(
平衡转化率的影响如图所示( 代表压强)。下列说法正确的是
代表压强)。下列说法正确的是

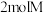 和
和 ,发生反应
,发生反应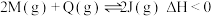 ,温度和压强对
,温度和压强对 平衡转化率的影响如图所示(
平衡转化率的影响如图所示( 代表压强)。下列说法正确的是
代表压强)。下列说法正确的是
A.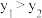 |
B.平衡常数: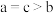 |
C.平均相对分子质量: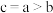 |
D.其他条件不变时,增大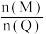 可提高 可提高 的转化率 的转化率 |
您最近一年使用:0次
名校
解题方法
2 . 体积相同的甲、乙两个容器中分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到化学平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3(g),并达到化学平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
 2SO3(g),并达到化学平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3(g),并达到化学平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
您最近一年使用:0次
2022-12-13更新
|
559次组卷
|
90卷引用:云南省保山市第九中学2020-2021学年高二上学期第二次月考化学试题
云南省保山市第九中学2020-2021学年高二上学期第二次月考化学试题(已下线)2011届上海市吴淞中学高三上学期第一次月考化学试卷(已下线)2010-2011学年浙江省余姚中学高二下学期第一次质量检测化学试卷(已下线)2011-2012学年江西省赣县中学南北校区高二9月份联考化学试卷(已下线)2011-2012年河北省灵寿中学高二上学期第一次月考化学试卷(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷(已下线)2014-2015学年福建三明市一中高二上第一次月考化学试卷(已下线)2013-2014学年福建省长乐第一中学高二上学期第二次月考化学试卷(已下线)2014-2015学年甘肃省民乐县第一中学高二上第一次月考化学试卷2014-2015学年内蒙古巴市一中高二10月月考化学试卷2014-2015学年云南省昆明三中、滇池中学高二下期中化学试卷2014-2015学年辽宁实验分校高一下6月阶段测试化学试卷2014-2015学年甘肃省民乐一中高二上学期第一次月考化学试卷2015-2016学年湖南宁远一中、祁阳一中高二上第二次联考化学试卷2016届浙江省建人高复学校高三上学期第三次月考化学试卷2015-2016学年重庆市杨家坪中学高二上学期第三次月考化学试卷2016-2017学年山西省怀仁一中高二上第一次月考化学试卷2016-2017学年黑龙江省双鸭山一中高二上9月月考化学卷2016-2017学年河北省卓越联盟高二上第一次月考化学试卷河北省邱县第一中学2017-2018学年高二上学期第一次月考化学试题湖北省长阳县第一高级中学2017-2018学年高二9月月考化学试题河北省馆陶县第一中学2017-2018学年高二上学期第一次月考化学试题甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二10月阶段考试化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题浙江省东阳中学2018-2019学年高二上学期12月月考化学试题湖北省黄州中学2018-2019学年高二下学期5月月考化学试题黑龙江省齐齐哈尔市第八中学2019-2020学年高二9月月考化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题甘肃省武威第八中学2020-2021学年高二上学期月考化学试题江西省南昌市八一中学2020-2021学年高二上学期10月考试化学试题(已下线)【南昌新东方】7. 南昌十中 徐钢 刘惠文.山西省太原市第五中学2020-2021学年高二上学期10月月考试题安徽省定远县育才学校2020-2021学年高二上学期第二次月考化学试题吉林省梅河口市第五中学2020-2021学年高二上学期第二次月考化学试题河北省石家庄市藁城区第一中学2020-2021学年高二上学期第一次月考化学试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题浙江省绍兴鲁迅中学2021-2022学年高二上学期第一次限时训练化学试题上海市七宝中学2022-2023学年高二上学期10月阶段测试化学试题河北省行唐启明中学2022-2023学年高二上学期12月月考化学试题贵州省贵阳市花溪第六中学2021-2022学年高二上学期月考化学试题湖南省郴州市永兴县童星学校2022-2023学年高二上学期9月月考化学试题宁夏银川市唐徕中学2023-2024学年高二上学期9月月考化学试题湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题(已下线)2010年河南省周口市高二上学期期中考试化学卷(已下线)2010-2011学年内蒙古赤峰二中高二上学期期末考试化学试卷(已下线)2010—2011学年黑龙江省牡丹江一中高二上学期期末考试化学试卷(已下线)2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷(已下线)2012届辽宁省葫芦岛市五校协作体高三上学期模拟考试化学卷(已下线)2011-2012学年甘肃省张掖中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省兖州市高二上学期期中考试化学试卷(已下线)2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年辽宁省东北育才学校高二上学期期中考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年陕西省陕师大附中高二上学期期末试题化学(理)试卷(已下线)2011-2012学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2012-2013学年吉林省白山市第一中学高一下学期期末考试化学试卷(已下线)2013-2014学年陕西省西安市一中高二上学期期中考试化学试卷(已下线)2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷2014-2015内蒙古赤峰市宁城县高二上学期期末考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷2015-2016学年安徽省屯溪一中高二上期中测试化学试卷2015-2016学年湖北航天高中、安陆二中等五校高二上期中化学试卷2015-2016学年甘肃省会宁一中高二上期末考试化学试卷2016-2017学年四川省资阳市高二上学期期末化学试卷2016-2017学年山东省烟台第二中学高二下学期开学考试化学试卷内蒙古北京八中乌兰察布分校2016-2017学年高二下学期期中考试化学试题湖北省咸丰县第一中学2017-2018学年高二上学期期中考试化学试题辽宁省沈阳铁路实验中学2017-2018学年高二上学期期中考试化学试题江西省上饶市铅山一中、弋阳一中2016-2017学年高二上学期期中化学试题(已下线)2018年10月28日 《每日一题》人教选修4--每周一测【全国百强校】广西自治区桂林市第十八中学2018-2019学年高二下学期开学考试化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 易错疑难集训(二)河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题选择性必修1(SJ)专题2易错疑难集训(二)(已下线)第6章 化学反应速率和化学平衡复习-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题河北省行唐启明中学2022-2023学年高二上学期期末考试化学试题陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题甘肃省张掖市高台县第一中学2023-2024学年高二上学期开学(暑假学习效果)检测化学试题山东省青岛第六十八中学2023-2024学年高二上学期期中考试化学试卷四川省泸州市泸县第四中学2023-2024学年高二上学期11月期中考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
3 . 苯乙烯是石油化学工业的重要原料之一。世界上90%以上的苯乙烯是采用乙苯催化脱氢法制得。具体反应为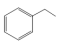 (g)
(g)
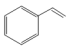 (g)+H2(g) ∆H=+124kJ/mol。
(g)+H2(g) ∆H=+124kJ/mol。
(1)相关物质的相对能量如表所示:
则苯乙烯(g)的相对能量为___ kJ•mol-1。
(2)工业上通常在乙苯蒸气中掺入水蒸气(物质的量之比为1:9),控制反应温度625℃,在等压(p)下进行上述反应,达到平衡时乙苯的转化率为α。
①掺入水蒸气能提高乙苯的平衡转化率,其原因是___ 。
②该温度下,反应的平衡常数Kp=__ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)乙苯催化脱氢制备苯乙烯时,通常会伴随着副反应发生,其中一个反应为 (g)+H2(g)
(g)+H2(g)
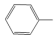 +CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
+CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
①对于该反应,下列说法正确的是____ 。
A.降低乙苯的浓度时,r减小
B.降低甲苯的浓度时,r减小
C.升高反应温度,k增大
D.达到平衡前,甲烷的生成速率逐渐增大
②设反应开始时的反应速率为r0,达到平衡之前,乙苯的转化率为α时的反应速率为r1,则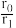 =
=___ 。
(4)含苯乙烯的废水排放会对环境造成严重污染,目前常采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2)。已知:•OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。.
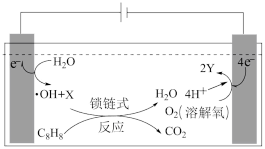
阴极反应式为____ ,X微粒的化学式为____ 。
 (g)
(g)
 (g)+H2(g) ∆H=+124kJ/mol。
(g)+H2(g) ∆H=+124kJ/mol。(1)相关物质的相对能量如表所示:
| 物质 | 乙苯(g) | H2(g) |
| 相对能量/(kJ•mol-1) | a | 0 |
(2)工业上通常在乙苯蒸气中掺入水蒸气(物质的量之比为1:9),控制反应温度625℃,在等压(p)下进行上述反应,达到平衡时乙苯的转化率为α。
①掺入水蒸气能提高乙苯的平衡转化率,其原因是
②该温度下,反应的平衡常数Kp=
(3)乙苯催化脱氢制备苯乙烯时,通常会伴随着副反应发生,其中一个反应为
 (g)+H2(g)
(g)+H2(g)
 +CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。
+CH4(g)。该反应的速率方程为r=k×c乙苯×c氢气,其中r为瞬时速率,k为反应速率常数,c乙苯和c氢气分别为乙苯和氢气的物质的量浓度。某温度下,向恒容密闭容器中充入等物质的量的乙苯和氢气,发生上述反应。①对于该反应,下列说法正确的是
A.降低乙苯的浓度时,r减小
B.降低甲苯的浓度时,r减小
C.升高反应温度,k增大
D.达到平衡前,甲烷的生成速率逐渐增大
②设反应开始时的反应速率为r0,达到平衡之前,乙苯的转化率为α时的反应速率为r1,则
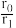 =
=(4)含苯乙烯的废水排放会对环境造成严重污染,目前常采用电解法进行处理,其工作原理如图(电解液是含苯乙烯和硫酸的废水,pH=6.2)。已知:•OH(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成CO2和H2O。.

阴极反应式为
您最近一年使用:0次
名校
解题方法
4 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
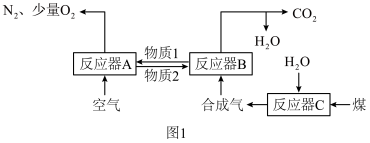
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
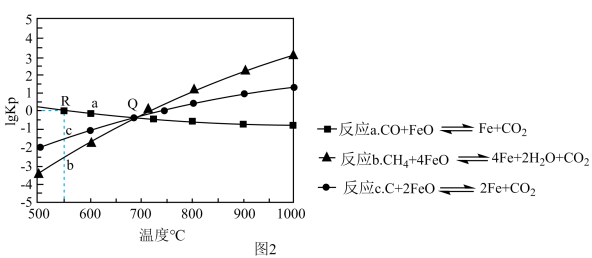
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
292次组卷
|
5卷引用:云南省昆明市第一中学2020届高三上学期12月月考理综试卷化学试题
5 . 为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__ 。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___ 。
②在该温度下反应的平衡常数K=___ 。
③关于上述反应,下列叙述正确的是___ (填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:
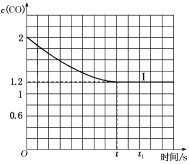
若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___ (不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:
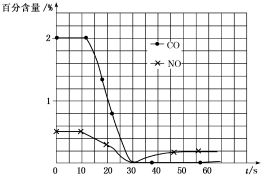
请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___ 。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=
②在该温度下反应的平衡常数K=
③关于上述反应,下列叙述正确的是
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是
您最近一年使用:0次
名校
6 . 在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是
 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是| A.A的转化率变小 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a>c+d |
您最近一年使用:0次
2019-11-19更新
|
189次组卷
|
51卷引用:云南省姚安县第一中学2017-2018学年高二10月月考化学试题
云南省姚安县第一中学2017-2018学年高二10月月考化学试题(已下线)2011-2012学年河南省扶沟高中高二下学期第一次考试化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年福建省福安市高级中学高二上学期第一次月考化学试卷2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷2015-2016学年河北省成安一中高二上学期1月月考化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷黑龙江省哈尔滨市第六中学2017-2018学年高二10月阶段考试化学试题新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题江苏省宿豫中学2019-2020学年度高二下学期调研测试(实验班)化学试题黑龙江省绥化市明水县第一中学2020-2021学年高二上学期第一次月考化学试题吉林省汪清县汪清第四中学2020-2021学年高二上学期第二阶段考试化学试题浙江省台州市路桥区东方理想学校2021-2022学年高二10月阶段性考试化学试题云南省红河县一中2021-2022学年高二上学期期中考试化学试题(已下线)2010-2011学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2010—2011学年浙江省杭州外国语学校高二年级下学期期中考试化学试卷(已下线)2011-2012学年山东省泰安市宁阳二中高二上学期期中考试化学试卷(已下线)2012年沪科版高中化学6.1提示化学反应速率和平衡之谜练习卷(已下线)2012-2013学年广东省实验中学高二上学期期中化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2012-2013福建省上杭一中高二上学期期中考试化学理试卷(已下线)2014届山东省济南一中高二上学期期末考试化学试卷 (已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷2014-2015甘肃省白银市会宁县五中高二上学期期末化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷2015-2016学年江西省铅山一中 、横峰中学高二上期中测试化学试卷2015-2016学年湖北省襄阳市四校高二上学期期中联考化学试卷2015-2016学年河北成安一中、永年二中高二上期中联考化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年河北省邯郸一中高二下期中化学试卷2016-2017学年河北省邯郸市成安一中、永年二中高二上期中化学卷2016-2017学年湖北省宜昌市葛洲坝中学高二上期中化学卷2016-2017学年安徽省合肥一中等名校高二上期末化学卷河南省商丘市九校2017-2018学年高二上学期期中联考化学试题河北省邯郸市2016-2017学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试化学试题(B卷)【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题河北省唐县第一中学2019届高三上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题广东省潮州市潮安区颜锡祺中学2019-2020学年高二上学期期中考试化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题陕西省西安市西航一中2021-2022学年高二上学期期末考试化学试题北京市第一五九中学2021-2022学年高二上学期期中考试化学试题陕西省安康市汉滨区五里高级中学2021-2022学年高二上学期期中考试化学试题
名校
7 . 甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
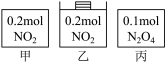
| A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 |
| B.平衡时N2O4的百分含量:乙>甲=丙 |
| C.平衡时甲中NO2与丙中N2O4的转化率不可能相同 |
| D.平衡时混合物的平均相对分子质量:甲>乙>丙 |
您最近一年使用:0次
2019-11-06更新
|
2230次组卷
|
28卷引用:云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题
云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题辽宁省辽阳市集美中学2020届高二12月月考化学试题江西省万载中学2019-2020学年高二12月月考(创新班)化学试题天津市第一中学2021届高三上学期第二次月考化学试题山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题河南省林州市第一中学2020-2021学年高二下学期第二次月考化学试题山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题湖北省武汉市长虹中学2021-2022学年高二上学期10月月考化学试卷四川省广安市华蓥中学校2021-2022学年高二上学期11月月考化学试题山西省山西大学附属中学2022-2023学年高二上学期10月考化学试题山东省青岛第十七中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁一中2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题(已下线)练习4 化学平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题选择性必修1 专题2 第三单元综合训练黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题(已下线)选择性必修1 期中检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)河南省洛阳市2021-2022学年高二上期期中考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题江西省新余市2021-2022学年高二上学期期末检测化学试题2.3.1浓度 压强变化对化学平衡的影响 课后安徽省安庆市第二中学2023-2024学年高二上学期期中考试化学试卷福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
8 . 将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g) 2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
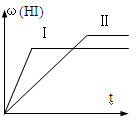
 2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是
| A.恒温恒容条件下,加入适当催化剂 |
| B.恒温条件下,缩小反应容器体积 |
| C.恒温条件下,扩大反应容器体积 |
| D.恒容条件下升高温度 |
您最近一年使用:0次
2016-12-05更新
|
232次组卷
|
17卷引用:云南普洱景东彝族自治县第一中学2020-2021学年高二上学期12月月考化学试题
云南普洱景东彝族自治县第一中学2020-2021学年高二上学期12月月考化学试题(已下线)2011届江苏赣榆高中高三第一次月考化学卷(已下线)2010—2011学年浙江省海盐元济高级中学高二3月月考化学试卷(已下线)2011-2012学年安徽省泗县双语中学高二第二次月考理科综合试题(化学部分)(已下线)2011-2012学年福建省四地六校高二第二次月考化学试卷(已下线)2011-2012学年浙江省余姚中学高二下学期第一次质检化学试卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2016-2017学年河北省卓越联盟高二上第一次月考化学试卷2016-2017学年四川省成都市树德中学高二10月阶段性考试化学试卷(已下线)2011-2012学年广西桂林中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012年浙江永嘉县普高联合体高二下学期期中联考化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷2016-2017学年山东省桓台二中高二上学期期中化学试卷高二人教版选修4 期末学业测评(二)湖南省常德市石门县第一中学2021-2022学年高一下学期期中考试化学试题



