名校
1 . 一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

 xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
| A.x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是增大反应物的浓度或降温 |
| D.t1~t2、t2~t3平衡常数相等,且K=4 |
您最近一年使用:0次
名校
解题方法
2 . 研究氮氧化物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.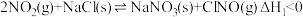
Ⅱ.
①反应: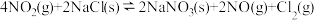 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正)___________  (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。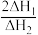 的数值范围是
的数值范围是___________ (填序号)。
A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时
___________ mol,Ⅱ的压强平衡常数
___________ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(2)CO还原氮氧化物的反应如下: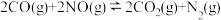
 。
。
①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。
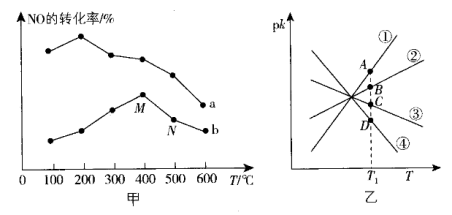
在催化剂作用下,图中M点___________ (填“达到了”或“未达到”)平衡状态。温度高于400℃,NO转化率降低的原因可能是___________ 。
②实验测得 (
(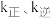 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示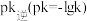 随温度变化的是
随温度变化的是___________ (填序号)升高温度,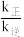
___________ (填“增大”“减小”或“不变”)图中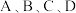 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
___________ L/mol。
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”)。
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.
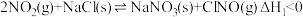
Ⅱ.

①反应:
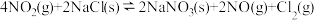 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正) (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。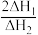 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol
 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时

 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(2)CO还原氮氧化物的反应如下:
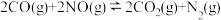
 。
。①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。

在催化剂作用下,图中M点
②实验测得
 (
(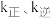 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示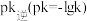 随温度变化的是
随温度变化的是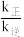
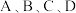 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将
您最近一年使用:0次
名校
解题方法
3 . 以CO2和NH3为原料合成尿素有利于实现“碳达峰、碳中和”,该体系中同时存在以下反应:
Ⅰ.2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159kJ·mol-1
NH2COONH4(s) ΔH1=-159kJ·mol-1
Ⅱ.2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2
Ⅲ.NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=___________ kJ·mol-1,ΔS___________ 0(填“>”或“<”)。
(2)一定温度下,按物质的量之比为2:1通入NH3和CO2至密闭容器中,假设仅发生反应Ⅰ。达到平衡后,CO2的平衡浓度为c1mol·L-1,其他条件不变,缩小容器容积,重新达到平衡后,CO2的平衡浓度为c2mol·L-1,则c1___________ c2(填“>”、“<”或“=”)。
(3)为研究上述三个反应的平衡关系,通入3mol的NH3、CO2混合气体至10L恒容密闭容器中,NH3的平衡分压随初始充入NH3与CO2的物质的量之比、温度的变化关系如图所示。
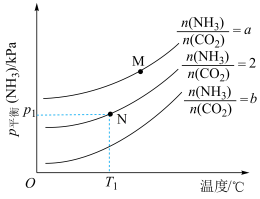
①a___________ b(填“>”或“<”)。
②M点的p平衡(NH3)大于N点的p平衡(NH3),原因为___________ (答一点)。
③T1℃时,反应前容器内气体压强为p0kPa,达到N点对应平衡状态的时间为tmin,则0~tmin时段反应的平均速率v(CO2)=___________ mol·L-1·min-1(用代数式表示)。保持温度不变,平衡后再向容器中通入一定量的水蒸气,NH2COONH4的平衡产率___________ (填“增大”、“减小”或“不变”)。
Ⅰ.2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH1=-159kJ·mol-1
NH2COONH4(s) ΔH1=-159kJ·mol-1Ⅱ.2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2Ⅲ.NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1回答下列问题:
(1)反应Ⅱ的ΔH2=
(2)一定温度下,按物质的量之比为2:1通入NH3和CO2至密闭容器中,假设仅发生反应Ⅰ。达到平衡后,CO2的平衡浓度为c1mol·L-1,其他条件不变,缩小容器容积,重新达到平衡后,CO2的平衡浓度为c2mol·L-1,则c1
(3)为研究上述三个反应的平衡关系,通入3mol的NH3、CO2混合气体至10L恒容密闭容器中,NH3的平衡分压随初始充入NH3与CO2的物质的量之比、温度的变化关系如图所示。

①a
②M点的p平衡(NH3)大于N点的p平衡(NH3),原因为
③T1℃时,反应前容器内气体压强为p0kPa,达到N点对应平衡状态的时间为tmin,则0~tmin时段反应的平均速率v(CO2)=
您最近一年使用:0次
2023-12-11更新
|
143次组卷
|
2卷引用:河南省顶级名校2023-2024学年高三上学期12月教学质量测评理科综合试题
名校
解题方法
4 . 合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
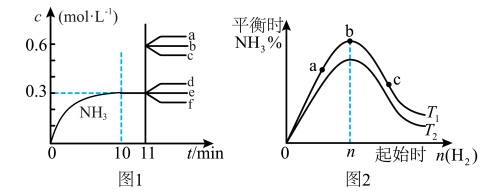
 2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
| A.图1中,10min末H2的消耗速率v(H2)=0.045mol/(L·min) |
| B.图1中,其他条件不变,第11min迅速压缩容器体积为1L,则c(NH3)-t曲线变化为a |
| C.图2中,反应物N2的平衡转化率:b>a>c |
| D.图2中,T1、T2表示温度,则T1>T2 |
您最近一年使用:0次
2023-11-12更新
|
304次组卷
|
4卷引用:河南省南阳市第一中学校2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
5 . 下列实验方案、现象和结论都正确的是
| 实验操作 | 现象 | 结论 | |
| A | 用玻璃棒蘸取新制氯水涂在pH试纸上 | pH试纸变红色 | 氯水显酸性 |
| B | 向酸性KMnO4和H2C2O4的混合溶液中 加入少量MnSO4(s) | 气泡迅速增多 溶液很快褪色 | MnSO4作催化剂 |
| C | 分别取5mL0.2mol/LNa2S2O3溶液和 10mL0.1mol/LNa2S2O3溶液于两支试管中 然后同时加入10mL0.1mol/LH2SO4溶液 | 产生等量浑浊 前者时间更短 | 增大Na2S2O3浓度 可以加快反应速率 |
| D | 对平衡体系2HI H2+I2(g)压缩容器 H2+I2(g)压缩容器 | 颜色加深 | 平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
260次组卷
|
3卷引用:河南省南阳市第一中学校2023-2024学年高二上学期第二次月考化学试题
名校
6 . 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
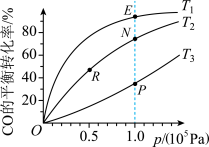
 CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
| A.温度:T1>T2>T3 |
| B.正反应速率:v(E)>v(P)、v(N)>v(R) |
| C.平衡常数:K(E)>K(P)、K(N)>K(R) |
| D.平均摩尔质量:M(E)>M(P)、M(N)>M(R) |
您最近一年使用:0次
2023-04-11更新
|
686次组卷
|
3卷引用:河南省焦作市博爱县第一中学2022-2023学年高三下学期5月月考化学试题
名校
解题方法
7 . 已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
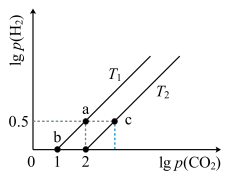
 2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
2CO(g)+2H2(g) △H>0。在密闭容器中充入等体积的反应物,测得平衡时CO2、H2的气体压强对数有如图所示关系,压强的单位为MPa。下列说法错误的是
A.a点时对应的Kp= (MPa) (MPa) |
| B.T1>T2 |
| C.c点对应的p(CO2)=1000MPa |
| D.当容器中CH4与CO的压强比为1∶2时,不能说明该反应达平衡状态 |
您最近一年使用:0次
2023-03-20更新
|
481次组卷
|
3卷引用:河南省平顶山第一中学2022-2023学年高二下学期4月考试化学试题
8 . 甲醇是重要的化上原料,研究甲醇的制备及用途在工业上有重要的意义。回答下列问题:
(1)一种重要的工业制备甲醇的反应为
 。
。
已知:①

②
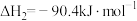
该制备反应的
______ 。升高温度,该制备反应的 的平衡转化率
的平衡转化率______ (填“增大”“减小”或“不变”)。
(2)已知反应 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
在540K下,按初始投料比 、
、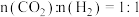 、
、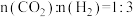 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
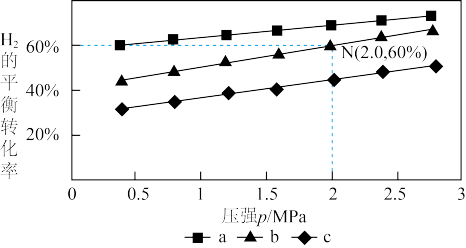
①a、b、c各曲线所表示的投料比由大到小的顺序为______ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数
______ 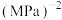 (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻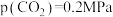 ,
, ,
,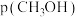
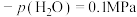 ,此时
,此时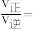
______ (保留两位小数)。
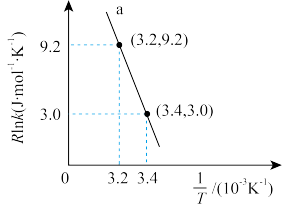
(3)甲醇催化可制取丙烯,反应为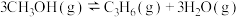 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能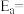
______  。
。
(4)Kistiakowsky曾研究了NOCl光化学分解反应。在一定频率(v)光的照射下,反应的机理为:
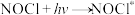

其中 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。则吸收1mol光子可分解
表示NOCl的激发态。则吸收1mol光子可分解______ mol NOCl。
(5)在饱和 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 ,其原理如图所示,则阴极的电极反应式为
,其原理如图所示,则阴极的电极反应式为______ 。
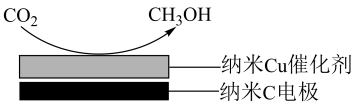
(1)一种重要的工业制备甲醇的反应为

 。
。已知:①


②

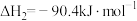
该制备反应的

 的平衡转化率
的平衡转化率(2)已知反应
 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。在540K下,按初始投料比
 、
、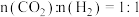 、
、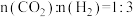 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
①a、b、c各曲线所表示的投料比由大到小的顺序为
②N点在b曲线上,540K时的压强平衡常数

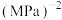 (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。③540K条件下,某容器测得某时刻
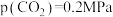 ,
, ,
,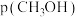
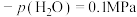 ,此时
,此时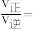
(3)甲醇催化可制取丙烯,反应为
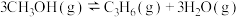 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能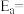
 。
。
(4)Kistiakowsky曾研究了NOCl光化学分解反应。在一定频率(v)光的照射下,反应的机理为:
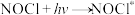

其中
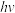 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。则吸收1mol光子可分解
表示NOCl的激发态。则吸收1mol光子可分解(5)在饱和
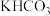 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 ,其原理如图所示,则阴极的电极反应式为
,其原理如图所示,则阴极的电极反应式为
您最近一年使用:0次
名校
9 . 一定温度下,在三个容积均为 的恒容密闭容器中进行反应:
的恒容密闭容器中进行反应: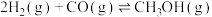 ,并达到平衡。下列说法正确的是
,并达到平衡。下列说法正确的是
 的恒容密闭容器中进行反应:
的恒容密闭容器中进行反应: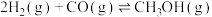 ,并达到平衡。下列说法正确的是
,并达到平衡。下列说法正确的是| 容器 | 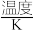 |  | 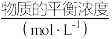 | ||
 |  | 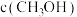 | 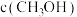 | ||
| I | 400 | 0.20 | 0.10 | 0 | 0.080 |
| II | 400 | 0.40 | 0.20 | 0 | |
| III | 500 | 0 | 0 | 0.10 | 0.025 |
| A.该反应的正反应吸热 |
| B.达到平衡时,容器I中反应物转化率比容器II中的大 |
C.达到平衡时,容器II中 大于容器I中 大于容器I中 的两倍 的两倍 |
| D.达到平衡时,容器III中的正反应速率比容器I中的大 |
您最近一年使用:0次
2022-11-29更新
|
209次组卷
|
2卷引用:河南省安阳市第三十九中学2022-2023学年高二上学期第二次考试化学试题
名校
10 . 某温度下,向容积为10L的恒容密闭容器中充入2molM和4molN,发生反应M(g)十2N(g) P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
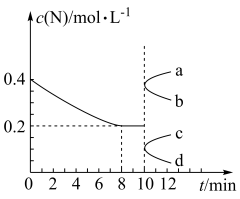
 P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
| A.该反应中,化学计量数x=3 |
| B.反应达到平衡后,仅增大压强,平衡常数也增大 |
| C.8min时,该反应的平衡常数K=2.5 |
| D.10min时,仅将容器容积扩大至原来的两倍,则气体N的物质的量浓度的变化曲线为a |
您最近一年使用:0次
2021-12-16更新
|
592次组卷
|
2卷引用:河南省南阳地区 2021-2022学年高二上学期 12 月阶段检测化学试题



