名校
1 . 用一碘甲烷 热裂解制取低碳烯烃的主要反应有:
热裂解制取低碳烯烃的主要反应有:
反应I:
反应Ⅱ:
反应Ⅲ:
在体积为 的恒容密闭容器中,投入
的恒容密闭容器中,投入 ,不同温度下平衡体系中
,不同温度下平衡体系中 、
、 、
、 物质的量分数随温度变化如图所示。
物质的量分数随温度变化如图所示。不正确 的是
 热裂解制取低碳烯烃的主要反应有:
热裂解制取低碳烯烃的主要反应有:反应I:

反应Ⅱ:

反应Ⅲ:

在体积为
 的恒容密闭容器中,投入
的恒容密闭容器中,投入 ,不同温度下平衡体系中
,不同温度下平衡体系中 、
、 、
、 物质的量分数随温度变化如图所示。
物质的量分数随温度变化如图所示。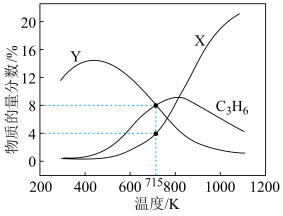
A. |
B.曲线X表示 的物质的量分数 的物质的量分数 |
C. 以前,温度对反应Ⅱ的影响是 以前,温度对反应Ⅱ的影响是 物质的量分数变化的主要因素 物质的量分数变化的主要因素 |
D. 的平衡体系中, 的平衡体系中, 的物质的量分数为 的物质的量分数为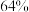 |
您最近一年使用:0次
2 . 实验室以辉铜矿粉(含Cu2S及少量的SiO2、Fe2O3)为原料制备CuSO4∙5H2O晶体,再制备Cu2O,实验过程可表示为:
Ⅱ.Cu2O在酸性环境中不稳定,在潮湿的空气中易被氧化。
(1)“酸浸氧化”时控制温度为80℃、O2流速一定,加入Fe2(SO4)3与NaCl协同浸取。其他条件相同时,铜浸出率与c[Fe2(SO4)3]、c(NaCl)的关系分别如图1、图2所示。___________ 。当c[Fe2(SO4)3]<0.1mol∙L-1时,随着硫酸铁浓度的增大,铜浸出率显著增加的原因可能是___________ 。
②Cl-破坏硫覆盖层,但c(NaCl)>1.0mol∙L-1时,铜浸出率下降,原因可能是___________ 。
(2)制取CuSO4∙5H2O。25℃时,用Cu(OH)2调pH发生反应
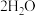 ,其平衡常数K=
,其平衡常数K=___________ ;检验制得的CuSO4∙5H2O晶体中不含有Fe3+的实验方法为___________ 。
(3)制取Cu2O。补充完整制取一定量Cu2O的实验方案:称取25g CuSO4∙5H2O晶体于烧杯中,加入适量蒸馏水溶解,___________ 。[须使用的试剂:葡萄糖(分子式C6H12O6,需过量20%)、NaOH溶液、蒸馏水;需要进行抽滤。]

Ⅱ.Cu2O在酸性环境中不稳定,在潮湿的空气中易被氧化。
(1)“酸浸氧化”时控制温度为80℃、O2流速一定,加入Fe2(SO4)3与NaCl协同浸取。其他条件相同时,铜浸出率与c[Fe2(SO4)3]、c(NaCl)的关系分别如图1、图2所示。

②Cl-破坏硫覆盖层,但c(NaCl)>1.0mol∙L-1时,铜浸出率下降,原因可能是
(2)制取CuSO4∙5H2O。25℃时,用Cu(OH)2调pH发生反应

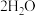 ,其平衡常数K=
,其平衡常数K=(3)制取Cu2O。补充完整制取一定量Cu2O的实验方案:称取25g CuSO4∙5H2O晶体于烧杯中,加入适量蒸馏水溶解,
您最近一年使用:0次
3 . 研究 的回收和综合利用对航天建设有重要意义。
的回收和综合利用对航天建设有重要意义。
(1)回收利用 是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1:
是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1:
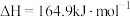 ,该反应是回收利用
,该反应是回收利用 的关键步骤。将原料按
的关键步骤。将原料按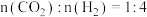 置于恒容密闭容器中发生反应A,在相同时间内测得
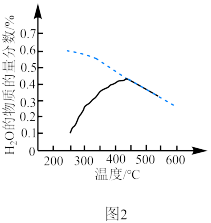
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是___________ 。
②用 代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是___________ 。
(2)利用 与
与 合成甲醇涉及的主要反应如下:
合成甲醇涉及的主要反应如下:
I.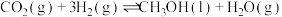
II.
一定条件下向某刚性容器中充入物质的量之比为 的
的 和
和 发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间,
发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间, 转化率和甲醇的选择性[甲醇的选择
转化率和甲醇的选择性[甲醇的选择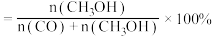 ]随温度变化如图3所示:
]随温度变化如图3所示:___________ cat2(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②某条件下,达到平衡时 的转化率为
的转化率为 ,
, 的选择性为
的选择性为 ,反应II的平衡常数
,反应II的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压 总压
总压 平衡时物质的量分数,保留1位有效数字)
平衡时物质的量分数,保留1位有效数字)
(3)科学家设计了一种新的 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如图4:
的难储存问题,装置如图4:___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为 溶液,对合成甲醇造成的不良后果是
溶液,对合成甲醇造成的不良后果是___________ 。
(4)科研人员提出 催化
催化 合成碳酸二甲酯(DMC),从而实现
合成碳酸二甲酯(DMC),从而实现 的综合利用。图5为理想的
的综合利用。图5为理想的 的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为
的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为___________ 。
 的回收和综合利用对航天建设有重要意义。
的回收和综合利用对航天建设有重要意义。(1)回收利用
 是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1:
是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1: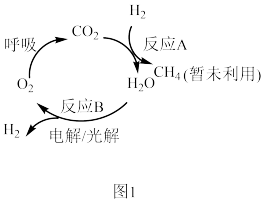

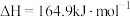 ,该反应是回收利用
,该反应是回收利用 的关键步骤。将原料按
的关键步骤。将原料按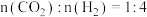 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是②用
 代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是(2)利用
 与
与 合成甲醇涉及的主要反应如下:
合成甲醇涉及的主要反应如下:I.
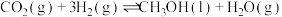
II.

一定条件下向某刚性容器中充入物质的量之比为
 的
的 和
和 发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间,
发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间, 转化率和甲醇的选择性[甲醇的选择
转化率和甲醇的选择性[甲醇的选择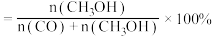 ]随温度变化如图3所示:
]随温度变化如图3所示:
 ”“
”“ ”或“
”或“ ”)。
”)。②某条件下,达到平衡时
 的转化率为
的转化率为 ,
, 的选择性为
的选择性为 ,反应II的平衡常数
,反应II的平衡常数
 总压
总压 平衡时物质的量分数,保留1位有效数字)
平衡时物质的量分数,保留1位有效数字)(3)科学家设计了一种新的
 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如图4:
的难储存问题,装置如图4: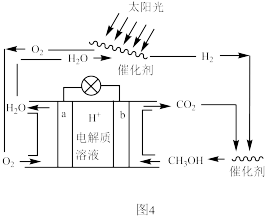
②b电极上的电极反应式为
 溶液,对合成甲醇造成的不良后果是
溶液,对合成甲醇造成的不良后果是(4)科研人员提出
 催化
催化 合成碳酸二甲酯(DMC),从而实现
合成碳酸二甲酯(DMC),从而实现 的综合利用。图5为理想的
的综合利用。图5为理想的 的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为
的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为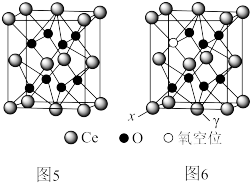
您最近一年使用:0次
4 . 二氧化碳加氢制甲烷过程中的主要反应为
Ⅰ.
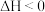
Ⅱ.

在密闭容器中, 、
、 、
、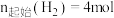 时,平衡后反应体系中各物质的物质的量随温度的变化如题图所示。
时,平衡后反应体系中各物质的物质的量随温度的变化如题图所示。 的选择性可表示为
的选择性可表示为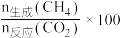 %。
%。
下列说法不正确 的是
Ⅰ.

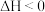
Ⅱ.


在密闭容器中,
 、
、 、
、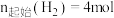 时,平衡后反应体系中各物质的物质的量随温度的变化如题图所示。
时,平衡后反应体系中各物质的物质的量随温度的变化如题图所示。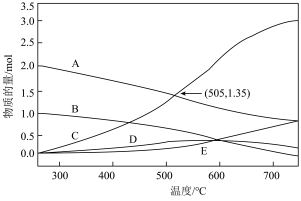
 的选择性可表示为
的选择性可表示为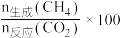 %。
%。下列说法
A. 的物质的量的曲线为B 的物质的量的曲线为B |
| B.CO的平衡选择性随着温度的升高而增加 |
C.在505℃,反应Ⅱ的平衡常数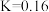 |
D. 平衡转化率随温度的上升先下降后上升 平衡转化率随温度的上升先下降后上升 |
您最近一年使用:0次
7日内更新
|
57次组卷
|
2卷引用:江苏省南通市2023-2024学年高三下学期期中考试化学试题
5 . 氢能是一种极具发展潜力的清洁能源。可通过下列反应大规模制取氢气。
Ⅰ.水煤气变换反应(WGSR)
反应a:
(1)一定压强下,由最稳定单质生成1mol化合物的焓变为该物质的摩尔生成焓。已知 、
、 的摩尔生成焓分别为
的摩尔生成焓分别为 、
、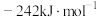 。则
。则 的摩尔生成焓的热化学方程式为
的摩尔生成焓的热化学方程式为_______ 。
(2)实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H₂的体积分数。对比实验的结果如下图所示。投入CaO时, 的体积分数增大的原因为
的体积分数增大的原因为_______ 。投入纳米CaO装置的氢气产率更高,其原因为_______ 。 可用于生产
可用于生产 ,实现
,实现 的资源化,其电极反应式为
的资源化,其电极反应式为_______ 。生成 的电极应连接电源的
的电极应连接电源的_______ 极(选填“正”或“负”)。
Ⅱ.甲烷干重整(DRM)
DRM的主要反应为:
反应b:
反应c:
该过程中会逐渐生成积碳覆盖在催化剂 表面,使催化剂中毒。
表面,使催化剂中毒。
(4)甲烷和二氧化碳的起始物质的量均为1mol,实验测得在0.1MPa下,平衡时各组分的量随温度变化如下图所示。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 。625°C时反应c的压强平衡常数
。625°C时反应c的压强平衡常数 为
为_______ 。 改性,使其形成氧空位,可减少积碳。
改性,使其形成氧空位,可减少积碳。 晶胞如下图所示。取干燥
晶胞如下图所示。取干燥 在Ar气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。加热后,当失重率(损失的质量/总质量)为2.32%时,每个晶胞拥有的
在Ar气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。加热后,当失重率(损失的质量/总质量)为2.32%时,每个晶胞拥有的 的个数为
的个数为_______ 。
Ⅰ.水煤气变换反应(WGSR)
反应a:

(1)一定压强下,由最稳定单质生成1mol化合物的焓变为该物质的摩尔生成焓。已知
 、
、 的摩尔生成焓分别为
的摩尔生成焓分别为 、
、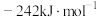 。则
。则 的摩尔生成焓的热化学方程式为
的摩尔生成焓的热化学方程式为(2)实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大H₂的体积分数。对比实验的结果如下图所示。投入CaO时,
 的体积分数增大的原因为
的体积分数增大的原因为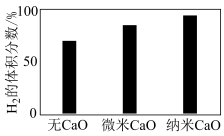
 可用于生产
可用于生产 ,实现
,实现 的资源化,其电极反应式为
的资源化,其电极反应式为 的电极应连接电源的
的电极应连接电源的Ⅱ.甲烷干重整(DRM)
DRM的主要反应为:
反应b:

反应c:

该过程中会逐渐生成积碳覆盖在催化剂
 表面,使催化剂中毒。
表面,使催化剂中毒。(4)甲烷和二氧化碳的起始物质的量均为1mol,实验测得在0.1MPa下,平衡时各组分的量随温度变化如下图所示。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 。625°C时反应c的压强平衡常数
。625°C时反应c的压强平衡常数 为
为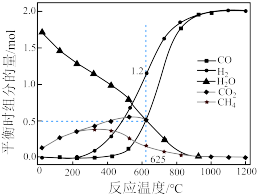
 改性,使其形成氧空位,可减少积碳。
改性,使其形成氧空位,可减少积碳。 晶胞如下图所示。取干燥
晶胞如下图所示。取干燥 在Ar气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。加热后,当失重率(损失的质量/总质量)为2.32%时,每个晶胞拥有的
在Ar气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。加热后,当失重率(损失的质量/总质量)为2.32%时,每个晶胞拥有的 的个数为
的个数为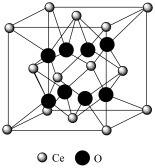
您最近一年使用:0次
解题方法
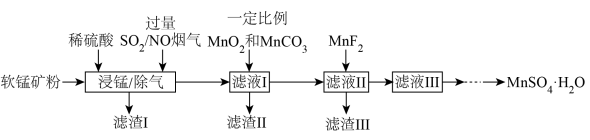
6 . 燃煤烟气中含有大量 和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备
和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备 ,部分流程如下。
,部分流程如下。
已知:①软锰矿(主要成分为 ,另含有少量
,另含有少量 、CaO、
、CaO、 等杂质)。
等杂质)。
② ;
;
③
 发生的主要化学方程式为
发生的主要化学方程式为________ 。
②滤渣Ⅰ的主要成分为________ 。(写化学式)
(2)“除气”过程,烟气中混入一定量 可提高NO脱除率,其可能的原因是:
可提高NO脱除率,其可能的原因是:________ 。
(3)“滤液Ⅰ”中加入等物质的量 和
和 ,反应的离子方程式为:
,反应的离子方程式为:________ 。
(4)“滤液Ⅱ”中用 可除去
可除去 ,结合反应方程式和定量计算说明原因
,结合反应方程式和定量计算说明原因________ 。(当反应平衡常数大于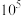 时,可认为反应完全)。
时,可认为反应完全)。
(5)“滤液Ⅲ”可制得 。已知:
。已知:
①在烟气吸收过程中,除生成 外,还容易产生连二硫酸锰(
外,还容易产生连二硫酸锰( ),当温度
),当温度
超过35℃, 会快速分解为
会快速分解为 和
和 。
。
②部分锰盐在不同温度下的溶解度和析出晶体的组成如图。 的实验方案为:
的实验方案为:________ 。(须使用的试剂为: L NaOH溶液,无水乙醇)
L NaOH溶液,无水乙醇)
 和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备
和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备 ,部分流程如下。
,部分流程如下。已知:①软锰矿(主要成分为
 ,另含有少量
,另含有少量 、CaO、
、CaO、 等杂质)。
等杂质)。②
 ;
;
③

 发生的主要化学方程式为
发生的主要化学方程式为②滤渣Ⅰ的主要成分为
(2)“除气”过程,烟气中混入一定量
 可提高NO脱除率,其可能的原因是:
可提高NO脱除率,其可能的原因是:(3)“滤液Ⅰ”中加入等物质的量
 和
和 ,反应的离子方程式为:
,反应的离子方程式为:(4)“滤液Ⅱ”中用
 可除去
可除去 ,结合反应方程式和定量计算说明原因
,结合反应方程式和定量计算说明原因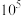 时,可认为反应完全)。
时,可认为反应完全)。(5)“滤液Ⅲ”可制得
 。已知:
。已知:①在烟气吸收过程中,除生成
 外,还容易产生连二硫酸锰(
外,还容易产生连二硫酸锰( ),当温度
),当温度超过35℃,
 会快速分解为
会快速分解为 和
和 。
。②部分锰盐在不同温度下的溶解度和析出晶体的组成如图。

 的实验方案为:
的实验方案为: L NaOH溶液,无水乙醇)
L NaOH溶液,无水乙醇)
您最近一年使用:0次
解题方法
7 . 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
反应Ⅰ:
反应Ⅱ:
①反应Ⅲ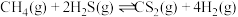 的
的
___________ 。
②反应Ⅱ自发的条件是___________ (填“低温”“高温”或“任何温度”)。
③ 和
和 三种分子的键角大小顺序为
三种分子的键角大小顺序为___________ 。
(2)投料比 ,并用
,并用 稀释:在
稀释:在 ,不同温度条件下反应相同时间后,测得
,不同温度条件下反应相同时间后,测得 和
和 体积分数如下表:
体积分数如下表:
①下列说法一定正确的是___________ (填标号)。
A.其他条件不变时,用 替代
替代 对实验结果几乎无影响
对实验结果几乎无影响
B.恒温恒压下,增加 的体积分数,
的体积分数, 的浓度升高
的浓度升高
C.由实验数据推出 中
中 键弱于
键弱于 中的
中的 键
键
D.由实验数据推出,温度越高, 的平衡转化率越高
的平衡转化率越高
②在 ,
, 下,保持通入
下,保持通入 的体积分数不变,提高投料比
的体积分数不变,提高投料比 的转化率不变,原因是
的转化率不变,原因是___________ 。
③已知反应过程中存在副反应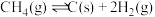 。研究发现,温度高于
。研究发现,温度高于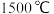 时继续升温,
时继续升温, 的转化率不会增大反而会降低的可能原因是
的转化率不会增大反而会降低的可能原因是___________ 。
(3)在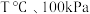 反应条件下,将
反应条件下,将 的混合气进行反应Ⅲ,达到平衡时,
的混合气进行反应Ⅲ,达到平衡时, 分压与
分压与 的分压相同。则反应Ⅲ的标准压强平衡常数
的分压相同。则反应Ⅲ的标准压强平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
,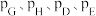 为各组分的平衡分压)。
为各组分的平衡分压)。
(1)已知下列反应的热化学方程式:
反应Ⅰ:

反应Ⅱ:

①反应Ⅲ
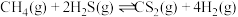 的
的
②反应Ⅱ自发的条件是
③
 和
和 三种分子的键角大小顺序为
三种分子的键角大小顺序为(2)投料比
 ,并用
,并用 稀释:在
稀释:在 ,不同温度条件下反应相同时间后,测得
,不同温度条件下反应相同时间后,测得 和
和 体积分数如下表:
体积分数如下表:| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
 的体积分数/% 的体积分数/% | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
 的体积分数/% 的体积分数/% | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
A.其他条件不变时,用
 替代
替代 对实验结果几乎无影响
对实验结果几乎无影响B.恒温恒压下,增加
 的体积分数,
的体积分数, 的浓度升高
的浓度升高C.由实验数据推出
 中
中 键弱于
键弱于 中的
中的 键
键D.由实验数据推出,温度越高,
 的平衡转化率越高
的平衡转化率越高②在
 ,
, 下,保持通入
下,保持通入 的体积分数不变,提高投料比
的体积分数不变,提高投料比 的转化率不变,原因是
的转化率不变,原因是③已知反应过程中存在副反应
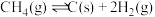 。研究发现,温度高于
。研究发现,温度高于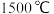 时继续升温,
时继续升温, 的转化率不会增大反而会降低的可能原因是
的转化率不会增大反而会降低的可能原因是(3)在
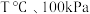 反应条件下,将
反应条件下,将 的混合气进行反应Ⅲ,达到平衡时,
的混合气进行反应Ⅲ,达到平衡时, 分压与
分压与 的分压相同。则反应Ⅲ的标准压强平衡常数
的分压相同。则反应Ⅲ的标准压强平衡常数
 ,
, ,其中
,其中 ,
,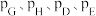 为各组分的平衡分压)。
为各组分的平衡分压)。
您最近一年使用:0次
2024·江苏·模拟预测
8 . CO、SO2等烟道气对环境有污染,需经处理后才能排放,处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为单质S(l):2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH。回答下列问题:
(1)已知CO的燃烧热为283.0 kJ⋅mol-1,S(l)+O2(g)=SO2(g) ΔH=-296.8 kJ⋅mol-1。则上述反应的ΔH=___________ kJ⋅mol-1。
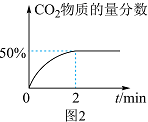
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是___________ 。___________ mol⋅L-1⋅min-1。
②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是___________ (填字母)。
a.选用更高效的催化剂 b.升高温度 c.及时分离出CO2 d.增加CO的浓度
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图3所示。___________ 。
②B点对应条件下Kx=___________ [对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= 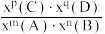 ,x为物质的量分数]。
,x为物质的量分数]。
③A点和C点压强平衡常数之比为___________ (用分压代替浓度,分压=总压×物质的量分数)。
(1)已知CO的燃烧热为283.0 kJ⋅mol-1,S(l)+O2(g)=SO2(g) ΔH=-296.8 kJ⋅mol-1。则上述反应的ΔH=
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是

②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出CO2 d.增加CO的浓度
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图3所示。

②B点对应条件下Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= 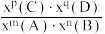 ,x为物质的量分数]。
,x为物质的量分数]。③A点和C点压强平衡常数之比为
您最近一年使用:0次
2024·江苏·模拟预测
9 . 工业上可用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),反应的主要化学方程式为:
反应 (主反应):2CO(g)+4H2(g)
(主反应):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H1
H1
反应 (副反应):CO(g)+2H2(g)
(副反应):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H2
H2
250℃时,将2 mol CO和4.2 mol H2通入容积为1 L的恒容密闭容器中,在催化剂的作用下发生反应,达到平衡后升高温度,在不同温度下测得CO的转化率(或二甲醚的产率)如图所示:
反应
 (主反应):2CO(g)+4H2(g)
(主反应):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H1
H1反应
 (副反应):CO(g)+2H2(g)
(副反应):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H2
H2250℃时,将2 mol CO和4.2 mol H2通入容积为1 L的恒容密闭容器中,在催化剂的作用下发生反应,达到平衡后升高温度,在不同温度下测得CO的转化率(或二甲醚的产率)如图所示:

| A.增大CO浓度有利于提高CO生成CH3OCH3的转化率 |
B.反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(l)的 CH3OCH3(g)+H2O(l)的 H1>0 H1>0 |
| C.260~290℃时,发生CH3OH脱水生成CH3OCH3的反应 |
D.290℃条件下,反应 的化学平衡常数为4 的化学平衡常数为4 |
您最近一年使用:0次
名校
10 . I.汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。已知4CO(g)+2NO2(g) 4CO2(g)+N2(g)
4CO2(g)+N2(g)  H=-1200kJ/mol。
H=-1200kJ/mol。
(1)该反应在___________ (填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___________ (填标号)。
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___________ 乙(填“>、=、<或不确定”,下同)。
②NO2的平衡浓度:甲___________ 乙。
③甲中CO的转化率为50%,该反应的平衡常数为___________ 。
II.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:在1.0L恒容密闭容器中投入1.25molCO2和1.75molH2发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:___________ 反应,p1、p2、p3从大到小的关系排序为___________ 。
(5)M点对应的平衡常数K=___________ ,在p2及512K时,图中N点v正___________ v逆(填“>”<”或“=”)。
 4CO2(g)+N2(g)
4CO2(g)+N2(g)  H=-1200kJ/mol。
H=-1200kJ/mol。(1)该反应在
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___________ (填标号)。
A. | B.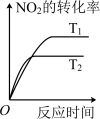 | C.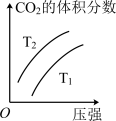 | D.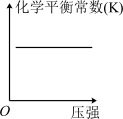 |
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲
②NO2的平衡浓度:甲
③甲中CO的转化率为50%,该反应的平衡常数为
II.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:在1.0L恒容密闭容器中投入1.25molCO2和1.75molH2发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示: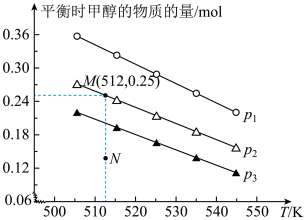
(5)M点对应的平衡常数K=
您最近一年使用:0次



