名校
解题方法
1 .  是重要的资源,
是重要的资源, 催化重整不仅可制得
催化重整不仅可制得 ,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
I.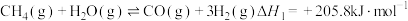
Ⅱ.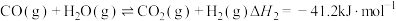
总反应:Ⅲ.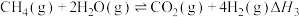
(1)反应Ⅲ的
___________ 。
(2)向反应体系中通入一定比例的 ,有利于重整反应。试从能量角度分析其原因
,有利于重整反应。试从能量角度分析其原因___________ ;进料中氧气量不能过大,原因是___________ 。
(3)生产中向重整反应体系中加入适量多孔 ,其优点是
,其优点是___________ 。
(4)在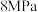 ,
, 条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比
条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比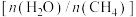 的计算结果如图所示。(物质i的摩尔分数
的计算结果如图所示。(物质i的摩尔分数 )
)___________ 、___________ 的变化曲线(填化学式)。
②投料水碳比为4时,反应Ⅲ的平衡常数
_______  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
 是重要的资源,
是重要的资源, 催化重整不仅可制得
催化重整不仅可制得 ,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:I.
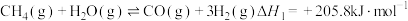
Ⅱ.
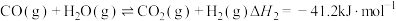
总反应:Ⅲ.
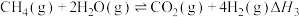
(1)反应Ⅲ的

(2)向反应体系中通入一定比例的
 ,有利于重整反应。试从能量角度分析其原因
,有利于重整反应。试从能量角度分析其原因(3)生产中向重整反应体系中加入适量多孔
 ,其优点是
,其优点是(4)在
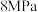 ,
, 条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比
条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比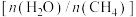 的计算结果如图所示。(物质i的摩尔分数
的计算结果如图所示。(物质i的摩尔分数 )
)
②投料水碳比为4时,反应Ⅲ的平衡常数

 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
您最近一年使用:0次
解题方法
2 .  催化氧化C2H6制取C2H4的新路径涉及以下反应:
催化氧化C2H6制取C2H4的新路径涉及以下反应:
反应Ⅰ: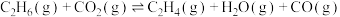

反应Ⅱ: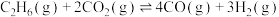

回答下列问题:
(1)计算反应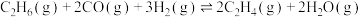 的
的
_______ (用含 和
和 的式子表示)。
的式子表示)。
(2) 和
和 按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“
按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“ 氧化
氧化 制
制 ”的影响,所得实验数据如表:
”的影响,所得实验数据如表:
结合上述数据分析, 催化氧化
催化氧化 制备
制备 的最佳催化剂为
的最佳催化剂为_______ ,判断依据是_______ 。
(3)若向绝热恒容容器中加入 和
和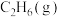 ,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
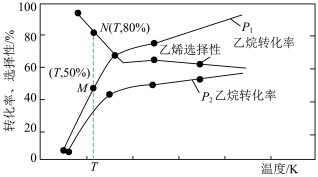
(4)一定条件下,向容积为1.0L的密闭容器中通入2mol 和3mol
和3mol  发生反应Ⅰ和反应Ⅱ,
发生反应Ⅰ和反应Ⅱ, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度、压强的变化关系如图所示(已知:
的选择性随温度、压强的变化关系如图所示(已知: )。
)。
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
②压强为 、温度为T K时,反应达平衡时,混合气体中
、温度为T K时,反应达平衡时,混合气体中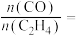
_______ 。
③M点时,反应Ⅰ的平衡常数为_______  (保留2位有效数字)。
(保留2位有效数字)。
 催化氧化C2H6制取C2H4的新路径涉及以下反应:
催化氧化C2H6制取C2H4的新路径涉及以下反应:反应Ⅰ:
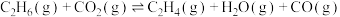

反应Ⅱ:
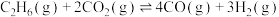

回答下列问题:
(1)计算反应
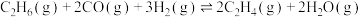 的
的
 和
和 的式子表示)。
的式子表示)。(2)
 和
和 按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“
按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“ 氧化
氧化 制
制 ”的影响,所得实验数据如表:
”的影响,所得实验数据如表:催化剂 |
|
|
催化剂X | 19.0 | 37.6 |
催化剂Y | 18.0 | 21.0 |
 催化氧化
催化氧化 制备
制备 的最佳催化剂为
的最佳催化剂为(3)若向绝热恒容容器中加入
 和
和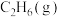 ,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。A. | B.反应体系的平衡常数不变 |
| C.容器内气体的密度不变 | D.容器内气体的平均相对分子质量不变 |
(4)一定条件下,向容积为1.0L的密闭容器中通入2mol
 和3mol
和3mol  发生反应Ⅰ和反应Ⅱ,
发生反应Ⅰ和反应Ⅱ, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度、压强的变化关系如图所示(已知:
的选择性随温度、压强的变化关系如图所示(已知: )。
)。

 (填“>”或“<”),理由是
(填“>”或“<”),理由是②压强为
 、温度为T K时,反应达平衡时,混合气体中
、温度为T K时,反应达平衡时,混合气体中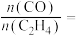
③M点时,反应Ⅰ的平衡常数为
 (保留2位有效数字)。
(保留2位有效数字)。
您最近一年使用:0次
7日内更新
|
27次组卷
|
2卷引用:吉林省松原市2024届高三下学期普通高等学校招生全国统一模拟考试大联考化学试题
3 . 在盛有CuO/Cu2O载氧体的恒容密闭容器中充入空气,发生反应:2Cu2O(s)+O2(g) 4CuO(s) ΔH,平衡时O2的体积分数φ(O2)随反应温度T变化的曲线如图所示。下列说法错误的是
4CuO(s) ΔH,平衡时O2的体积分数φ(O2)随反应温度T变化的曲线如图所示。下列说法错误的是
 4CuO(s) ΔH,平衡时O2的体积分数φ(O2)随反应温度T变化的曲线如图所示。下列说法错误的是
4CuO(s) ΔH,平衡时O2的体积分数φ(O2)随反应温度T变化的曲线如图所示。下列说法错误的是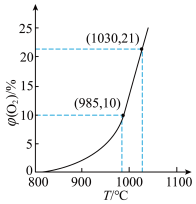
| A.该反应在低温条件下能自发进行 |
| B.在1030℃时加入催化剂,平衡时φ(O2)>21% |
| C.1030℃,当气体密度不再随时间变化而变化时,反应达到了平衡状态 |
| D.985℃达到平衡状态后,充入纯氧,再次达到平衡后,O2浓度不变 |
您最近一年使用:0次
名校
解题方法
4 . 甲烷干重整(DRM)利用 和
和 两种温室气体生产合成气,是一种有效实现碳达峰、碳中和的关键技术,在科学研究和工业应用领域都受到广泛的关注。其反应体系主要有以下几个反应发生:
两种温室气体生产合成气,是一种有效实现碳达峰、碳中和的关键技术,在科学研究和工业应用领域都受到广泛的关注。其反应体系主要有以下几个反应发生:
①

②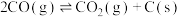

③

④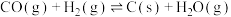

回答下列问题。
(1)
___________ ,反应①自发进行的条件为___________ 。
(2)将一定量的 和
和 加入恒容密闭容器,不同温度下,反应体系压强对
加入恒容密闭容器,不同温度下,反应体系压强对 转化率的影响如图所示,则
转化率的影响如图所示,则 由大到小的顺序为
由大到小的顺序为___________ 。 的条件下,
的条件下, 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。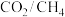 越大,
越大, 转化率
转化率___________ (填“增大”、“减少”或“不变”,下同), 的选择性
的选择性___________ 。请分析 选择性随投料比变化原因
选择性随投料比变化原因___________ 。
(4)在 、初始投料
、初始投料 的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。
的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。 的平衡常数
的平衡常数
___________  (
( 是以分压表示的平衡常数,已知分压
是以分压表示的平衡常数,已知分压 总压
总压 物质的量分数)。
物质的量分数)。
②反应体系在600℃时,有较多积碳产生,为避免积碳过多导致导致催化剂失活,生产中可改变的条件为___________ (答一点即可)。
 和
和 两种温室气体生产合成气,是一种有效实现碳达峰、碳中和的关键技术,在科学研究和工业应用领域都受到广泛的关注。其反应体系主要有以下几个反应发生:
两种温室气体生产合成气,是一种有效实现碳达峰、碳中和的关键技术,在科学研究和工业应用领域都受到广泛的关注。其反应体系主要有以下几个反应发生:①


②
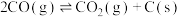

③


④
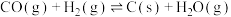

回答下列问题。
(1)

(2)将一定量的
 和
和 加入恒容密闭容器,不同温度下,反应体系压强对
加入恒容密闭容器,不同温度下,反应体系压强对 转化率的影响如图所示,则
转化率的影响如图所示,则 由大到小的顺序为
由大到小的顺序为
 的条件下,
的条件下, 转化率随温度的变化如图所示。
转化率随温度的变化如图所示。
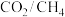 越大,
越大, 转化率
转化率 的选择性
的选择性 选择性随投料比变化原因
选择性随投料比变化原因(4)在
 、初始投料
、初始投料 的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。
的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。
 的平衡常数
的平衡常数
 (
( 是以分压表示的平衡常数,已知分压
是以分压表示的平衡常数,已知分压 总压
总压 物质的量分数)。
物质的量分数)。②反应体系在600℃时,有较多积碳产生,为避免积碳过多导致导致催化剂失活,生产中可改变的条件为
您最近一年使用:0次
名校
5 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
反应Ⅰ.
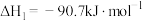
反应Ⅱ.

反应Ⅲ.
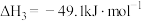
(1)反应Ⅱ的
___________ 
(2)下列措施有利于提高甲醇平衡产率的是___________(填字母)。
(3)反应III的平衡常数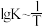 ,的变化关系应为下图的曲线
,的变化关系应为下图的曲线___________ (填“①”或“②”) 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比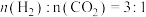 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ (填化学式)。
②体系中 的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的
的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的___________ 反应和反应Ⅲ的___________ 反应(填“正向”或“逆向”)。
(5)T℃时,将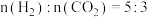 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
反应Ⅱ:
反应Ⅲ:
反应达到平衡状态时, 和
和 的分压相等,甲醇的选择性(产率)是CO的2倍,则
的分压相等,甲醇的选择性(产率)是CO的2倍,则 的平衡转化率为
的平衡转化率为___________ ,反应Ⅲ的
___________ 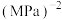 (列出计算式即可)。
(列出计算式即可)。
 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:反应Ⅰ.

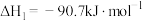
反应Ⅱ.


反应Ⅲ.

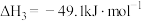
(1)反应Ⅱ的


(2)下列措施有利于提高甲醇平衡产率的是___________(填字母)。
| A.加入适量CO | B.使用催化剂 |
| C.循环利用原料气 | D.升高温度 |
(3)反应III的平衡常数
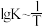 ,的变化关系应为下图的曲线
,的变化关系应为下图的曲线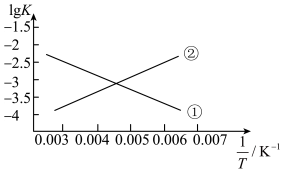
 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比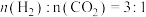 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
②体系中
 的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的
的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的(5)T℃时,将
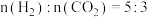 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
为用气体分压表示的平衡常数,分压=物质的量分数×总压。)反应Ⅱ:

反应Ⅲ:

反应达到平衡状态时,
 和
和 的分压相等,甲醇的选择性(产率)是CO的2倍,则
的分压相等,甲醇的选择性(产率)是CO的2倍,则 的平衡转化率为
的平衡转化率为
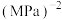 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-05-03更新
|
135次组卷
|
3卷引用:2024届吉林省通化市梅河口市第五中学高三下学期二模化学试题
名校
6 .  作为未来的重要碳源,其选择性加氢合成
作为未来的重要碳源,其选择性加氢合成 一直是研究热点,在
一直是研究热点,在 加氢合成
加氢合成 的体系中,同时发生以下反应:
的体系中,同时发生以下反应:
反应i: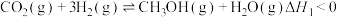
反应ii: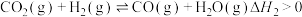
(1)若实验测得反应ⅰ: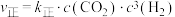 ,
,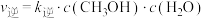 (其中
(其中 、
、 为速率常数。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为:
为速率常数。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为: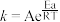 ,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,
,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂, 增大的倍数
增大的倍数_______ (填“>”“<”或“=”) 增大的倍数。
增大的倍数。
(2)在 加氢合成
加氢合成 的体系中,下列说法错误的是_______(填标号)。
的体系中,下列说法错误的是_______(填标号)。
(3)某温度下,向容积为1L的密闭容器中通入2mol 和10mol
和10mol ,10min后体系达到平衡,此时
,10min后体系达到平衡,此时 的转化率为20%,
的转化率为20%, 的选择性为50%。已知:
的选择性为50%。已知: 的选择性
的选择性
①用 表示0~10min内平均反应速率
表示0~10min内平均反应速率
_______ 。
②反应ⅰ的平衡常数
_______ 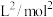 (写出计算式即可)。
(写出计算式即可)。
 作为未来的重要碳源,其选择性加氢合成
作为未来的重要碳源,其选择性加氢合成 一直是研究热点,在
一直是研究热点,在 加氢合成
加氢合成 的体系中,同时发生以下反应:
的体系中,同时发生以下反应:反应i:
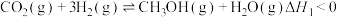
反应ii:
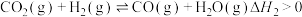
(1)若实验测得反应ⅰ:
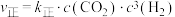 ,
,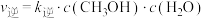 (其中
(其中 、
、 为速率常数。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为:
为速率常数。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为: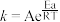 ,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,
,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(2)在
 加氢合成
加氢合成 的体系中,下列说法错误的是_______(填标号)。
的体系中,下列说法错误的是_______(填标号)。A.增大 浓度有利于提高 浓度有利于提高 的转化率 的转化率 |
| B.若升高温度,反应ⅰ的正反应速率减小:反应ⅱ的正反应速率增大 |
| C.体系达平衡后,若压缩体积,则反应ⅰ平衡正向移动,反应ⅱ平衡不移动 |
D.选用合适的催化剂可以提高 在单位时间内的产量 在单位时间内的产量 |
 和10mol
和10mol ,10min后体系达到平衡,此时
,10min后体系达到平衡,此时 的转化率为20%,
的转化率为20%, 的选择性为50%。已知:
的选择性为50%。已知: 的选择性
的选择性
①用
 表示0~10min内平均反应速率
表示0~10min内平均反应速率
②反应ⅰ的平衡常数

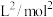 (写出计算式即可)。
(写出计算式即可)。
您最近一年使用:0次
7 . 氨是重要的化工原料,也是潜在的储氢材料。回答下列问题:
(1)氨的沸点为 ,易液化,工业上常用于做制冷剂,其易液化的主要原因是
,易液化,工业上常用于做制冷剂,其易液化的主要原因是___________ 。
(2)在液氨中制备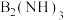 的有机反应如下:
的有机反应如下:
① ;
;
② ;
;
③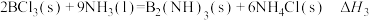 。
。
上述反应中, 、
、 、
、 之间等式关系为
之间等式关系为___________ 。
(3)氨分解制备氢气,反应历程如图所示。 的键能为
的键能为___________  。
。
②写出 分解总反应的热化学方程式:
分解总反应的热化学方程式:___________ 。
(4)化学上,把反应物消耗一半所用时间叫作“半衰期”。在恒容密闭容器中充入适量钨和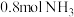 ,实验测得在钨表面氨气分解反应半衰期与温度(
,实验测得在钨表面氨气分解反应半衰期与温度( )、初始压强(
)、初始压强( )的关系如图所示。
)的关系如图所示。
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 温度下,反应进行到
温度下,反应进行到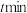 时容器内反应体系总压强为
时容器内反应体系总压强为___________  。
。
(5)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,合成氨气。
,合成氨气。 的平衡体积分数与投料比
的平衡体积分数与投料比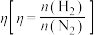 关系如图所示。
关系如图所示。 、
、 、
、 点中,
点中, 的平衡转化率最大的是
的平衡转化率最大的是___________ (填字母)。
②若 点对应体系中,
点对应体系中, 体积分数为
体积分数为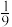 ,则该温度下,平衡常数
,则该温度下,平衡常数 为
为___________  (只列计算式)。
(只列计算式)。
(1)氨的沸点为
 ,易液化,工业上常用于做制冷剂,其易液化的主要原因是
,易液化,工业上常用于做制冷剂,其易液化的主要原因是(2)在液氨中制备
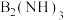 的有机反应如下:
的有机反应如下:①
 ;
;②
 ;
;③
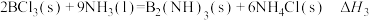 。
。上述反应中,
 、
、 、
、 之间等式关系为
之间等式关系为(3)氨分解制备氢气,反应历程如图所示。

 的键能为
的键能为 。
。②写出
 分解总反应的热化学方程式:
分解总反应的热化学方程式:(4)化学上,把反应物消耗一半所用时间叫作“半衰期”。在恒容密闭容器中充入适量钨和
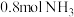 ,实验测得在钨表面氨气分解反应半衰期与温度(
,实验测得在钨表面氨气分解反应半衰期与温度( )、初始压强(
)、初始压强( )的关系如图所示。
)的关系如图所示。

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 温度下,反应进行到
温度下,反应进行到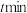 时容器内反应体系总压强为
时容器内反应体系总压强为 。
。(5)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,合成氨气。
,合成氨气。 的平衡体积分数与投料比
的平衡体积分数与投料比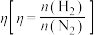 关系如图所示。
关系如图所示。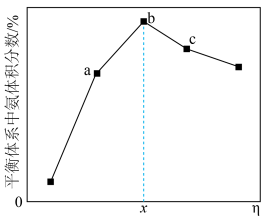
 、
、 、
、 点中,
点中, 的平衡转化率最大的是
的平衡转化率最大的是②若
 点对应体系中,
点对应体系中, 体积分数为
体积分数为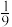 ,则该温度下,平衡常数
,则该温度下,平衡常数 为
为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
解题方法
8 .  是重要的资源,
是重要的资源, 催化重整不仅可制得
催化重整不仅可制得 ,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.

Ⅱ.

总反应:
Ⅲ.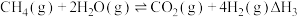
(1)反应Ⅲ的
________ ;该反应自发进行的条件是________ 。
(2)常向反应体系中通入一定比例的 ,有利于重整反应。试从能量角度分析其原因
,有利于重整反应。试从能量角度分析其原因________ ;进料中氧气量不能过大,原因是________ 。
(3)生产中向重整反应体系中加入适量多孔 ,其优点是
,其优点是________ 。
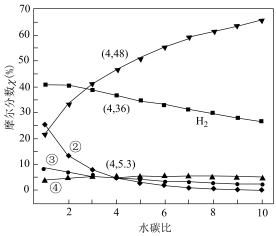
(4)在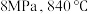 条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比
条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比 的计算结果如图所示。(物质
的计算结果如图所示。(物质 的摩尔分数
的摩尔分数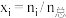 )
)________ 、________ 的变化曲线(填化学式)。
②投料水碳比为4时,反应Ⅲ的平衡常数
________ (以分压表示,分压=总压×物质的量分数)。
 是重要的资源,
是重要的资源, 催化重整不仅可制得
催化重整不仅可制得 ,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
,还对温室气体的减排具有重要意义。工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:Ⅰ.


Ⅱ.


总反应:
Ⅲ.
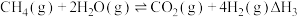
(1)反应Ⅲ的

(2)常向反应体系中通入一定比例的
 ,有利于重整反应。试从能量角度分析其原因
,有利于重整反应。试从能量角度分析其原因(3)生产中向重整反应体系中加入适量多孔
 ,其优点是
,其优点是(4)在
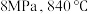 条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比
条件下,甲烷水蒸气重整反应达到平衡时体系中各组分摩尔分数与投料水碳比 的计算结果如图所示。(物质
的计算结果如图所示。(物质 的摩尔分数
的摩尔分数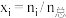 )
)
②投料水碳比为4时,反应Ⅲ的平衡常数

您最近一年使用:0次
9 . 在含Ag+、Cu2+、Hg2+的溶液中,滴加氨水,存在平衡关系:Ag++2NH3 [Ag(NH3)2]+、Cu2++4NH3
[Ag(NH3)2]+、Cu2++4NH3 [Cu(NH3)4]2+、Hg2++4NH3
[Cu(NH3)4]2+、Hg2++4NH3 [Hg(NH3)4]2+,平衡常数分别为K1、K2、K3,且K2<K3。lgx与lgc(NH3)的关系如图所示,其中
[Hg(NH3)4]2+,平衡常数分别为K1、K2、K3,且K2<K3。lgx与lgc(NH3)的关系如图所示,其中 表示
表示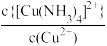 或
或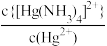 或
或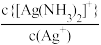 ,下列叙述正确的是
,下列叙述正确的是
 [Ag(NH3)2]+、Cu2++4NH3
[Ag(NH3)2]+、Cu2++4NH3 [Cu(NH3)4]2+、Hg2++4NH3
[Cu(NH3)4]2+、Hg2++4NH3 [Hg(NH3)4]2+,平衡常数分别为K1、K2、K3,且K2<K3。lgx与lgc(NH3)的关系如图所示,其中
[Hg(NH3)4]2+,平衡常数分别为K1、K2、K3,且K2<K3。lgx与lgc(NH3)的关系如图所示,其中 表示
表示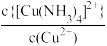 或
或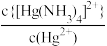 或
或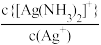 ,下列叙述正确的是
,下列叙述正确的是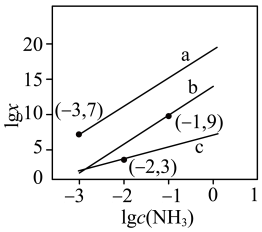
A.直线a代表lg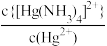 与lgc(NH3)的关系 与lgc(NH3)的关系 |
| B.根据图像可计算平衡常数K2=1.0×1019 |
| C.向含相同浓度的Cu2+和Hg2+的混合溶液中滴加少量氨水,[Cu(NH3)4]2+的浓度大于[Hg(NH3)4]2+ |
D.[Hg(NH3)4]2++Cu2+ [Cu(NH3)4]2++Hg2+的平衡常数K=1.0×10-6 [Cu(NH3)4]2++Hg2+的平衡常数K=1.0×10-6 |
您最近一年使用:0次
2024-03-21更新
|
549次组卷
|
2卷引用:吉林省长春市东北师范大学附属中学2024届高三下学期第五次模拟考试化学试题
名校
10 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:N2(g)+3H2(g)⇌2NH3(g) ∆H=-92.4kJ·mol-1 ∆S=-200J·K-1·mol-1。回答下列问题:
(1)合成氨反应在常温下_______ (填“能”或“不能”)自发。
(2)_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二: 复合催化剂。
复合催化剂。

下列说法正确的是_______ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: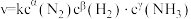 ,根据表中数据,
,根据表中数据,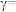
_______ ;
在合成氨过程中,需要不断分离出氨的原因为_______ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)在初始压强为20MPa、450℃、容积恒定、催化剂条件下发生合成氨反应,按物质的量比值n(N2):n(H2)=1:3充入反应物,氢气的平衡转化率为60%,则Kp=_______ (保留三位小数)。
(1)合成氨反应在常温下
(2)
 。
。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二:
 复合催化剂。
复合催化剂。
下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
 ,根据表中数据,
,根据表中数据,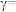
| 实验 | 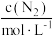 | 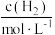 |  | 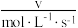 |
| 1 | m | n | p | q |
| 2 | 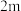 | n | p |  |
| 3 | m | n |  | 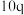 |
| 4 | m |  | p | 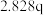 |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)在初始压强为20MPa、450℃、容积恒定、催化剂条件下发生合成氨反应,按物质的量比值n(N2):n(H2)=1:3充入反应物,氢气的平衡转化率为60%,则Kp=
您最近一年使用:0次



