解题方法
1 . 工业上,可以用 处理烟气中
处理烟气中 、
、 ,总反应式为
,总反应式为 .已知:有关反应的能量变化曲线如图所示。
.已知:有关反应的能量变化曲线如图所示。 和
和 反应的热化学方程式:
反应的热化学方程式:________________ 。上述总反应中
________  。
。
(2)其他条件不变,增大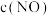 ,对总反应速率几乎没有影响,其原因可能是
,对总反应速率几乎没有影响,其原因可能是________________ 。
(3)一定条件下, 速率方程为
速率方程为 (k为速率常数,只与温度有关)。阿仑尼乌斯经验公式:
(k为速率常数,只与温度有关)。阿仑尼乌斯经验公式: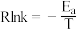 (R为常数,
(R为常数, 为活化能,不随温度改变;T为温度)。
为活化能,不随温度改变;T为温度)。 和
和 反应在不同催化剂Cat1、Cat2作用下,
反应在不同催化剂Cat1、Cat2作用下, 与
与 的关系如图所示。
的关系如图所示。________ (填“Cat1”或“Cat2”),判断依据是________________ 。
(4)在恒容密闭容器中保持总物质的量不变,充入NO和 。NO平衡转化率与温度(T)、投料比
。NO平衡转化率与温度(T)、投料比 关系如图所示。
关系如图所示。
________  (填“
(填“ ”“
”“ ”或“
”或“ ”);平衡常数
”);平衡常数 、
、 和
和 由大到小排序为
由大到小排序为________________ 。
②已知: ,
, 温度下该反应的平衡常数
温度下该反应的平衡常数
________________ 。( 为用分压表示的平衡常数,分压
为用分压表示的平衡常数,分压 总压
总压 物质的量分数)
物质的量分数)
(5)在恒容密闭容器中充入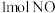 和
和 ,发生反应,测得部分物质的平衡浓度变化如图所示。M点对应的反应体系中
,发生反应,测得部分物质的平衡浓度变化如图所示。M点对应的反应体系中 体积分数为
体积分数为________________ 。
 处理烟气中
处理烟气中 、
、 ,总反应式为
,总反应式为 .已知:有关反应的能量变化曲线如图所示。
.已知:有关反应的能量变化曲线如图所示。
 和
和 反应的热化学方程式:
反应的热化学方程式:
 。
。(2)其他条件不变,增大
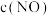 ,对总反应速率几乎没有影响,其原因可能是
,对总反应速率几乎没有影响,其原因可能是(3)一定条件下,
 速率方程为
速率方程为 (k为速率常数,只与温度有关)。阿仑尼乌斯经验公式:
(k为速率常数,只与温度有关)。阿仑尼乌斯经验公式: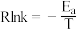 (R为常数,
(R为常数, 为活化能,不随温度改变;T为温度)。
为活化能,不随温度改变;T为温度)。 和
和 反应在不同催化剂Cat1、Cat2作用下,
反应在不同催化剂Cat1、Cat2作用下, 与
与 的关系如图所示。
的关系如图所示。
(4)在恒容密闭容器中保持总物质的量不变,充入NO和
 。NO平衡转化率与温度(T)、投料比
。NO平衡转化率与温度(T)、投料比 关系如图所示。
关系如图所示。

 (填“
(填“ ”“
”“ ”或“
”或“ ”);平衡常数
”);平衡常数 、
、 和
和 由大到小排序为
由大到小排序为②已知:
 ,
, 温度下该反应的平衡常数
温度下该反应的平衡常数
 为用分压表示的平衡常数,分压
为用分压表示的平衡常数,分压 总压
总压 物质的量分数)
物质的量分数)(5)在恒容密闭容器中充入
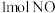 和
和 ,发生反应,测得部分物质的平衡浓度变化如图所示。M点对应的反应体系中
,发生反应,测得部分物质的平衡浓度变化如图所示。M点对应的反应体系中 体积分数为
体积分数为
您最近一年使用:0次
2 .  是常见的环境污染性气体。一定温度下,向三个容积不等的恒容密闭容器中分别投入1 mol
是常见的环境污染性气体。一定温度下,向三个容积不等的恒容密闭容器中分别投入1 mol  ,用足量活性炭还原
,用足量活性炭还原 的反应为
的反应为 。反应相同时间后,三个容器中
。反应相同时间后,三个容器中 的物质的量(n)如图中A、B、C三点所示。下列叙述不正确的是
的物质的量(n)如图中A、B、C三点所示。下列叙述不正确的是
 是常见的环境污染性气体。一定温度下,向三个容积不等的恒容密闭容器中分别投入1 mol
是常见的环境污染性气体。一定温度下,向三个容积不等的恒容密闭容器中分别投入1 mol  ,用足量活性炭还原
,用足量活性炭还原 的反应为
的反应为 。反应相同时间后,三个容器中
。反应相同时间后,三个容器中 的物质的量(n)如图中A、B、C三点所示。下列叙述不正确的是
的物质的量(n)如图中A、B、C三点所示。下列叙述不正确的是
| A.A点达到平衡, B、C点均未达到平衡 |
B.若B点达到平衡时,在该温度下的平衡常数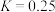 |
C.若C点使用催化剂,能提高 的转化率 的转化率 |
D.C点时,瞬间压缩容器体积至1 L后, 的物质的量增大 的物质的量增大 |
您最近一年使用:0次
7日内更新
|
24次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
3 . 向体积均为1L的两恒容容器中分别充入2mol X和1mol Y发生反应: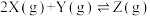
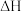 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
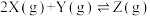
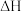 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A.反应速率: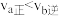 | B.气体的总物质的量: |
C.a点平衡常数: | D.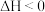 |
您最近一年使用:0次
名校
解题方法
4 . 将 转化为
转化为 的途径有如下两种:
的途径有如下两种:
反应I:无 时,
时,
反应Ⅱ:有 时,
时,
向 密闭容器甲中投入
密闭容器甲中投入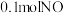 ,向
,向 密闭容器乙中投入
密闭容器乙中投入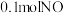 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化情况如图所示。
的转化率随温度的变化情况如图所示。
 转化为
转化为 的途径有如下两种:
的途径有如下两种:反应I:无
 时,
时,
反应Ⅱ:有
 时,
时,
向
 密闭容器甲中投入
密闭容器甲中投入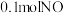 ,向
,向 密闭容器乙中投入
密闭容器乙中投入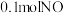 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化情况如图所示。
的转化率随温度的变化情况如图所示。
A.两个反应的 均大于0 均大于0 |
| B.X点时两个容器中的正反应速率相同 |
C.容器甲中的反应达到平衡后,再投入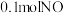 ,则 ,则 的平衡转化率增大 的平衡转化率增大 |
D.图中Y点对应的平衡常数 |
您最近一年使用:0次
2024-05-31更新
|
224次组卷
|
4卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
5 . 汽车尾气净化反应为: 、
、 。向
。向 密闭容器中充入
密闭容器中充入
 、
、 ,测得
,测得 和
和 的物质的量浓度与时间关系如图所示。下列说法正确的是
的物质的量浓度与时间关系如图所示。下列说法正确的是
 、
、 。向
。向 密闭容器中充入
密闭容器中充入
 、
、 ,测得
,测得 和
和 的物质的量浓度与时间关系如图所示。下列说法正确的是
的物质的量浓度与时间关系如图所示。下列说法正确的是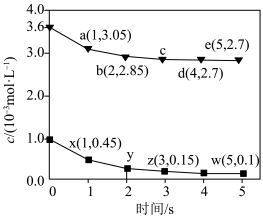
A.当体系中 和 和 浓度比不变时达到平衡状态 浓度比不变时达到平衡状态 |
B. 段反应速率 段反应速率 |
| C.上述正反应在任何温度下都能自发进行 |
D.该温度下,上述反应的逆反应平衡常数 |
您最近一年使用:0次
6 . 羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害,工业上用于合成除草剂、杀草丹、燕麦敌、杀虫剂巴丹等。其结构与 类似。工业上一般通过
类似。工业上一般通过 或者CO与
或者CO与 反应制取COS,发生的相关反应如下:
反应制取COS,发生的相关反应如下:
i.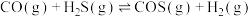
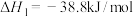
ii.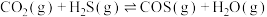
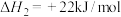
iii.

(1)
_______ 。
(2)COS的中心原子的杂化方式为_______ 。
(3)在一定温度下,将4molCO和 通入一固定容积的密闭容器中发生上述反应i。
通入一固定容积的密闭容器中发生上述反应i。
①能证明上述反应达到平衡的标志是_______ (填字母)。
A.CO和 的转化率相等 B.
的转化率相等 B. 的体积分数不再变化
的体积分数不再变化
C.混合气体的密度不再变化 D.CO、 、COS、
、COS、 浓度之比为1:1:1:1
浓度之比为1:1:1:1
②上述反应达到平衡后,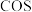 所占的体积分数为12.5%,则该反应的平衡常数为
所占的体积分数为12.5%,则该反应的平衡常数为_______ (保留两位有效数字)。若此时再向体系中加入0.5molCO和 ,平衡将
,平衡将_______ (填“向正反应方向”“向逆反应方向”或“不”)移动;理由是_______ 。
(4)将4molCO和 通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点
通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点_______ (填“是”或“不是”)平衡状态,判断的理由是_______ 。 、1molCO和
、1molCO和 通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、
通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、 和
和 平衡时的转化率如图所示,
平衡时的转化率如图所示, 转化率先减小后增大的原因是
转化率先减小后增大的原因是_______ 。
 类似。工业上一般通过
类似。工业上一般通过 或者CO与
或者CO与 反应制取COS,发生的相关反应如下:
反应制取COS,发生的相关反应如下:i.
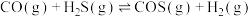
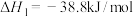
ii.
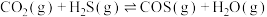
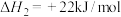
iii.


(1)

(2)COS的中心原子的杂化方式为
(3)在一定温度下,将4molCO和
 通入一固定容积的密闭容器中发生上述反应i。
通入一固定容积的密闭容器中发生上述反应i。①能证明上述反应达到平衡的标志是
A.CO和
 的转化率相等 B.
的转化率相等 B. 的体积分数不再变化
的体积分数不再变化C.混合气体的密度不再变化 D.CO、
 、COS、
、COS、 浓度之比为1:1:1:1
浓度之比为1:1:1:1②上述反应达到平衡后,
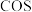 所占的体积分数为12.5%,则该反应的平衡常数为
所占的体积分数为12.5%,则该反应的平衡常数为 ,平衡将
,平衡将(4)将4molCO和
 通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点
通入一固定容积的密闭容器中发生上述反应i,反应5分钟,CO的转化率随温度的变化关系如图所示。a点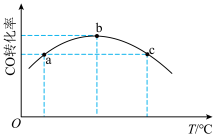
 、1molCO和
、1molCO和 通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、
通入一固定容积的密闭容器中发生上述反应i、ii和iii,CO、 和
和 平衡时的转化率如图所示,
平衡时的转化率如图所示, 转化率先减小后增大的原因是
转化率先减小后增大的原因是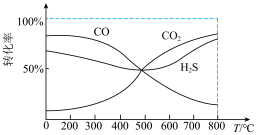
您最近一年使用:0次
名校
解题方法
7 . 深入研究碳、氮元素的物质转化有着重要的实际意义,汽车尾气净化装置中CO和NO发生如下反应:
i.
 ,
,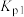
ii.
 ,
,
iii.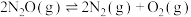
 ,
,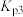
回答下列问题:
(1)上述反应的 的线性关系如图所示(
的线性关系如图所示( )。
)。
_______ (填“>”或“<”)0,反应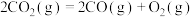 的
的
_______ (用 、
、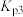 表示)。
表示)。 ,初始总压强为
,初始总压强为 ,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的
,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的 ,
, ,
, ,
, 分别为正、逆反应速率常数。充分反应达平衡时总压强为
分别为正、逆反应速率常数。充分反应达平衡时总压强为 ,
, 的物质的量为1.25mol,则
的物质的量为1.25mol,则
_______ 。
(3)CO和NO发生上述三个反应,在不同条件下达到平衡时,在 K时NO的转化率与
K时NO的转化率与 的变化曲线及
的变化曲线及 时NO的转化率与T的变化曲线如图所示。
时NO的转化率与T的变化曲线如图所示。 时NO的转化率与T的变化曲线为
时NO的转化率与T的变化曲线为_______ 曲线(填“Ⅰ”或“Ⅱ”),A点后NO的平衡转化率增大的原因是_______ 。
(4)CO、NO均能够与血红蛋白(Hb)中 形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:
形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡: 。
。
①从化学平衡角度简述CO的中毒原理:_______ 。
②已知反应
 实验表明,人体内HbCO与
实验表明,人体内HbCO与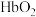 的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与
的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与 的体积比大于
的体积比大于_______ 即达到智力受损的程度。
i.

 ,
,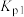
ii.

 ,
,
iii.
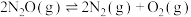
 ,
,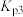
回答下列问题:
(1)上述反应的
 的线性关系如图所示(
的线性关系如图所示( )。
)。
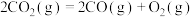 的
的
 、
、 表示)。
表示)。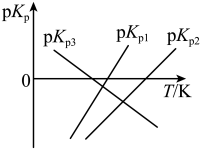
 ,初始总压强为
,初始总压强为 ,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的
,仅发生以上反应ⅰ、ⅱ,且反应ⅰ的 ,
, ,
, ,
, 分别为正、逆反应速率常数。充分反应达平衡时总压强为
分别为正、逆反应速率常数。充分反应达平衡时总压强为 ,
, 的物质的量为1.25mol,则
的物质的量为1.25mol,则
(3)CO和NO发生上述三个反应,在不同条件下达到平衡时,在
 K时NO的转化率与
K时NO的转化率与 的变化曲线及
的变化曲线及 时NO的转化率与T的变化曲线如图所示。
时NO的转化率与T的变化曲线如图所示。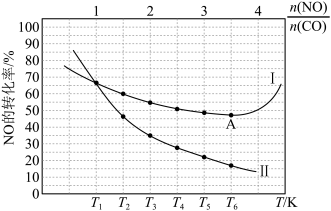
 时NO的转化率与T的变化曲线为
时NO的转化率与T的变化曲线为(4)CO、NO均能够与血红蛋白(Hb)中
 形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:
形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡: 。
。①从化学平衡角度简述CO的中毒原理:
②已知反应

 实验表明,人体内HbCO与
实验表明,人体内HbCO与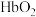 的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与
的浓度之比为1∶50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与 的体积比大于
的体积比大于
您最近一年使用:0次
解题方法
8 . 利用测压法在恒容反应器中研究25℃时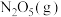 分解反应:
分解反应: 二聚为
二聚为 的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示:
的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示:
已知:① 时,
时,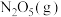 完全分解;②
完全分解;②
 ;③
;③ 为红棕色气体。下列说法错误的是
为红棕色气体。下列说法错误的是
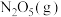 分解反应:
分解反应: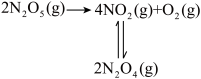
 二聚为
二聚为 的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示:
的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示:| t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 |  |
| p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
 时,
时,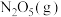 完全分解;②
完全分解;②
 ;③
;③ 为红棕色气体。下列说法错误的是
为红棕色气体。下列说法错误的是A.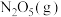 完全分解后, 完全分解后, |
B.若升高温度到35℃,则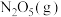 完全分解后体系压强 完全分解后体系压强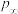 (35℃)大于63.1kPa (35℃)大于63.1kPa |
| C.若缩小起始时容器的体积,反应达到平衡后颜色将变浅 |
D.25℃时,反应达到平衡后,反应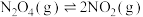 的平衡常数 的平衡常数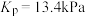 |
您最近一年使用:0次
9 . 探究对氯苯甲酸(HA)在苯—水体系中的溶解状况。
已知:常温下,HA在水(W)和苯(B)两相间的分配系数: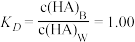 (只与温度有关)
(只与温度有关)
在水中,HA H++A- ΔH>0,其Ka(HA)=1.00×10-4mol·L-1
H++A- ΔH>0,其Ka(HA)=1.00×10-4mol·L-1
在苯中,HA只发生二聚:2HA (HA)2
(HA)2
实验测得:水中c(A-)=5.00×10-4mol·L-1时,苯中的c[(HA)2]=7.05×10-4mol·L-1
下列有关说法错误的是
已知:常温下,HA在水(W)和苯(B)两相间的分配系数:
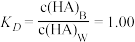 (只与温度有关)
(只与温度有关)在水中,HA
 H++A- ΔH>0,其Ka(HA)=1.00×10-4mol·L-1
H++A- ΔH>0,其Ka(HA)=1.00×10-4mol·L-1在苯中,HA只发生二聚:2HA
 (HA)2
(HA)2实验测得:水中c(A-)=5.00×10-4mol·L-1时,苯中的c[(HA)2]=7.05×10-4mol·L-1
下列有关说法错误的是
| A.水溶液的pH=3.3(lg5≈0.7) |
| B.若向萃取体系中滴入少量浓盐酸,则苯中c[(HA)2]将减少 |
| C.在苯中二聚反应的平衡常数K=1.13×102mol-1·L(结果保留三位有效数字) |
| D.HA在苯中发生二聚的原因是在苯中,羧酸与羧酸之间易形成分子内氢键 |
您最近一年使用:0次
名校
10 . 乙酸俗称醋酸,是一种重要的化工原料。
(1)1968年,Monsanto以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸,反应历程如下图所示:_____ 。
②已知B为六配位离子,画出B的结构示意图_____ 。
③根据反应④,写出E生成CH3COOH的化学方程式_____ 。
(2)乙酸在催化剂的作用下和氢气反应可生成乙醇,反应体系主要发生如下反应:
Ⅰ.CH3COOH(g)+2H2(g) C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
Ⅱ.CH3COOH(g)+C2H5OH(g) CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
Ⅲ.CH3COOH(g)+H2(g) CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
在200kPa反应条件下,将n(H2)∶n(CH3COOH)=10∶1的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性S随温度变化如下图所示。
已知: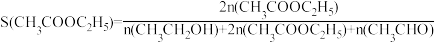
①CH3CHO(g)+H2(g) C2H5OH(g)的ΔH=
C2H5OH(g)的ΔH=_____ kJ·mol-1。
②图中表示乙酸的转化率随温度变化的曲线是_____ 。当温度低于340℃时,随着温度的升高,CH3COOC2H5选择性变大的原因是_____ 。_____ (任写一条)。
④恒温恒压条件下,向初始体积为1L的体积可变密闭容器中通入2molH2和1molCH3COOH,发生上述反应,达到平衡时容器的体积变为0.8L,S(CH3COOC2H5)=S(CH3CHO),n(H2)=0.7mol。反应Ⅱ的平衡常数K=_____ (保留2位小数)。
(1)1968年,Monsanto以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸,反应历程如下图所示:

②已知B为六配位离子,画出B的结构示意图
③根据反应④,写出E生成CH3COOH的化学方程式
(2)乙酸在催化剂的作用下和氢气反应可生成乙醇,反应体系主要发生如下反应:
Ⅰ.CH3COOH(g)+2H2(g)
 C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1Ⅱ.CH3COOH(g)+C2H5OH(g)
 CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1Ⅲ.CH3COOH(g)+H2(g)
 CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1在200kPa反应条件下,将n(H2)∶n(CH3COOH)=10∶1的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性S随温度变化如下图所示。
已知:
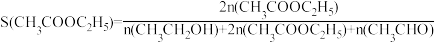
①CH3CHO(g)+H2(g)
 C2H5OH(g)的ΔH=
C2H5OH(g)的ΔH=②图中表示乙酸的转化率随温度变化的曲线是

④恒温恒压条件下,向初始体积为1L的体积可变密闭容器中通入2molH2和1molCH3COOH,发生上述反应,达到平衡时容器的体积变为0.8L,S(CH3COOC2H5)=S(CH3CHO),n(H2)=0.7mol。反应Ⅱ的平衡常数K=
您最近一年使用:0次
2024-05-23更新
|
108次组卷
|
2卷引用:湖南省永州市2024届高三下学期第三次模拟考试化学试卷



