名校
1 . 利用介孔限域催化温室气体 加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:
加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:
i.
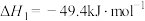
ii.

(1)稳定单质的焓(H)为0,有关物质的焓如表所示,

___________  。
。
(2)在5.0MPa下,将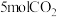 和
和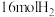 在
在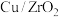 催化剂作用下进行反应i和ii.平衡时
催化剂作用下进行反应i和ii.平衡时 和CO选择性S[S(
和CO选择性S[S( 或CO)
或CO)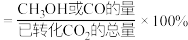 ]及
]及 的转化率a随温度的变化如图所示。
的转化率a随温度的变化如图所示。 的转化率的曲线是
的转化率的曲线是___________ (填“x”“y”或“z”)。
②250℃时,平衡体系共有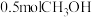 ,则
,则 的平衡转化率=
的平衡转化率=___________ ,反应i的
___________ (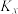 是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)。
是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)。
③p、q两点反应i的正反应速率大小:
___________ 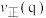 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(3)若只发生反应ii,反应的速率方程为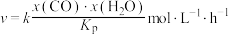 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后 ,此时反应ii的速率
,此时反应ii的速率
___________  (用含k的代数式表示)。
(用含k的代数式表示)。
(4)我国科学者又进一步研究了在 催化剂上
催化剂上 加氢制甲醇的机理;其主反应历程如图所示
加氢制甲醇的机理;其主反应历程如图所示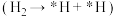 。下列说法正确的是___________(填字母)。
。下列说法正确的是___________(填字母)。
 加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:
加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:i.

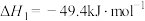
ii.


(1)稳定单质的焓(H)为0,有关物质的焓如表所示,
| 物质 |  |  |  |
焓 | -394 | -111 | -242 |

 。
。(2)在5.0MPa下,将
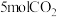 和
和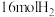 在
在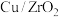 催化剂作用下进行反应i和ii.平衡时
催化剂作用下进行反应i和ii.平衡时 和CO选择性S[S(
和CO选择性S[S( 或CO)
或CO)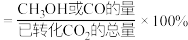 ]及
]及 的转化率a随温度的变化如图所示。
的转化率a随温度的变化如图所示。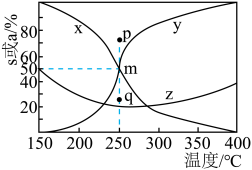
 的转化率的曲线是
的转化率的曲线是②250℃时,平衡体系共有
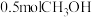 ,则
,则 的平衡转化率=
的平衡转化率=
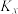 是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)。
是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)。③p、q两点反应i的正反应速率大小:

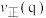 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(3)若只发生反应ii,反应的速率方程为
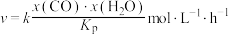 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后 ,此时反应ii的速率
,此时反应ii的速率
 (用含k的代数式表示)。
(用含k的代数式表示)。(4)我国科学者又进一步研究了在
 催化剂上
催化剂上 加氢制甲醇的机理;其主反应历程如图所示
加氢制甲醇的机理;其主反应历程如图所示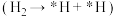 。下列说法正确的是___________(填字母)。
。下列说法正确的是___________(填字母)。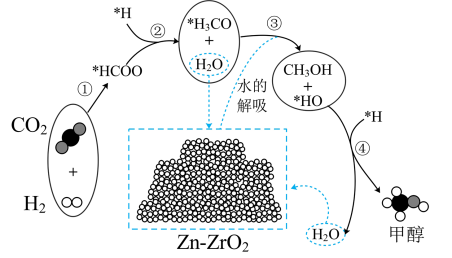
| A.二氧化碳加氢制甲醇的过程中原子利用率达100% |
| B.带*标记的物质是该反应历程中的中间产物 |
C.第④步的反应式为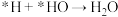 |
D.反应历程中只有 键断裂,没有 键断裂,没有 键断裂 键断裂 |
您最近一年使用:0次
昨日更新
|
240次组卷
|
4卷引用:辽宁省协作校2023-2024学年高三下学期三模化学试题
2 . 将CO2转化为有机碳酸酯CH3OCOOCH3(g)(DMC),可有效减少碳排放。CO2转化为DMC的总反应为3CO2(g)+6H2(g) CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:
CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) K1。
CH3OH(g)+H2O(g) K1。
Ⅱ.CO2(g)+2CH3OH(g) CH3OCOOCH3(g)+H2O(g) K2。
CH3OCOOCH3(g)+H2O(g) K2。
请回答下列问题:
(1)CH3OCOOCH3的名称为_______ ,1molCH3OH中含有的σ键类型为_______ 。
(2)反应的反应机理如图所示。_______ ,该物质还有另一个作用是提高DMC的平衡产率,结合反应机理图分析其中的原因:_______ 。
(3)一定温度范围内lgK-T的线性关系如图。_______ (填“>”或“<”)E逆。
②K总=K2时,该温度下K1=_______ 。某温度下,在5L恒容密闭容器中充入5molCO2和10molH2,发生反应Ⅰ、Ⅱ,反应经10min达到平衡,此时n(CH3OCOOCH3)=1mol,n(CH3OH)=1mol,则K2=_______ 。
 CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:
CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) K1。
CH3OH(g)+H2O(g) K1。Ⅱ.CO2(g)+2CH3OH(g)
 CH3OCOOCH3(g)+H2O(g) K2。
CH3OCOOCH3(g)+H2O(g) K2。请回答下列问题:
(1)CH3OCOOCH3的名称为
(2)反应的反应机理如图所示。
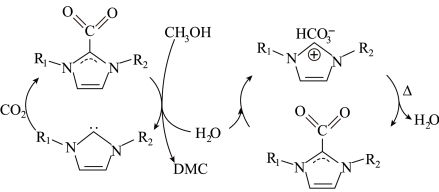
(3)一定温度范围内lgK-T的线性关系如图。
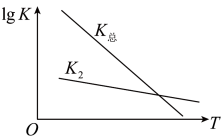
②K总=K2时,该温度下K1=
您最近一年使用:0次
名校
3 . 常温下,向 和
和 的混合液中滴加氨水,混合液中
的混合液中滴加氨水,混合液中 与
与 关系如图所示。
关系如图所示。
 和
和 的混合液中滴加氨水,混合液中
的混合液中滴加氨水,混合液中 与
与 关系如图所示。
关系如图所示。
A. 代表 代表 与 与 关系 关系 |
B. 溶液中: 溶液中: |
C.常温下, |
D. 的平衡常数 的平衡常数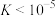 |
您最近一年使用:0次
2024-06-01更新
|
77次组卷
|
2卷引用:2024年辽宁省锦州市渤海大学附属高级中学模拟化学试题
名校
解题方法
4 . 将 转化为
转化为 的途径有如下两种:
的途径有如下两种:
反应I:无 时,
时,
反应Ⅱ:有 时,
时,
向 密闭容器甲中投入
密闭容器甲中投入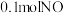 ,向
,向 密闭容器乙中投入
密闭容器乙中投入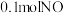 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化情况如图所示。
的转化率随温度的变化情况如图所示。
 转化为
转化为 的途径有如下两种:
的途径有如下两种:反应I:无
 时,
时,
反应Ⅱ:有
 时,
时,
向
 密闭容器甲中投入
密闭容器甲中投入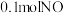 ,向
,向 密闭容器乙中投入
密闭容器乙中投入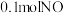 和
和 ,相同时间内测得
,相同时间内测得 的转化率随温度的变化情况如图所示。
的转化率随温度的变化情况如图所示。
A.两个反应的 均大于0 均大于0 |
| B.X点时两个容器中的正反应速率相同 |
C.容器甲中的反应达到平衡后,再投入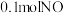 ,则 ,则 的平衡转化率增大 的平衡转化率增大 |
D.图中Y点对应的平衡常数 |
您最近一年使用:0次
2024-05-31更新
|
224次组卷
|
4卷引用:辽宁省部分高中2024届高三下学期二轮复习联考(二)化学试题
5 . 油、气发动机会产生CO和氮氧化物等污染气体,研究污染气体对环境的影响和减少污染气体的排放是重要的课题。回答下列问题:
(1)研究表明污染气体能破坏臭氧层。
已知:



①写出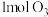 与
与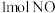 作用产生
作用产生 和
和 的热化学方程式
的热化学方程式___________ 。
②恒容密闭体系中发生①的反应,在相同时间,NO氧化率随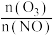 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随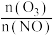 值增大而增大的主要原因是
值增大而增大的主要原因是___________ 。
 的瞬时反应速率满足以下关系式:
的瞬时反应速率满足以下关系式: ;
; ,
, 、
、 为速率常数,受温度影响。
为速率常数,受温度影响。
③温度为 时,在
时,在 的恒容密闭容器中,投入
的恒容密闭容器中,投入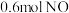 和
和 ,达到平衡时
,达到平衡时 为
为 ;当温度为
;当温度为 且该反应达到平衡时,存在
且该反应达到平衡时,存在 ,则
,则
___________  (选填“大于”、“小于”或“等于”)。
(选填“大于”、“小于”或“等于”)。
④研究发现该反应按如下步骤进行:
第一步: 快速平衡 第二步:
快速平衡 第二步: 慢反应
慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中: ;
; 。下列叙述正确的是
。下列叙述正确的是___________ 。
A.同一温度下,平衡时第一步反应的 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)目前燃油汽车的排气管内部装有三元催化器,尾气中反应物或生成物浓度随温度变化如图2、图3所示。___________ ,并说明理由___________ 。
⑥为探究温度对催化剂催化效果的影响,将固定比例NO、CO混合气体,以一定流速发生
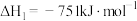 ,通过三元催化剂排气管,相同时间内测量尾气中NO的含量,得到脱氮率随温度变化如图所示,已知图中BC段为平衡状态,且平衡脱氮率为
,通过三元催化剂排气管,相同时间内测量尾气中NO的含量,得到脱氮率随温度变化如图所示,已知图中BC段为平衡状态,且平衡脱氮率为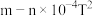 ,
, ,m、n为常数。下列说法错误的是
,m、n为常数。下列说法错误的是___________ 。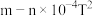 表达式中:
表达式中: ,
,
B.CD段处于平衡状态,因该反应正向放热,升温平衡逆向移动,故脱氮率降低
C.D点平衡脱氮率为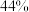
D.BA段因温度下降,催化剂活性降低,故平衡脱氮率下降
(1)研究表明污染气体能破坏臭氧层。
已知:




①写出
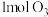 与
与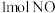 作用产生
作用产生 和
和 的热化学方程式
的热化学方程式②恒容密闭体系中发生①的反应,在相同时间,NO氧化率随
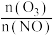 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随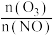 值增大而增大的主要原因是
值增大而增大的主要原因是

 的瞬时反应速率满足以下关系式:
的瞬时反应速率满足以下关系式: ;
; ,
, 、
、 为速率常数,受温度影响。
为速率常数,受温度影响。③温度为
 时,在
时,在 的恒容密闭容器中,投入
的恒容密闭容器中,投入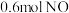 和
和 ,达到平衡时
,达到平衡时 为
为 ;当温度为
;当温度为 且该反应达到平衡时,存在
且该反应达到平衡时,存在 ,则
,则
 (选填“大于”、“小于”或“等于”)。
(选填“大于”、“小于”或“等于”)。④研究发现该反应按如下步骤进行:
第一步:
 快速平衡 第二步:
快速平衡 第二步: 慢反应
慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:
 ;
; 。下列叙述正确的是
。下列叙述正确的是A.同一温度下,平衡时第一步反应的
 越大反应正向程度越大
越大反应正向程度越大B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)目前燃油汽车的排气管内部装有三元催化器,尾气中反应物或生成物浓度随温度变化如图2、图3所示。

⑥为探究温度对催化剂催化效果的影响,将固定比例NO、CO混合气体,以一定流速发生

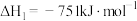 ,通过三元催化剂排气管,相同时间内测量尾气中NO的含量,得到脱氮率随温度变化如图所示,已知图中BC段为平衡状态,且平衡脱氮率为
,通过三元催化剂排气管,相同时间内测量尾气中NO的含量,得到脱氮率随温度变化如图所示,已知图中BC段为平衡状态,且平衡脱氮率为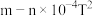 ,
, ,m、n为常数。下列说法错误的是
,m、n为常数。下列说法错误的是
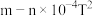 表达式中:
表达式中: ,
,
B.CD段处于平衡状态,因该反应正向放热,升温平衡逆向移动,故脱氮率降低
C.D点平衡脱氮率为
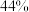
D.BA段因温度下降,催化剂活性降低,故平衡脱氮率下降
您最近一年使用:0次
2024-05-30更新
|
183次组卷
|
3卷引用:2024届辽宁省部分学校高三下学期联考三模化学试题
6 . 一定温度下,在2个容积均为1L的恒容密闭容器中,加入一定量的反应物,发生反应: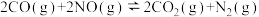 ,相关数据见下表。
,相关数据见下表。
下列说法不正确的是
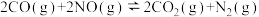 ,相关数据见下表。
,相关数据见下表。| 容器编号 | 温度/℃ | 起始物质的量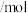 | 平衡物质的量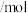 | |
 |  |  | ||
| Ⅰ |  | 0.2 | 0.2 | 0.1 |
| Ⅱ |  | 0.2 | 0.2 | 0.12 |
A.若 ;则 ;则 |
B.Ⅰ中反应达到平衡时, 的转化率为50% 的转化率为50% |
C. 条件下的平衡常数为5 条件下的平衡常数为5 |
D.对于Ⅱ,平衡后向容器中再充入0.2  和0.2 和0.2  平衡逆向移动 平衡逆向移动 |
您最近一年使用:0次
名校
7 . 氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ: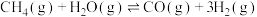
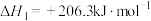
反应Ⅱ: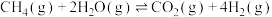

反应Ⅲ: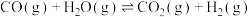
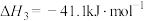
回答下列问题:
(1)反应Ⅱ能自发进行的条件是_______ 。
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比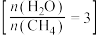 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
①下列说法不正确 的是_______ 。
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比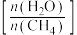 ,有利于提高H2的产率
,有利于提高H2的产率
C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=_______ (用含a,m,n的代数式表示)。
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[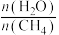 ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:_______ 。
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是_______ (用化学反应方程式表示)。
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2: ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法不正确 的是_______。
反应Ⅰ:
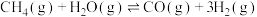
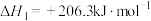
反应Ⅱ:
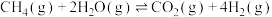

反应Ⅲ:
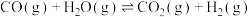
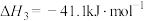
回答下列问题:
(1)反应Ⅱ能自发进行的条件是
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比
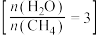 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。①下列说法
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比
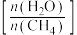 ,有利于提高H2的产率
,有利于提高H2的产率C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[
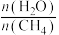 ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示: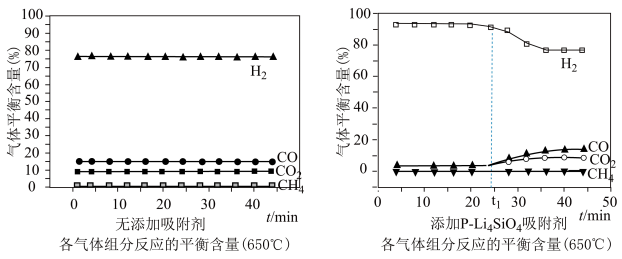
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2:
 ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法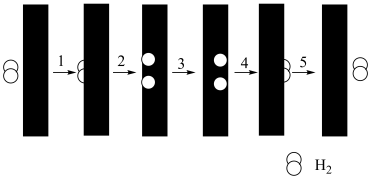
| A.钯膜对H2分子的透过具有选择性 |
B.过程4的 |
| C.采用钯膜分离技术可以提高原料的利用率 |
| D.常用N2将过程5中的H2吹扫出反应器而促进反应 |
您最近一年使用:0次
解题方法
8 . 工业尾气脱硝是减少空气污染的重要举措.回答下列问题:
(1)已知相关反应的热力学数据如下表所示:
①理论上,反应消耗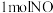 时,反应
时,反应______ (填“吸收”或“释放”)__________  的能量;
的能量;
② 时,另一脱硝反应
时,另一脱硝反应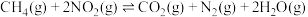 的
的
_______ ;(用含有a、b的式子表示)
(2)模拟工业尾气脱硝:一定条件下,将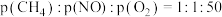 的气体与
的气体与 混合,均匀通过催化脱硝反应器,测得
混合,均匀通过催化脱硝反应器,测得 内
内 去除率与
去除率与 转化率随反应温度的变化如图所示.
转化率随反应温度的变化如图所示. 的去除率最高的原因是
的去除率最高的原因是_________________ ;
②若只考虑反应Ⅰ和Ⅲ,则温度为T时,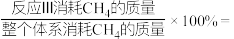
_______ ;(保留到0.1%)
③ 时,为提高反应Ⅲ中
时,为提高反应Ⅲ中 的平衡转化率,理论上能采取的措施是
的平衡转化率,理论上能采取的措施是________ ;(填选项)
A.适当降低温度 B.加入少量生石灰
C.恒容充入更多 D.使用更高效的催化剂
D.使用更高效的催化剂
(1)已知相关反应的热力学数据如下表所示:
| 反应 | 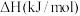 | 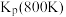 | |
| Ⅰ |  |  | |
| Ⅱ | 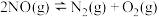 | 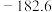 | |
| Ⅲ | 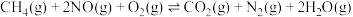 | a | |
| Ⅳ |  | b |
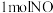 时,反应
时,反应 的能量;
的能量;②
 时,另一脱硝反应
时,另一脱硝反应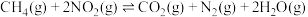 的
的
(2)模拟工业尾气脱硝:一定条件下,将
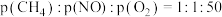 的气体与
的气体与 混合,均匀通过催化脱硝反应器,测得
混合,均匀通过催化脱硝反应器,测得 内
内 去除率与
去除率与 转化率随反应温度的变化如图所示.
转化率随反应温度的变化如图所示.
 的去除率最高的原因是
的去除率最高的原因是②若只考虑反应Ⅰ和Ⅲ,则温度为T时,
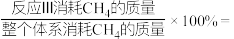
③
 时,为提高反应Ⅲ中
时,为提高反应Ⅲ中 的平衡转化率,理论上能采取的措施是
的平衡转化率,理论上能采取的措施是A.适当降低温度 B.加入少量生石灰
C.恒容充入更多
 D.使用更高效的催化剂
D.使用更高效的催化剂
您最近一年使用:0次
名校
解题方法
9 . 黄铁矿(主要成分FeS2)在空气中会被缓慢氧化,过程如图所示。下列说法正确的是

| A.发生反应a时,每0.2molFeS2被还原,转移2.8mole- |
B.25℃时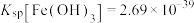 ,则该温度下d的逆反应平衡常数 ,则该温度下d的逆反应平衡常数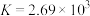 |
C.c发生反应的离子方程式为: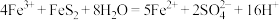 |
| D.黄铁矿是工业制备硫酸的必选原料 |
您最近一年使用:0次
2024-05-22更新
|
215次组卷
|
3卷引用: 辽宁省部分高中2023-2024学年高三下学期第三次模拟考试化学试题
辽宁省部分高中2023-2024学年高三下学期第三次模拟考试化学试题辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题(已下线)湖南师大附中2024届高三下学期第三次模拟考试化学试题
名校
解题方法
10 . 利用炼锌钴渣[主要含 、
、 、
、 和
和 、
、 单质]制备
单质]制备 和高纯
和高纯 的流程如下。
的流程如下。 时,
时,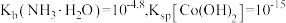
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中 发生反应的离子方程式
发生反应的离子方程式___________ 。
(2)“沉铁”过程中 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因___________ ;该过程加入 的作用为
的作用为___________ 。
(3)“沉镍”过程 对溶液中
对溶液中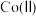 、
、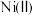 含量的影响如图。
含量的影响如图。
___________ 。
②该过程 可能发生的反应如下:
可能发生的反应如下:
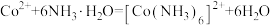
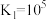


则
___________ 。
(4)“沉钴”过程生成 的离子方程式为
的离子方程式为___________ 。
(5)在电解过程中为了保持电解液成分稳定,应不断加入___________ (填化学式)。
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
 、
、 、
、 和
和 、
、 单质]制备
单质]制备 和高纯
和高纯 的流程如下。
的流程如下。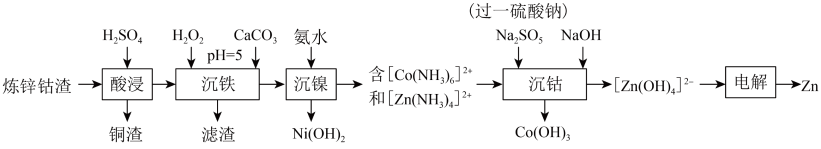
 时,
时,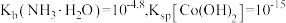
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中
 发生反应的离子方程式
发生反应的离子方程式(2)“沉铁”过程中
 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因 的作用为
的作用为(3)“沉镍”过程
 对溶液中
对溶液中 、
、 含量的影响如图。
含量的影响如图。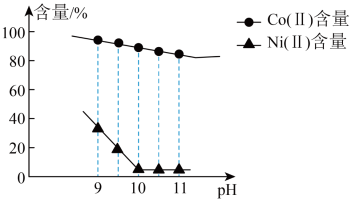

②该过程
 可能发生的反应如下:
可能发生的反应如下: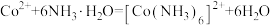
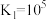


则

(4)“沉钴”过程生成
 的离子方程式为
的离子方程式为(5)在电解过程中为了保持电解液成分稳定,应不断加入
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. | C. | D. |
您最近一年使用:0次



