名校
1 . 汽车尾气中含有氮氧化物、CO等多种污染物,已成为城市空气的主要污染源。请回答下列关于氮氧化物的问题:
I.汽车尾气中NO产生的反应为 。一定条件下,等物质的量的
。一定条件下,等物质的量的 、
、 在恒容密闭容器中反应,
在恒容密闭容器中反应, 的浓度变化如图所示:
的浓度变化如图所示:

(1)此反应物的总能量__________ (填“大于”“小于”或“等于”)生成物的总能最。
(2) 温度下反应,NO的体积分数的最大值为
温度下反应,NO的体积分数的最大值为__________ 。
(3) 温度下,随着反应的进行,混合气体的平均相对分子质量如何变化?
温度下,随着反应的进行,混合气体的平均相对分子质量如何变化?__________ (填“增大”“减小”或“不变”)。
(4) 温度下,如果
温度下,如果 、
、 的起始浓度分别为
的起始浓度分别为 、
、 ,某时刻
,某时刻 的转化率为50%时,反应是否平衡?
的转化率为50%时,反应是否平衡?__________ (填“是”或“否”)。如果末平衡,则反应会__________ (填“正向”或“逆向”)进行。
II. 、CO也可反应,主要基元反应如下:
、CO也可反应,主要基元反应如下:
①

②

(5)写出总反应的热化学方程式:__________ 。
(6)反应过程中的能量变化如图,正反应的活化能__________ (填“大于”或“小于”)逆反应的活化能。

(7)表示反应体系中加入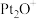 的是曲线
的是曲线______ (填“a”或“b”)。
III.NO、CO也能在催化条件下进行反应: ,已知该反应的
,已知该反应的 。
。
(8)该反应在一定条件下能自发进行,由此判断该反应的
__________ (填“大于”或“小于”)0。
I.汽车尾气中NO产生的反应为
 。一定条件下,等物质的量的
。一定条件下,等物质的量的 、
、 在恒容密闭容器中反应,
在恒容密闭容器中反应, 的浓度变化如图所示:
的浓度变化如图所示:
(1)此反应物的总能量
(2)
 温度下反应,NO的体积分数的最大值为
温度下反应,NO的体积分数的最大值为(3)
 温度下,随着反应的进行,混合气体的平均相对分子质量如何变化?
温度下,随着反应的进行,混合气体的平均相对分子质量如何变化?(4)
 温度下,如果
温度下,如果 、
、 的起始浓度分别为
的起始浓度分别为 、
、 ,某时刻
,某时刻 的转化率为50%时,反应是否平衡?
的转化率为50%时,反应是否平衡?II.
 、CO也可反应,主要基元反应如下:
、CO也可反应,主要基元反应如下:①


②


(5)写出总反应的热化学方程式:
(6)反应过程中的能量变化如图,正反应的活化能

(7)表示反应体系中加入
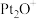 的是曲线
的是曲线III.NO、CO也能在催化条件下进行反应:
 ,已知该反应的
,已知该反应的 。
。(8)该反应在一定条件下能自发进行,由此判断该反应的

您最近一年使用:0次
名校
解题方法
2 . 某1L恒容密闭容器中, 、
、 的起始浓度分别为
的起始浓度分别为 和
和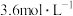 ,二者反应生成
,二者反应生成 和
和 ,该反应的部分物质的浓度随时间变化的关系如图所示(部分时间段的浓度变化未标出)。下列有关判断正确的是
,该反应的部分物质的浓度随时间变化的关系如图所示(部分时间段的浓度变化未标出)。下列有关判断正确的是
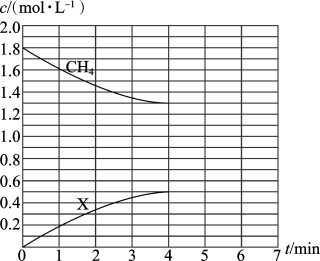
 、
、 的起始浓度分别为
的起始浓度分别为 和
和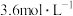 ,二者反应生成
,二者反应生成 和
和 ,该反应的部分物质的浓度随时间变化的关系如图所示(部分时间段的浓度变化未标出)。下列有关判断正确的是
,该反应的部分物质的浓度随时间变化的关系如图所示(部分时间段的浓度变化未标出)。下列有关判断正确的是
| A.增大压强,平衡正向移动 |
| B.平衡常数约为0.91 |
C.若5min时向容器中再加入 和 和 ,则平衡正向移动 ,则平衡正向移动 |
D.X是 |
您最近一年使用:0次
名校
3 . 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应: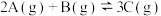 ,若经2s后平衡,测得C的体积分数为50%,现有下列几种说法:
,若经2s后平衡,测得C的体积分数为50%,现有下列几种说法:
①2s内,用A表示的平均速率为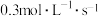
②平衡时物质A的转化率为50%
⑧平衡时物质B的浓度为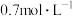
④平衡常数为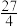
其中正确的是
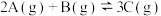 ,若经2s后平衡,测得C的体积分数为50%,现有下列几种说法:
,若经2s后平衡,测得C的体积分数为50%,现有下列几种说法:①2s内,用A表示的平均速率为
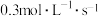
②平衡时物质A的转化率为50%
⑧平衡时物质B的浓度为
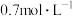
④平衡常数为
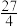
其中正确的是
| A.②④ | B.①③ | C.②③ | D.③④ |
您最近一年使用:0次
名校
解题方法
4 . 化学反应的快慢(速率)和化学反应的限度是化学反应原理的重要组成部分。请回答下列问题:
(1)在一定温度下的定容容器中,当C(s)+CO2(g) 2CO(g)不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量。能说明C(s)+CO2(g)
2CO(g)不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量。能说明C(s)+CO2(g) 2CO(g)达到平衡状态的是
2CO(g)达到平衡状态的是_____ 。
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
①该反应为_____ 反应(填“吸热”或“放热”)。
②某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为_____ 。
③若830℃时,向容器中充入1molCO、5molH2O,反应达到平衡后,其化学平衡常数K_____ 1.0(填“大于”“小于”或“等于”)。
④若1200℃时在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡移动方向为_____ (填“正反应方向”“逆反应方向”或“不移动”)。
(1)在一定温度下的定容容器中,当C(s)+CO2(g)
 2CO(g)不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量。能说明C(s)+CO2(g)
2CO(g)不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量。能说明C(s)+CO2(g) 2CO(g)达到平衡状态的是
2CO(g)达到平衡状态的是(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应为
②某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
③若830℃时,向容器中充入1molCO、5molH2O,反应达到平衡后,其化学平衡常数K
④若1200℃时在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡移动方向为
您最近一年使用:0次
2021-12-02更新
|
229次组卷
|
3卷引用:甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
5 . 完成下列填空
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。该原理不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g)。该原理不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
已知:C(s)+2H2(g)=CH4(g) △H=-75 kJ•mol-1
C(s)+O2(g)=CO2(g) △H=-394 kJ•mol-1
C(s)+ O2(g)=CO(g) △H=-111 kJ•mol-1
O2(g)=CO(g) △H=-111 kJ•mol-1
①催化重整反应的△H=___________ 。
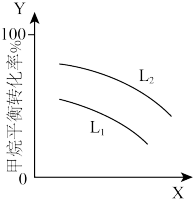
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,CH4-CO2催化重整反应中CH4(g)的平衡转化率随X的变化关系。X代表的物理量是___________ ;判断L1、L2的大小关系L1___________ L2(填“>”“<”“=”)
③某温度下,在体积为2L的容器中加入2 molCH4、1 molCO2以及催化剂进行重整反应,经过2min达到平衡状态时测得CO2的转化率是50%。其平衡常数为___________ mol2•L-2;达到平衡后,其它条件不变时向反应容器中充入CO2和CO各1mol,则化学平衡___________ 移动(填“正反应方向”、“逆反应方向”或“不”)。
(2)工业上由N2、H2来制备NH3.不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。
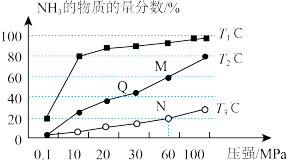
①Q点的v(正)___________ M点的v(正)(填“>”“<”或“=”)。
②工业合成氨的反应为:N2+3H2 2NH3。其化学平衡常数K和温度t的关系如下表:
2NH3。其化学平衡常数K和温度t的关系如下表:
则图中三条曲线对应的温度分别为T1、T2、T3,其中温度最低的是___________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。该原理不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g)。该原理不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:已知:C(s)+2H2(g)=CH4(g) △H=-75 kJ•mol-1
C(s)+O2(g)=CO2(g) △H=-394 kJ•mol-1
C(s)+
 O2(g)=CO(g) △H=-111 kJ•mol-1
O2(g)=CO(g) △H=-111 kJ•mol-1①催化重整反应的△H=
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,CH4-CO2催化重整反应中CH4(g)的平衡转化率随X的变化关系。X代表的物理量是

③某温度下,在体积为2L的容器中加入2 molCH4、1 molCO2以及催化剂进行重整反应,经过2min达到平衡状态时测得CO2的转化率是50%。其平衡常数为
(2)工业上由N2、H2来制备NH3.不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。

①Q点的v(正)
②工业合成氨的反应为:N2+3H2
 2NH3。其化学平衡常数K和温度t的关系如下表:
2NH3。其化学平衡常数K和温度t的关系如下表:| t/℃ | 300 | 500 | 600 | 700 | 800 |
| K | 3.6 | 2.1 | 1.6 | 1.0 | 0.8 |
则图中三条曲线对应的温度分别为T1、T2、T3,其中温度最低的是
您最近一年使用:0次
12-13高二上·江苏盐城·期末
名校
6 . 25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)  Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
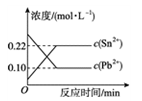
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| C.25 ℃时,该反应的平衡常数K=2.2 |
| D.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
您最近一年使用:0次
2017-11-07更新
|
480次组卷
|
47卷引用:2013届甘肃省永昌县第一中学高三上学期期中考试化学试卷
(已下线)2013届甘肃省永昌县第一中学高三上学期期中考试化学试卷(已下线)2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二第三学段考试化学试卷(已下线)2011-2012学年浙江省金华一中高二下学期期中考试化学试卷(已下线)2011-2012学年海南省海南中学高二上学期期末考试理科化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013学年福建德化三中高二上学期第二次月考理科化学试卷(已下线)2013-2014学年湖北省部分重点中学高二上学期期末考试化学试卷(已下线)2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(已下线)2013-2014福建省厦门双十中学高三热身考试化学试卷(已下线)2013-2014吉林省吉林一中高一下学期期末考试化学试卷(已下线)2015届福建省福州第八中学高三上学期第二次质量检查化学试卷2014-2015学年甘肃省武威市六中高二上学期期中化学(理)试卷2015届上海理工大学附中高三上学期月考化学试卷2015-2016湖南省衡阳四中高二12月学科联赛化学试卷2015-2016湖南省衡阳县四中高二12月学科联赛化学试卷2014-2015广东省揭阳市第一中学高二上学期期末考试化学理试卷2014-2015学年福建省晋江市平山中学高二下学期期中考试化学试卷2014-2015学年湖北省老河口市第二中学高二下学期期末化学试卷2016届河北省行唐启明中学高三上学期12月月考化学试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高二上期末化学卷2016届江西省宜春市奉新县第一中学高三上第五次月考化学试卷2015-2016学年湖南省醴陵二中、四中高二上学期期末化学试卷2016届河南省三门峡市陕州中学高三下尖子生专题训练(三)理综化学试卷2016届山西省平遥中学高三第二轮训练三化学试卷2015-2016学年内蒙古包头九中高一下期末化学试题2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年河南省师大附中高二上期中化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年辽宁省瓦房店市高级中学高二上10月月考化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题甘肃省民乐县第一中学2017-2018学年高二上学期期中考试化学试题江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题四川省眉山市眉山中学2018-2019学年高二上学期10月月考理科综合化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2【全国百强校】吉林省延边市第二中学2018-2019学年高二下学期开学考试化学试题吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题河南省南阳市2018-2019学年高二上学期期中质量评估化学试题湖南省长沙市天心区雅礼中学2018-2019学年高二下学期期末考试化学试题吉林省汪清县第六中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题湖北省咸宁市通城二中2020-2021学年度高二上学期期中考试化学试题黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题
7 . 甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是___________ (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。


(3)判断反应③△H______ 0; △S______ 0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)_____ v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________________ 。
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | ||
(1)反应②是
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)


(3)判断反应③△H
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
您最近一年使用:0次
2016-12-09更新
|
126次组卷
|
2卷引用:2015-2016学年甘肃省永昌一中高二上学期期末化学试卷



