名校
1 . 在催化下, 加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
Ⅰ.
Ⅱ.
回答下列问题。
(1)已知: 时,部分物质的相对能量如表所示,则
时,部分物质的相对能量如表所示,则 的相对能量为
的相对能量为_______  。
。
(2)为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:
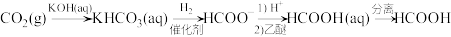
步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式:_______ 。
②其他条件不变,步骤1中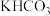 转化为
转化为 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。_______ ,后又下降的可能原因是_______ 。
③流程图步骤2中,加入乙醚的作用是_______ ,步骤3的分离方法是_______ 。
(3)保持 、恒压,
、恒压, 和
和 的投料物质的量之比为
的投料物质的量之比为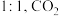 的初始分压为
的初始分压为 ,测得
,测得 的转化率
的转化率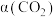 与时间t的关系如图所示。
与时间t的关系如图所示。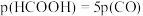 ,则反应Ⅰ的
,则反应Ⅰ的
_____ 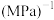 (用含
(用含 的式子表示)。
的式子表示)。
 加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。
加氢合成甲酸发生反应Ⅰ,同时还伴有反应Ⅱ发生。Ⅰ.

Ⅱ.

回答下列问题。
(1)已知:
 时,部分物质的相对能量如表所示,则
时,部分物质的相对能量如表所示,则 的相对能量为
的相对能量为 。
。| 物质 | 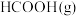 | 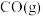 |
相对能量/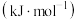 | 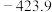 |  |
(2)为了提高二氧化碳转化为甲酸的转化率,工业上常采用以下方法:
步骤1 步骤2 步骤3
①写出步骤1反应的离子方程式:
②其他条件不变,步骤1中
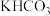 转化为
转化为 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。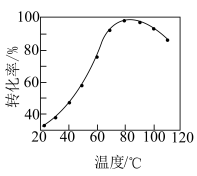
③流程图步骤2中,加入乙醚的作用是
(3)保持
 、恒压,
、恒压, 和
和 的投料物质的量之比为
的投料物质的量之比为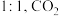 的初始分压为
的初始分压为 ,测得
,测得 的转化率
的转化率 与时间t的关系如图所示。
与时间t的关系如图所示。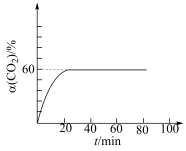
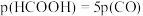 ,则反应Ⅰ的
,则反应Ⅰ的
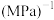 (用含
(用含 的式子表示)。
的式子表示)。
您最近一年使用:0次
2024-04-15更新
|
80次组卷
|
2卷引用:2024届甘肃省平凉市静宁县高三第四次摸底考试模拟预测化学试题
名校
解题方法
2 . “绿水青山就是金山银山”,运用化学反应原理研究碳、 氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成 甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ∆H1=-116kJ•mol-1
(1)已知:CO(g)+ O2(g)=CO2(g) ∆H2=-283kJ•mol-1
O2(g)=CO2(g) ∆H2=-283kJ•mol-1
H2(g)+ O2(g)=H2O(g) ∆H3=-242kJ•mol-1
O2(g)=H2O(g) ∆H3=-242kJ•mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________ 。
(2)下列措施中有利于增大反应:CO(g)+2H2(g) CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是___________ 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(3)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
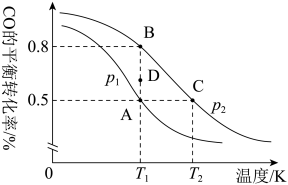
①该可逆反应的ΔH___________ 0(填“>”或“<”),A、B、C三点平衡常数KA、KB、KC的大小关系是___________ ;
②压强p1___________ p2(填“>”“<”或“=”),若p2=100kPa,则B点的Kp=___________ kPa-2(Kp为以分压表示的平衡常数;分压=总压×物质的量分数)
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:υ正___________ υ逆 (填“>”“<”或“=”)。
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为___________ ℃。
(5)800℃时,发生上述反应,某一时刻测得容器内物质的浓度分别为:CO2为2mol•L-1,H2为1.5mol•L-1,CO为1mol•L-1,H2O为3mol•L-1,则此时反应向___________ (填“正反应方向”或“逆反应方向”)进行。
I.甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成 甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ∆H1=-116kJ•mol-1
(1)已知:CO(g)+
 O2(g)=CO2(g) ∆H2=-283kJ•mol-1
O2(g)=CO2(g) ∆H2=-283kJ•mol-1H2(g)+
 O2(g)=H2O(g) ∆H3=-242kJ•mol-1
O2(g)=H2O(g) ∆H3=-242kJ•mol-1则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
(2)下列措施中有利于增大反应:CO(g)+2H2(g)
 CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(3)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
①该可逆反应的ΔH
②压强p1
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:υ正
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
(5)800℃时,发生上述反应,某一时刻测得容器内物质的浓度分别为:CO2为2mol•L-1,H2为1.5mol•L-1,CO为1mol•L-1,H2O为3mol•L-1,则此时反应向
您最近一年使用:0次
3 . 联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1) 25℃时,1molN2H4(l) 与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出612.5 kJ的热量。请写出该反应的热化学方程式________________
(2) 已知:2NO2(g) N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH______ 0(填写“>”、“<”、“=”)
② 一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡,达到平衡状态的标志是
N2O4(g)达到平衡,达到平衡状态的标志是___________ (填字母)
A 单位时间内生成n mol N2O4的同时生成2 nmolNO2
B 用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C 混合气体的颜色不再改变的状态
D 混合气体的密度不再改变的状态
E 混合气体的平均相对分子质量不再改变的状态
③ 其他条件不变时,下列措施能提高NO2转化率的是___________ (填字母)
A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
(3) 17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)= 0.2 mol·L-1,c(N2O4)= 0.16 mol·L-1。该温度下该反应的平衡常数K为_________ 。
(1) 25℃时,1molN2H4(l) 与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出612.5 kJ的热量。请写出该反应的热化学方程式
(2) 已知:2NO2(g)
 N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。① 在上述条件下反应能够自发进行,则反应的ΔH
② 一定温度下,在密闭容器中反应2NO2(g)
 N2O4(g)达到平衡,达到平衡状态的标志是
N2O4(g)达到平衡,达到平衡状态的标志是A 单位时间内生成n mol N2O4的同时生成2 nmolNO2
B 用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C 混合气体的颜色不再改变的状态
D 混合气体的密度不再改变的状态
E 混合气体的平均相对分子质量不再改变的状态
③ 其他条件不变时,下列措施能提高NO2转化率的是
A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
(3) 17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)= 0.2 mol·L-1,c(N2O4)= 0.16 mol·L-1。该温度下该反应的平衡常数K为
您最近一年使用:0次
名校
解题方法
4 . 能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___ ;该反应在条件下能自发进行___ (选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。

①T1___ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___ (填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___ ;t3时采取的措施可能是___ 。

④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
您最近一年使用:0次
2020-04-01更新
|
112次组卷
|
2卷引用:甘肃省静宁县第一中学2019-2020学年高二下学期第一次月考(实验班)化学试题
名校
5 . 100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g) 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。

Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____ mol·L-1·s-1。
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=____ 。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1_____ K2(填“>”、“<”或“=”)。
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____ 。
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=____ kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是____ (填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___ (填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____ (“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____ 。(精确到小数点后两位)
 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
 H2(g)+CO2(g)。
H2(g)+CO2(g)。(5)下列说法能作为判断该反应达到化学平衡状态的依据的是
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=
您最近一年使用:0次
2019-10-22更新
|
75次组卷
|
2卷引用:【全国百强校】甘肃省静宁县第一中学2019-2020学年高二上学期第二次考试化学试题
名校
6 . 在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________ 。
(2)该反应为____________ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________ ℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________ (填“正向”或“逆向”)进行。
 CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应
您最近一年使用:0次
2019-09-30更新
|
220次组卷
|
4卷引用:甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题
解题方法
7 . (1)反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
①反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________ (用ΔH1和ΔH2表示),K=________ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是___________________ 反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g) CO(g)+H2O(g)达到化学平衡状态的依据是
CO(g)+H2O(g)达到化学平衡状态的依据是_______ (填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①用CO表示的化学反应速率为_________________________ ,该反应平衡常数的表达式为______________________________ ,该条件下反应的平衡常数为______ ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______ mol·L-1。
②下列措施中能使平衡时 增大的是
增大的是________ (填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
 FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表: | 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH= CO(g)+H2O(g)是
CO(g)+H2O(g)是②能判断CO2(g)+H2(g)
 CO(g)+H2O(g)达到化学平衡状态的依据是
CO(g)+H2O(g)达到化学平衡状态的依据是A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
①用CO表示的化学反应速率为
②下列措施中能使平衡时
 增大的是
增大的是A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
名校
8 . 一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g)  2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________ (填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________ 。在保证A浓度不变的情况下,扩大容器的体积,平衡______ (填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________ ;t8时_________________________ 。
②t2时平衡向___________________ (填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________ 。
 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。(1)一段时间后上述反应达到平衡。则下列说法中正确的是
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时
②t2时平衡向
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线
您最近一年使用:0次
2018-10-28更新
|
417次组卷
|
8卷引用:【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题
名校
解题方法
9 . 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________ 。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________ 。(已知:H2S: ;
; ;H2CO3:
;H2CO3: 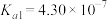 ;
;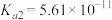 )
)
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①实验1条件下平衡常数K=______________ (保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________ 。
③该反应的△H______ 0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mol H2O,2mol CO2,5mol H2,则此时v正___________ v逆(填“<”,“>”,“=”)。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。①能判断该反应达到平衡状态的标志是
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为
 ;
; ;H2CO3:
;H2CO3: 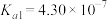 ;
;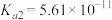 )
)(3)已知反应:CO(g)+H2O(g)
 CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | H2 | CO | 0 | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是
③该反应的△H
您最近一年使用:0次
2017-12-19更新
|
287次组卷
|
3卷引用:甘肃省平凉市泾川市2019届高三模拟测试化学试题
真题
名校
10 . 在一定温度下,反应 H2(g)+
H2(g)+ X2(g)⇌HX(g)的平衡常数为10,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
X2(g)⇌HX(g)的平衡常数为10,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
 H2(g)+
H2(g)+ X2(g)⇌HX(g)的平衡常数为10,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
X2(g)⇌HX(g)的平衡常数为10,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于| A.5% | B.17% | C.25% | D.33% |
您最近一年使用:0次
2016-12-09更新
|
1367次组卷
|
22卷引用:甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题
甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年江西省丰城、樟树、高安中学高二上学期期末联考化学试卷2015-2016学年海南省嘉积中学高二上学期期末理化学试卷2015-2016学年江西省九江一中高二上学期第一次月考化学试卷2015-2016学年河北省正定中学高一下期末化学试卷2016-2017学年山西省太原五中高二上10月月考化学卷黑龙江省大庆中学2017-2018学年高二上学期期末化学试题福建省华安县第一中学2017-2018学年高二年上学期第二次月考(12月)化学试题高二人教版选修4 第二章 章末知识测评(二)福建省漳州市东山县第二中学2019届高三上学期第三次月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题宁夏长庆高级中学2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)(已下线)【南昌新东方】江西省九江一中2015-2016学年高二上学期第一次月考化学试卷海南省琼山中学2019-2020学年高二上学期期中考试化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期中考试化学试题广西玉林师院附中、玉林十一中等五校2020-2021学年高二上学期教学质量评价理综化学试题云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题



