名校
解题方法
1 . 2023年杭州亚运会主火炬创新使用了绿色“零碳甲醇”作为燃料,这不仅在亚运史上是第一次,在全球大型体育赛事上也是首次实现了废碳的再生利用。“零碳甲醇”是符合“碳中和”属性的绿色能源。
Ⅰ.直接法制甲醇
我国科研团队研究发现使用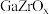 双金属氧化物可形成氧空位,具有催化氧化性能,实现
双金属氧化物可形成氧空位,具有催化氧化性能,实现 加氢制甲醇。该反应机理如图所示。
加氢制甲醇。该反应机理如图所示。
(2)向恒温恒压密闭容器中充入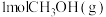 和
和 发生上述反应(反应Ⅰ)的逆过程,达到平衡时,
发生上述反应(反应Ⅰ)的逆过程,达到平衡时, 的转化率为
的转化率为 ,用摩尔分数表示反应Ⅰ的平衡常数
,用摩尔分数表示反应Ⅰ的平衡常数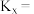
___________ 。(用分数表示,物质i的摩尔分数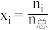 )
)
Ⅱ.间接法制甲醇
 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成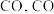 和
和 再合成甲醇。
再合成甲醇。
反应Ⅱ:
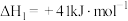
反应Ⅲ:

(3)反应Ⅱ的速率 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
___________ (填“增大”“减小”或“不变”)。
(4)在某催化剂下,反应Ⅲ的反应历程如图所示(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,*表示吸附在催化剂上)。已知V中有一种吸附在催化剂表面的物质,V可表示为___________ 。 ,向密闭容器中加入
,向密闭容器中加入 和
和 ,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为
的物质的量为 为
为 。则
。则 分压的变化量为
分压的变化量为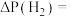
___________  (保留三位有效数字)。
(保留三位有效数字)。
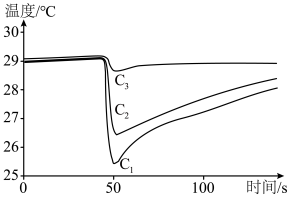
(6)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是___________ ,理由是___________ 。
Ⅰ.直接法制甲醇
我国科研团队研究发现使用
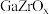 双金属氧化物可形成氧空位,具有催化氧化性能,实现
双金属氧化物可形成氧空位,具有催化氧化性能,实现 加氢制甲醇。该反应机理如图所示。
加氢制甲醇。该反应机理如图所示。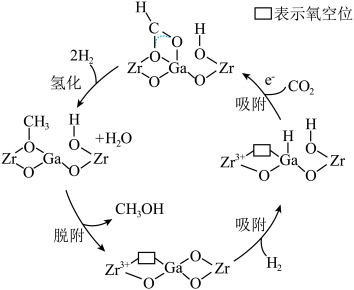
| A.增大催化剂的比表面积有利于提高平衡转化率 |
| B.催化剂表面甲醇及时脱附有利于提高反应速率 |
| C.在恒温恒容密闭容器中,通入惰性气体以增加体系压强,有利于提高甲醇的产率 |
D.若断开 键同时断开 键同时断开 键,则说明反应达到平衡状态 键,则说明反应达到平衡状态 |
(2)向恒温恒压密闭容器中充入
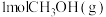 和
和 发生上述反应(反应Ⅰ)的逆过程,达到平衡时,
发生上述反应(反应Ⅰ)的逆过程,达到平衡时, 的转化率为
的转化率为 ,用摩尔分数表示反应Ⅰ的平衡常数
,用摩尔分数表示反应Ⅰ的平衡常数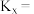
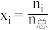 )
)Ⅱ.间接法制甲醇
 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成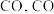 和
和 再合成甲醇。
再合成甲醇。反应Ⅱ:

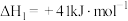
反应Ⅲ:


(3)反应Ⅱ的速率
 ,其中
,其中 和
和 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
(4)在某催化剂下,反应Ⅲ的反应历程如图所示(图中的数据表示的仅为微粒的数目以及各个阶段微粒的相对总能量,*表示吸附在催化剂上)。已知V中有一种吸附在催化剂表面的物质,V可表示为
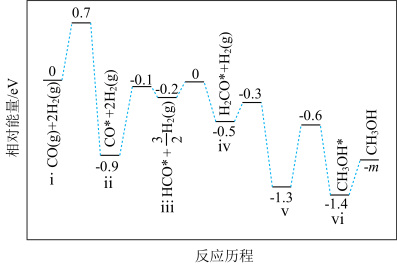
 ,向密闭容器中加入
,向密闭容器中加入 和
和 ,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内
,在恒温下只发生反应Ⅰ和反应Ⅱ。10s后反应达到平衡,此时容器内 的物质的量为
的物质的量为 为
为 。则
。则 分压的变化量为
分压的变化量为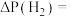
 (保留三位有效数字)。
(保留三位有效数字)。(6)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是
您最近一年使用:0次
2 . 用过二硫酸铵 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。
已知:i. 、
、 均能导电;
均能导电;
ii. ;
;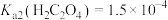 ;
;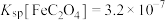
(1) 的晶胞如图1所示。
的晶胞如图1所示。 晶胞,则每个
晶胞,则每个 晶胞中含有的Fe原子个数为
晶胞中含有的Fe原子个数为___________ 。
②图2所示结构单元不能作为 晶胞的原因是
晶胞的原因是___________ 。
(2)用 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
①一段时间后, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②浸取初期,随着浸取时间延长, 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是___________ 。
(3)在足量 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:
①添加Ag⁺可以显著提高Cu元素的浸出率的原因:___________ 。
②进一步研究发现添加的少量 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:___________ 。
(4)进一步从浸出液中提取铜并使 再生的流程示意图如图4所示。
再生的流程示意图如图4所示。
①滤液A中加草酸的反应为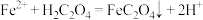 ,该反应化学平衡常数为
,该反应化学平衡常数为___________ 。
②电解滤液B而不电解滤液A的原因是___________ 。
 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。已知:i.
 、
、 均能导电;
均能导电;ii.
 ;
;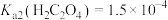 ;
;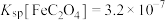
(1)
 的晶胞如图1所示。
的晶胞如图1所示。
 晶胞,则每个
晶胞,则每个 晶胞中含有的Fe原子个数为
晶胞中含有的Fe原子个数为②图2所示结构单元不能作为
 晶胞的原因是
晶胞的原因是(2)用
 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
①一段时间后,
 与
与 反应的离子方程式为
反应的离子方程式为②浸取初期,随着浸取时间延长,
 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是(3)在足量
 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:添加 | 未加 | |
| Cu元素的浸出率 | 98.02% | 30.90% |
| 过程中产物形态 |
|
|
②进一步研究发现添加的少量
 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:(4)进一步从浸出液中提取铜并使
 再生的流程示意图如图4所示。
再生的流程示意图如图4所示。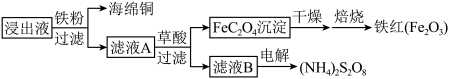
①滤液A中加草酸的反应为
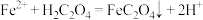 ,该反应化学平衡常数为
,该反应化学平衡常数为②电解滤液B而不电解滤液A的原因是
您最近一年使用:0次
7日内更新
|
223次组卷
|
2卷引用:江苏省南通市海安高级中学2024届高三下学期第二次模拟考试化学试题
解题方法
3 . 选择性催化还原(SCR)脱硝技术可用于减少工业生产中氮氧化物( )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:
Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
(1)反应

___________ ,副反应化学方程式为___________ 。
(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图:___________ ,应选择的最佳催化剂为___________ ,选用合适的催化剂还能抑制催化剂表面出现铵盐结晶现象,结晶会导致___________ 。
Ⅱ.H2―SCR技术
主反应: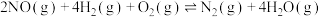
副反应:
(3)恒温下,向容积为1L的容器中充入2mol NO、4mol 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的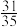 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为___________ ,主反应的
___________ (列出计算式即可)。
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:___________ ,随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是___________ 。
 )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
| 反应方程式 | 反应热 | |
| 吸附过程 | 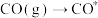 |  |
 |  | |
| 解离过程 |  |  |
| 缔结过程 | 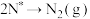 |  |
 |  | |
 | 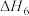 |
(1)反应


(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图: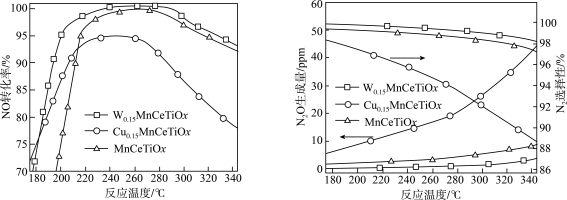
Ⅱ.H2―SCR技术
主反应:
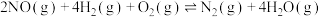
副反应:

(3)恒温下,向容积为1L的容器中充入2mol NO、4mol
 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的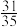 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的
 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
您最近一年使用:0次
4 .  和
和 催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。 的量不变,向体积相同的恒容密闭容器中分别通入
的量不变,向体积相同的恒容密闭容器中分别通入 为0:1、1:1、2:1、3:1的
为0:1、1:1、2:1、3:1的 的混合气,测得
的混合气,测得 的平衡转化率随温度的变化曲线如图2。
的平衡转化率随温度的变化曲线如图2。
Ⅰ.
Ⅱ.
Ⅲ.
(1) =
=___________ 。
(2)① =1:1对应图中曲线
=1:1对应图中曲线___________ (填序号)。
②900K下,曲线b、c、d的平衡转化率显著大于a的原理为___________ 。
(3)900K,将 =3:1的混合气通入恒容密闭容器中进行反应。
=3:1的混合气通入恒容密闭容器中进行反应。
①下列说法正确的是___________ (填序号)。
A.通入氩气可提高 的平衡转化率
的平衡转化率
B.体系达到平衡时,若缩小容器容积,反应Ⅱ平衡不移动
C.当 和
和 的比值不变时,体系达到平衡
的比值不变时,体系达到平衡
D.改善催化剂的性能可提高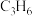 生产效率
生产效率
②若初始压强为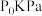 ,t min时达到平衡,此时
,t min时达到平衡,此时 分压是CO的5倍,0~t min内
分压是CO的5倍,0~t min内 =
=___________  ;反应Ⅰ的压强平衡常数
;反应Ⅰ的压强平衡常数 =
=___________ 。
(4)利用反应 可制备高纯Ni。
可制备高纯Ni。
① 晶体中不存在的作用力有
晶体中不存在的作用力有___________ 。
A.离子键 B.π键 C.范德华力 D.极性键 E.金属键
② 中Ni为
中Ni为 杂化,配位原子是
杂化,配位原子是___________ ,判断依据是___________ 。
 和
和 催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
 的量不变,向体积相同的恒容密闭容器中分别通入
的量不变,向体积相同的恒容密闭容器中分别通入 为0:1、1:1、2:1、3:1的
为0:1、1:1、2:1、3:1的 的混合气,测得
的混合气,测得 的平衡转化率随温度的变化曲线如图2。
的平衡转化率随温度的变化曲线如图2。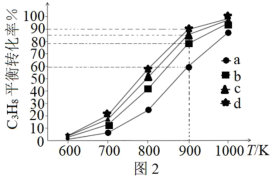
Ⅰ.

Ⅱ.

Ⅲ.

(1)
 =
=(2)①
 =1:1对应图中曲线
=1:1对应图中曲线②900K下,曲线b、c、d的平衡转化率显著大于a的原理为
(3)900K,将
 =3:1的混合气通入恒容密闭容器中进行反应。
=3:1的混合气通入恒容密闭容器中进行反应。①下列说法正确的是
A.通入氩气可提高
 的平衡转化率
的平衡转化率B.体系达到平衡时,若缩小容器容积,反应Ⅱ平衡不移动
C.当
 和
和 的比值不变时,体系达到平衡
的比值不变时,体系达到平衡D.改善催化剂的性能可提高
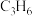 生产效率
生产效率②若初始压强为
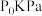 ,t min时达到平衡,此时
,t min时达到平衡,此时 分压是CO的5倍,0~t min内
分压是CO的5倍,0~t min内 =
= ;反应Ⅰ的压强平衡常数
;反应Ⅰ的压强平衡常数 =
=(4)利用反应
 可制备高纯Ni。
可制备高纯Ni。①
 晶体中不存在的作用力有
晶体中不存在的作用力有A.离子键 B.π键 C.范德华力 D.极性键 E.金属键
②
 中Ni为
中Ni为 杂化,配位原子是
杂化,配位原子是
您最近一年使用:0次
5 . 硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法-“炼石胆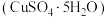 取精华法”。借助现代仪器分析,该制备过程中
取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有
分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有___________ 种。875℃左右的吸热峰表示化学反应的方程式为___________ 。
①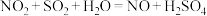 (慢反应) ②
(慢反应) ②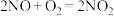 (快反应)
(快反应)
(ⅰ)上述过程中 的作用为
的作用为___________ 。其中反应___________ (填“①”或“②”)是该反应的决速步。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是___________ (答出两点即可)。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化:
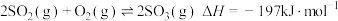
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如图所示,下列说法不正确的是___________ 。
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同α下的最大速率,选择最佳生产温度
(ⅱ)设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
___________ (用平衡分压代替平衡浓度计算)。
(4)二氧化硫一空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。___________ ;
(ⅱ)相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为___________ 。
(1)我国古籍记载了硫酸的制备方法-“炼石胆
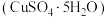 取精华法”。借助现代仪器分析,该制备过程中
取精华法”。借助现代仪器分析,该制备过程中 分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有
分解的TG曲线(热重)及DSC曲线如下图所示,DSC图中,吸热效应呈现向下凸起的峰(热焓增加),放热效应反之,则700℃左右有二个吸热峰,此时分解生成的氧化物有
①
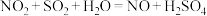 (慢反应) ②
(慢反应) ②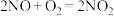 (快反应)
(快反应)(ⅰ)上述过程中
 的作用为
的作用为(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是
(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: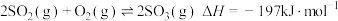
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如图所示,下列说法不正确的是

b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同α下的最大速率,选择最佳生产温度
(ⅱ)设
 的平衡分压为p,
的平衡分压为p, 的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
的平衡转化率为b,用含p和b的代数式表示上述催化氧化反应的
(4)二氧化硫一空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。

(ⅱ)相同条件下,放电过程中消耗的
 和
和 的体积比为
的体积比为
您最近一年使用:0次
7日内更新
|
39次组卷
|
2卷引用:2024届新疆维吾尔自治区高三下学期三模考试理综试题-高中化学
名校
解题方法
6 .  是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为
是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为 。主反应如下:
。主反应如下:
反应Ⅰ.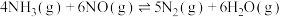
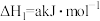
反应Ⅱ.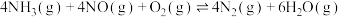
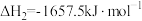
(1)已知:
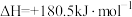 。则
。则
_______  。某条件下对于反应Ⅰ,
。某条件下对于反应Ⅰ, ,
,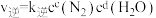 ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m_______ n(填“>”、“<”或“=”)。
(2)将模拟烟气按一定的流量通入掺杂不同金属的催化剂,在不同温度下进行反应并测定相关物质浓度,得出不同情况下NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。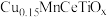 时,温度高于260℃时NO转化率下降的原因可能是
时,温度高于260℃时NO转化率下降的原因可能是_______ 。
②综合考虑应选择_______ 为该脱硝过程的催化剂,选择合适的催化剂_______ (填写“能”或“不能”)提高 的平衡产率。
的平衡产率。
③为探究氨的催化脱硝过程中生成 的机理,将含有不同同位素原子的物质(
的机理,将含有不同同位素原子的物质(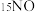 与
与 、
、 )通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。
)通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。 与NO、
与NO、 反应生成
反应生成 的化学方程式为
的化学方程式为_______ (需标出N原子的质量数)。
(3)当温度为273℃,在恒容密闭的容器中,假设仅发生两个主反应。通入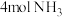 、
、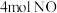 、
、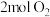 ,初始压强为
,初始压强为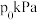 情况下,达到平衡后测定
情况下,达到平衡后测定 转化率为30%,平衡体系中
转化率为30%,平衡体系中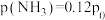 。则NO的转化率为
。则NO的转化率为______ ,反应Ⅱ的
______ (写出计算式即可)。
 是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为
是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为 。主反应如下:
。主反应如下:反应Ⅰ.
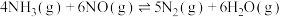
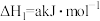
反应Ⅱ.
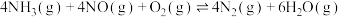
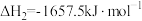
(1)已知:

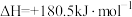 。则
。则
 。某条件下对于反应Ⅰ,
。某条件下对于反应Ⅰ, ,
,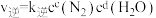 ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m(2)将模拟烟气按一定的流量通入掺杂不同金属的催化剂,在不同温度下进行反应并测定相关物质浓度,得出不同情况下NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。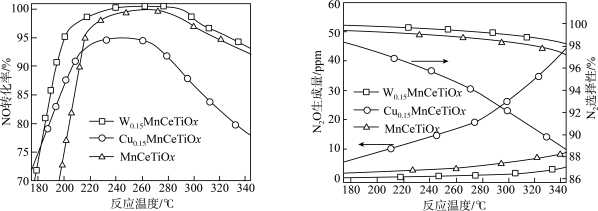
 时,温度高于260℃时NO转化率下降的原因可能是
时,温度高于260℃时NO转化率下降的原因可能是②综合考虑应选择
 的平衡产率。
的平衡产率。③为探究氨的催化脱硝过程中生成
 的机理,将含有不同同位素原子的物质(
的机理,将含有不同同位素原子的物质(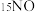 与
与 、
、 )通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。
)通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。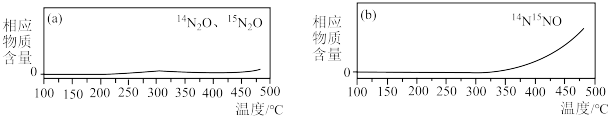
 与NO、
与NO、 反应生成
反应生成 的化学方程式为
的化学方程式为(3)当温度为273℃,在恒容密闭的容器中,假设仅发生两个主反应。通入
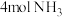 、
、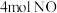 、
、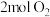 ,初始压强为
,初始压强为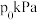 情况下,达到平衡后测定
情况下,达到平衡后测定 转化率为30%,平衡体系中
转化率为30%,平衡体系中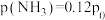 。则NO的转化率为
。则NO的转化率为
您最近一年使用:0次
名校
解题方法
7 . 二甲醚( )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
Ⅰ.

Ⅱ.

Ⅲ.

下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
回答下列问题:
(1)
___________ ;反应Ⅱ的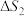
___________ (填“>”“=”或“<”)0。
(2) ℃下,向1L刚性密闭容器中投入2mol
℃下,向1L刚性密闭容器中投入2mol  ,只发生反应Ⅲ,t s时达到平衡,此时
,只发生反应Ⅲ,t s时达到平衡,此时 的转化率为
的转化率为 。
。
①下列叙述能说明反应Ⅲ已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化 b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率 d.
的消耗速率 d. 的体积分数不再发生变化
的体积分数不再发生变化
②若向该容器中再加入2mol ,重新达到平衡时所需时间
,重新达到平衡时所需时间___________ (填“>”“=”或“<”)t s,此时 的体积分数为
的体积分数为___________ (用含 的代数式表示)。
的代数式表示)。
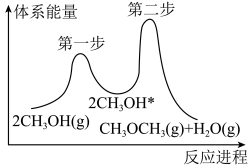
③在催化剂条件下反应Ⅲ的反应过程如下图所示,“*”表示吸附在催化剂上。___________ (填“第一步”或“第二步”),判断的理由是__________________ 。
(3) ℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入
℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入 和
和 发生上述反应,平衡时
发生上述反应,平衡时 的转化率为60%,
的转化率为60%, (g)的体积分数为25%。则平衡时
(g)的体积分数为25%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字);该温度下反应Ⅰ的压强平衡常数
___________ (用含p的代数式表示) 。
。
 )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:Ⅰ.


Ⅱ.


Ⅲ.


下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
| 物质 |  (g) (g) |  (g) (g) |  (g) (g) |  (g) (g) |
标准生成热/( ) ) | 0 | -201.3 | -241.3 | -184.3 |
(1)

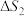
(2)
 ℃下,向1L刚性密闭容器中投入2mol
℃下,向1L刚性密闭容器中投入2mol  ,只发生反应Ⅲ,t s时达到平衡,此时
,只发生反应Ⅲ,t s时达到平衡,此时 的转化率为
的转化率为 。
。①下列叙述能说明反应Ⅲ已经达到平衡的是
a.混合气体密度不再发生变化 b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率 d.
的消耗速率 d. 的体积分数不再发生变化
的体积分数不再发生变化②若向该容器中再加入2mol
 ,重新达到平衡时所需时间
,重新达到平衡时所需时间 的体积分数为
的体积分数为 的代数式表示)。
的代数式表示)。③在催化剂条件下反应Ⅲ的反应过程如下图所示,“*”表示吸附在催化剂上。
(3)
 ℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入
℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入 和
和 发生上述反应,平衡时
发生上述反应,平衡时 的转化率为60%,
的转化率为60%, (g)的体积分数为25%。则平衡时
(g)的体积分数为25%。则平衡时 的体积分数为
的体积分数为
 。
。
您最近一年使用:0次
7日内更新
|
196次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高三下学期4月模拟测试化学试题
解题方法
8 . 我国在政府工作报告中提出力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳转化利用技术,成为当下研究热点。
 .
. 与
与 重整是
重整是 再利用的研究热点之一、该重整反应体系主要涉及以下反应:
再利用的研究热点之一、该重整反应体系主要涉及以下反应:
①

②
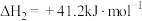
③
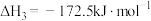
(1)已知反应①低温无法自发进行,只能在高温下自发进行,则
___________ 0(填“>”或“<”)。
(2)某温度下,在体积 的密闭容器中加入
的密闭容器中加入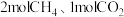 及催化剂仅发生反应①,经过
及催化剂仅发生反应①,经过 达到平衡状态时
达到平衡状态时 的转化率为
的转化率为 。则用
。则用 表示的平均化学反应速率为
表示的平均化学反应速率为___________ ,平衡常数的值为___________ ;达到平衡后,其他条件不变时向容器中充入 与
与 各
各 ,则化学平衡
,则化学平衡___________ 移动(选填“正向”、“逆向”或“不”)。
(3) 下,将
下,将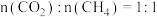 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图所示。
的平衡转化率如图所示。 时
时 的平衡转化率远大于
的平衡转化率远大于 时
时 的平衡转化率。原因是
的平衡转化率。原因是___________ 。 .
. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为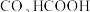 是一种具有前景的利用
是一种具有前景的利用 的方式。在催化剂表面,
的方式。在催化剂表面, 还原生成
还原生成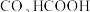 通过两种平行的反应途径进行,各自途径的关键中间体分别为
通过两种平行的反应途径进行,各自途径的关键中间体分别为 。催化剂催化
。催化剂催化 转化为
转化为 和
和 的反应历程如图1(*表示吸附在催化剂表面)。
的反应历程如图1(*表示吸附在催化剂表面)。 催化剂表面更利于生成
催化剂表面更利于生成___________ 。
(5)在m和n两种催化剂作用下,反应①的阿伦尼乌斯经验公式实验数据如图2所示,已知阿伦尼乌斯经验公式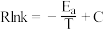 (
( 为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是
为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是___________ (填“m”或“n”)。
 .
. 与
与 重整是
重整是 再利用的研究热点之一、该重整反应体系主要涉及以下反应:
再利用的研究热点之一、该重整反应体系主要涉及以下反应:①


②

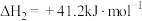
③

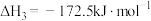
(1)已知反应①低温无法自发进行,只能在高温下自发进行,则

(2)某温度下,在体积
 的密闭容器中加入
的密闭容器中加入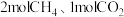 及催化剂仅发生反应①,经过
及催化剂仅发生反应①,经过 达到平衡状态时
达到平衡状态时 的转化率为
的转化率为 。则用
。则用 表示的平均化学反应速率为
表示的平均化学反应速率为 与
与 各
各 ,则化学平衡
,则化学平衡(3)
 下,将
下,将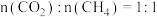 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图所示。
的平衡转化率如图所示。 时
时 的平衡转化率远大于
的平衡转化率远大于 时
时 的平衡转化率。原因是
的平衡转化率。原因是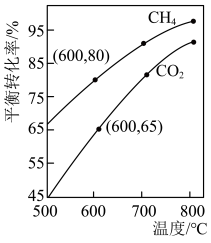
 .
. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为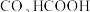 是一种具有前景的利用
是一种具有前景的利用 的方式。在催化剂表面,
的方式。在催化剂表面, 还原生成
还原生成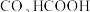 通过两种平行的反应途径进行,各自途径的关键中间体分别为
通过两种平行的反应途径进行,各自途径的关键中间体分别为 。催化剂催化
。催化剂催化 转化为
转化为 和
和 的反应历程如图1(*表示吸附在催化剂表面)。
的反应历程如图1(*表示吸附在催化剂表面)。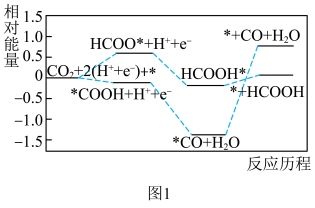
 催化剂表面更利于生成
催化剂表面更利于生成(5)在m和n两种催化剂作用下,反应①的阿伦尼乌斯经验公式实验数据如图2所示,已知阿伦尼乌斯经验公式
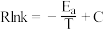 (
( 为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是
为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较高的是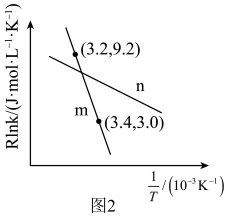
您最近一年使用:0次
解题方法
9 . 铁的化合物在工业生产中具有重要的应用。以硅酸铁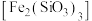 作为载氧体实现甲烷部分氧化,发生的主要反应有:
作为载氧体实现甲烷部分氧化,发生的主要反应有:
i. ;
;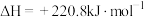
ii. ;
;
iii.
iv.
回答下列问题:
(1)在元素周期表中,Fe元素位于___________ 区(填“s”“p”“d”或“ds”)。
(2)反应i___________ (填“能”或“不能”)在高温条件下自发进行。反应ii的正反应活化能___________ (填“大于”“小于”或“等于”)逆反应活化能。
(3)反应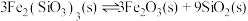 的
的
___________  。
。
(4)在恒温恒容条件下,仅发生反应i,下列说法不能表明反应i已达到化学平衡的是___________(填标号)。
(5)载氧体 为
为 转化为氧化物提供氧原子,
转化为氧化物提供氧原子, 与
与 物质的量之比
物质的量之比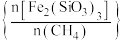 是影响
是影响 转化为合成气
转化为合成气 的重要因素。在
的重要因素。在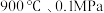 下,向密闭容器投入
下,向密闭容器投入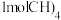 发生上述反应,不同
发生上述反应,不同 对部分物种的平衡量的影响如图所示。
对部分物种的平衡量的影响如图所示。 的选择性(S)公式如下:
的选择性(S)公式如下: ,
, 。
。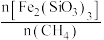 值为
值为___________ (填标号)。
A.1.5 B.0.45 C.0.38 D.0.3
②当 平衡转化率为98%时,测得体系中
平衡转化率为98%时,测得体系中 ,则
,则
___________ %(保留1位小数)。
(6)在恒压密闭容器中,加入甲烷和水蒸气各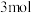 ,一定条件下发生反应:
,一定条件下发生反应: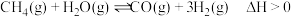 。测得平衡时
。测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
___________  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
②温度为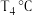 、压强为,
、压强为,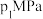 时,N点表示的正、逆反应速率
时,N点表示的正、逆反应速率
___________ 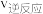 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
③ 时该反应的压强平衡常数
时该反应的压强平衡常数
___________  (用含
(用含 的代数式表示)。
的代数式表示)。
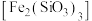 作为载氧体实现甲烷部分氧化,发生的主要反应有:
作为载氧体实现甲烷部分氧化,发生的主要反应有:i.
 ;
;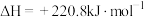
ii.
 ;
;
iii.

iv.

回答下列问题:
(1)在元素周期表中,Fe元素位于
(2)反应i
(3)反应
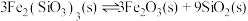 的
的
 。
。(4)在恒温恒容条件下,仅发生反应i,下列说法不能表明反应i已达到化学平衡的是___________(填标号)。
A.相同时间内,气态反应物有 键断裂的同时气态产物有 键断裂的同时气态产物有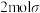 键生成 键生成 |
| B.容器中气体的密度不再变化 |
| C.固体中所含氧元素的质量分数不再变化 |
| D.容器中气体的平均相对分子质量不再变化 |
(5)载氧体
 为
为 转化为氧化物提供氧原子,
转化为氧化物提供氧原子, 与
与 物质的量之比
物质的量之比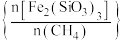 是影响
是影响 转化为合成气
转化为合成气 的重要因素。在
的重要因素。在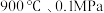 下,向密闭容器投入
下,向密闭容器投入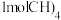 发生上述反应,不同
发生上述反应,不同 对部分物种的平衡量的影响如图所示。
对部分物种的平衡量的影响如图所示。 的选择性(S)公式如下:
的选择性(S)公式如下: ,
, 。
。
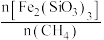 值为
值为A.1.5 B.0.45 C.0.38 D.0.3
②当
 平衡转化率为98%时,测得体系中
平衡转化率为98%时,测得体系中 ,则
,则
(6)在恒压密闭容器中,加入甲烷和水蒸气各
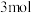 ,一定条件下发生反应:
,一定条件下发生反应: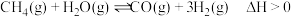 。测得平衡时
。测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。

 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。②温度为
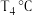 、压强为,
、压强为,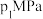 时,N点表示的正、逆反应速率
时,N点表示的正、逆反应速率
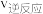 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。③
 时该反应的压强平衡常数
时该反应的压强平衡常数
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
10 . CO2的充分利用和转化为其他化学品,对于环境和能源等意义重大。回答下列问题:
(1)CO2可制备二甲醚(CH3OCH3),涉及热化学方程式如下:
Ⅰ. ;
;
Ⅱ. ;
;
Ⅲ. 。
。
①反应Ⅰ的
___________  ,该反应的活化能
,该反应的活化能 (正)
(正)___________ (填“大于”或“小于”) (逆)。
(逆)。
②对于反应Ⅱ、Ⅲ,在一定条件下,若反应Ⅱ中,CO2的转化率为98%、反应Ⅲ的转化率为40%,则CH3CH2OH的产率为___________ 。
(2)利用CO2与CH4反应可制备合成气。在恒容密闭容器中通入物质的量均为nmol的CH4与CO2,在一定条件下发生反应 ,测得CO2的平衡转化率与温度及压强的关系如图1所示。
,测得CO2的平衡转化率与温度及压强的关系如图1所示。 、
、 、
、 、
、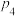 由大到小的顺序为
由大到小的顺序为___________ ,理由是___________ 。
②在压强为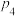 、1100℃的条件下,X点平衡常数
、1100℃的条件下,X点平衡常数
___________ (用含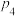 的代数式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
的代数式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图2所示。研究表明,在不同电极材料上形成中间体的部分反应相对能量(活化能)如图3所示。___________ 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是___________ 。
(1)CO2可制备二甲醚(CH3OCH3),涉及热化学方程式如下:
Ⅰ.
 ;
;Ⅱ.
 ;
;Ⅲ.
 。
。①反应Ⅰ的

 ,该反应的活化能
,该反应的活化能 (正)
(正) (逆)。
(逆)。②对于反应Ⅱ、Ⅲ,在一定条件下,若反应Ⅱ中,CO2的转化率为98%、反应Ⅲ的转化率为40%,则CH3CH2OH的产率为
(2)利用CO2与CH4反应可制备合成气。在恒容密闭容器中通入物质的量均为nmol的CH4与CO2,在一定条件下发生反应
 ,测得CO2的平衡转化率与温度及压强的关系如图1所示。
,测得CO2的平衡转化率与温度及压强的关系如图1所示。
 、
、 、
、 、
、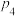 由大到小的顺序为
由大到小的顺序为②在压强为
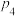 、1100℃的条件下,X点平衡常数
、1100℃的条件下,X点平衡常数
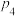 的代数式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
的代数式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图2所示。研究表明,在不同电极材料上形成中间体的部分反应相对能量(活化能)如图3所示。

②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是
您最近一年使用:0次





