解题方法
1 . I、目前我国主要使用肼(N2H4)作为卫星发射所用燃料。
(1)N2H4可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和H2O。
已知:
①N2(g)+2O2(g)=N2O4(l) ΔH=-19.5kJ·mol−1K1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.2kJ·mol−1K2
写出反应③液体燃料N2H4与液态N2O4反应生成N2和H2O的热化学方程式:___________ ,K1、K2、K3之间的关系:___________
(2)若已知下列数据:
试根据表中数据计算出N-H的键能:___________ kJ·mol−1
Ⅱ、在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:
(3)该反应为___________ 反应(填“吸热”、“放热”),原因为___________
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内 (H2)=
(H2)=___________ ,转化率α(CO2)=___________
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的物质的量分别为4mol、4mol、8mol、8mol,则此时上述反应的平衡向___________ 移动(填“正向”、“逆向”或“不”)
Ⅲ、已知在不同温度下,甲烷隔绝空气有可能发生如下两个裂解反应:①CH4(g)→C(s)+2H2(g),②2CH4(g)→C2H4(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,查阅资料,得到如下热力学数据:
反应①的ΔH(298K)=+74.848kJ/mol,ΔS(298K)=+80.674J/(mol·K)
反应②的ΔH(298K)=+376.426kJ/mol,ΔS(298K)=+220.211J/(mol·K)
已知,上述反应的焓变和熵变随温度变化很小。请帮助这位同学回答下列问题:
(6)反应①在___________ (填“高温”或“低温”)下能自发进行
(7)为了提高甲烷的炭化程度,下列温度最合适的是___________
(1)N2H4可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和H2O。
已知:
①N2(g)+2O2(g)=N2O4(l) ΔH=-19.5kJ·mol−1K1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.2kJ·mol−1K2
写出反应③液体燃料N2H4与液态N2O4反应生成N2和H2O的热化学方程式:
(2)若已知下列数据:
| 化学键 | N-N | N≡N | H-O | O=O |
| 键能/kJ·mol-1 | 190 | 946 | 462.8 | 498.8 |
试根据表中数据计算出N-H的键能:
Ⅱ、在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内
 (H2)=
(H2)=(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的物质的量分别为4mol、4mol、8mol、8mol,则此时上述反应的平衡向
Ⅲ、已知在不同温度下,甲烷隔绝空气有可能发生如下两个裂解反应:①CH4(g)→C(s)+2H2(g),②2CH4(g)→C2H4(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,查阅资料,得到如下热力学数据:
反应①的ΔH(298K)=+74.848kJ/mol,ΔS(298K)=+80.674J/(mol·K)
反应②的ΔH(298K)=+376.426kJ/mol,ΔS(298K)=+220.211J/(mol·K)
已知,上述反应的焓变和熵变随温度变化很小。请帮助这位同学回答下列问题:
(6)反应①在
(7)为了提高甲烷的炭化程度,下列温度最合适的是___________
| A.905.2K | B.927K | C.1273K | D.2000K |
您最近一年使用:0次
2 . Ⅰ.氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。用氢气和氮气合成氨是一个可逆反应,化学方程式为N2+3H2 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式:_______ 。
(2)如果一个反应的ΔH—TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=—198.2 J·mol-1·K-1,则其在常温下_______ (填“能”或“不能”)自发进行。
Ⅱ.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(3)该反应的平衡常数表达式K=_______ ,ΔH=_______ (填“<”“>”或“=”)0。
(4)830℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时,c(A)=_______ mol·L-1,C的物质的量为_______ mol;若反应经一段时间后,达到平衡时A的转化率为_______ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_______ 。
(5)判断该反应是否达到平衡的依据为_______ 。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(6)1200℃时,反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为_______ 。
 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。(1)请写出该反应的热化学方程式:
(2)如果一个反应的ΔH—TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=—198.2 J·mol-1·K-1,则其在常温下
Ⅱ.已知A(g)+B(g)
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(3)该反应的平衡常数表达式K=
(4)830℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时,c(A)=
(5)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(6)1200℃时,反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为
您最近一年使用:0次
3 . 氯气是重要的化工原料,随着氯气用量的日益增大,将涉氯行业产生的氯化氢转化为氯气具有重要的现实意义。工业上常采用的转化原理为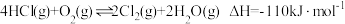 。
。
回答下列问题:
(1)研究表明,在CuO作催化剂时, 氧化HCl的反应分两步进行:
氧化HCl的反应分两步进行:
氯化反应: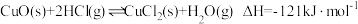 ;
;
氧化反应: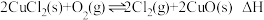 。
。
①氧化反应的
_______  ,该反应中正反应活化能
,该反应中正反应活化能_______ 逆反应活化能(填“>”或“<”)。
②氯化反应在低温条件下进行的趋势很大,原因为_______ 。
(2)在某刚性密闭容器中发生反应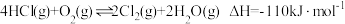 。测得初始投料比
。测得初始投料比 分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:
分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:

①代表初始投料比 分别为1∶1和6∶1时的曲线分别为
分别为1∶1和6∶1时的曲线分别为_______ 、_______ 。
②初始投料比 为4∶1时,升高温度导致HCl的平衡转化率降低的原因为
为4∶1时,升高温度导致HCl的平衡转化率降低的原因为_______ ;在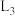 所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
_______ (填“>”“<”或“=”) 。
。
(3)我国科学家设计的一种将HCl转化为 的装置如图乙所示,该制备
的装置如图乙所示,该制备 的方法具有占地面积小、原料利用率高等优点。
的方法具有占地面积小、原料利用率高等优点。

①该装置工作时,发生的能量变化除化学能→热能外,还有_______ 。
②通入HCl(g)的电极为原电池的_______ 极,该电极的电极反应式为_______ 。
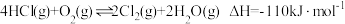 。
。回答下列问题:
(1)研究表明,在CuO作催化剂时,
 氧化HCl的反应分两步进行:
氧化HCl的反应分两步进行:氯化反应:
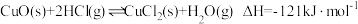 ;
;氧化反应:
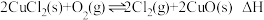 。
。①氧化反应的

 ,该反应中正反应活化能
,该反应中正反应活化能②氯化反应在低温条件下进行的趋势很大,原因为
(2)在某刚性密闭容器中发生反应
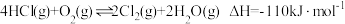 。测得初始投料比
。测得初始投料比 分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:
分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:
①代表初始投料比
 分别为1∶1和6∶1时的曲线分别为
分别为1∶1和6∶1时的曲线分别为②初始投料比
 为4∶1时,升高温度导致HCl的平衡转化率降低的原因为
为4∶1时,升高温度导致HCl的平衡转化率降低的原因为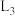 所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
 。
。(3)我国科学家设计的一种将HCl转化为
 的装置如图乙所示,该制备
的装置如图乙所示,该制备 的方法具有占地面积小、原料利用率高等优点。
的方法具有占地面积小、原料利用率高等优点。
①该装置工作时,发生的能量变化除化学能→热能外,还有
②通入HCl(g)的电极为原电池的
您最近一年使用:0次
2022-09-29更新
|
210次组卷
|
2卷引用:河南名校2022-2023学年高二上学期(9月)联考化学试题
名校
4 . 下列说法正确的是
| A.电解法精炼镍时,粗镍作阴极,纯镍作阳极 |
B.反应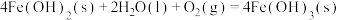 常温下能自发进行,该反应的 常温下能自发进行,该反应的 |
C.常温下 溶液中加入少量 溶液中加入少量 固体,溶液中 固体,溶液中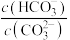 值减小 值减小 |
D.在一容积可变的密闭容器中反应 达平衡后,保持温度不变,缩小体积,平衡正向移动, 达平衡后,保持温度不变,缩小体积,平衡正向移动, 的值增大 的值增大 |
您最近一年使用:0次
2022-09-22更新
|
1917次组卷
|
9卷引用:辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题
名校
解题方法
5 . 研究CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题;
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:
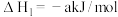 (a>0)
(a>0)
反应Ⅱ: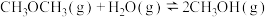
 (b>0)
(b>0)
反应Ⅲ:

(1) =
=_______ kJ/mol,据此判断反应Ⅲ在_______ (填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I,能说明反应I达到平衡状态的是_______ (填字母序号)。
a.平衡常数保持不变 b.生成3molH—H键的同时断裂1molC—O键
c.容器内混合气体的密度保持不变 d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:
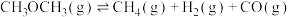 ,在不同时间测定容器内的总压,所得数据见下表:
,在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:反应达平衡时,二甲醚的分解率为_______ ,该温度下的平衡常数
_______  (
( 为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=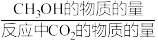 ×100%
×100%

①在上述条件下,结合图象分析,合成甲醇的最佳温度是_______ ,最佳催化剂是_______ 。
②温度高于230℃,CH3OH产率随温度升高而下降的原因是_______ 。
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:

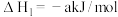 (a>0)
(a>0)反应Ⅱ:
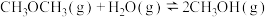
 (b>0)
(b>0)反应Ⅲ:


(1)
 =
=(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I,能说明反应I达到平衡状态的是
a.平衡常数保持不变 b.生成3molH—H键的同时断裂1molC—O键
c.容器内混合气体的密度保持不变 d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:
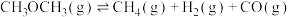 ,在不同时间测定容器内的总压,所得数据见下表:
,在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5 | 10 | 15 | 20 |  |
| 气体总压p总/kPa | p0 | 1.4p0 | 1.6p0 | 1.8p0 | 1.9p0 | 2p0 |

 (
( 为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=
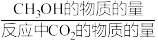 ×100%
×100%
①在上述条件下,结合图象分析,合成甲醇的最佳温度是
②温度高于230℃,CH3OH产率随温度升高而下降的原因是
您最近一年使用:0次
2022-09-11更新
|
583次组卷
|
3卷引用:辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 下列说法正确的是
| A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)= c(OH-) + c(A-) |
| B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023 |
| D.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0 |
您最近一年使用:0次
2022-08-19更新
|
191次组卷
|
2卷引用:江苏省扬州市宝应县2019-2020学年高二下学期期中检测化学试题
解题方法
7 . CH3OH和CH3CH2OH均是重要的有机合成原料、溶剂、燃料等。Cu2O可催化CH3OCH3制备CH3OH和CH3CH2OH。已知:
反应1:CH3OCH3(g)+CO(g) CH3COOCH3(g) △H1=akJ ·mol-1
CH3COOCH3(g) △H1=akJ ·mol-1
反应2: CH3COOCH3(g)+H2(g)
CH3COOCH3(g)+H2(g) 
 CH3OH(g)+
CH3OH(g)+  CH3CH2OH(g) △H2=b kJ·mol-1
CH3CH2OH(g) △H2=b kJ·mol-1
(1)CH3OCH3(g) +CO(g) +2H2(g) CH3OH(g) +CH3CH2OH(g)△H=。
CH3OH(g) +CH3CH2OH(g)△H=。 _______ (用含a、b的代数式表示)kJ·mol-1。
(2)在某恒容容器中发生反应1和反应2,达到平衡时,体系中物质的百分含量与温度的关系如图所示。由此推知,△H1_______ (填“>”、“<”或“=”,下同)0,△H2_______ 0。
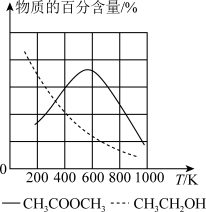
(3)T1 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3(g)、1 molCO(g)、2 mol H2(g) ,发生反应:CH3OCH3(g)+CO(g) +2H2(g) CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为
CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为 ,容器内压强为p MPa。
,容器内压强为p MPa。
①0~10 min内,v(CH3OCH3)=_______ mol·L-1·min-1,平衡后,c(CH3CH2OH) = _______ mol·L-1,Kp=_______ MPa-2(分压=总压×物质的量分数)。
②若将该反应置于温度为T2K下进行,Kp2>Kp1则T2_______ (填“>”或“<”)T1,该反应在_______ (填“ 高温”“低温”或“任意温度”)条件下更有利于自发进行。
③下到说法能判断该反应达到平衡状态的是_______ (填标号)。
A.消耗1molCO时,生成1mol CH3OH
B.CH3CH2OH的浓度不再发生改变
C.混合气体的密度不变
D.容器压强不变
反应1:CH3OCH3(g)+CO(g)
 CH3COOCH3(g) △H1=akJ ·mol-1
CH3COOCH3(g) △H1=akJ ·mol-1反应2:
 CH3COOCH3(g)+H2(g)
CH3COOCH3(g)+H2(g) 
 CH3OH(g)+
CH3OH(g)+  CH3CH2OH(g) △H2=b kJ·mol-1
CH3CH2OH(g) △H2=b kJ·mol-1(1)CH3OCH3(g) +CO(g) +2H2(g)
 CH3OH(g) +CH3CH2OH(g)△H=。
CH3OH(g) +CH3CH2OH(g)△H=。 (2)在某恒容容器中发生反应1和反应2,达到平衡时,体系中物质的百分含量与温度的关系如图所示。由此推知,△H1

(3)T1 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3(g)、1 molCO(g)、2 mol H2(g) ,发生反应:CH3OCH3(g)+CO(g) +2H2(g)
 CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为
CH3OHg)+CH3CH2OH(g),10 min时反应达到平衡,此时CH3OH(g)的体积分数为 ,容器内压强为p MPa。
,容器内压强为p MPa。①0~10 min内,v(CH3OCH3)=
②若将该反应置于温度为T2K下进行,Kp2>Kp1则T2
③下到说法能判断该反应达到平衡状态的是
A.消耗1molCO时,生成1mol CH3OH
B.CH3CH2OH的浓度不再发生改变
C.混合气体的密度不变
D.容器压强不变
您最近一年使用:0次
2022-07-10更新
|
225次组卷
|
2卷引用:湖南省衡阳市部分校2021-2022学年高二下学期期末考试化学试题
名校
8 . 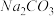 固体溶于水可表示为
固体溶于水可表示为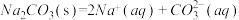 ,其焓变和熵变分别为
,其焓变和熵变分别为 和
和 ,已知:
,已知: ;
; ;
;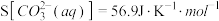 ;且
;且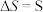 (反应后)
(反应后)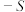 (反应前)下列说法正确的是
(反应前)下列说法正确的是
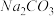 固体溶于水可表示为
固体溶于水可表示为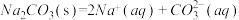 ,其焓变和熵变分别为
,其焓变和熵变分别为 和
和 ,已知:
,已知: ;
; ;
;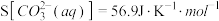 ;且
;且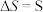 (反应后)
(反应后)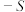 (反应前)下列说法正确的是
(反应前)下列说法正确的是A. 和 和 均大于零 均大于零 |
B. 和 和 均小于零 均小于零 |
C. 小于零, 小于零, 大于零 大于零 |
D. 大于零, 大于零, 小于零 小于零 |
您最近一年使用:0次
2022-07-07更新
|
662次组卷
|
2卷引用:浙江省绍兴市2021-2022学年高二下学期期末考试化学试题
解题方法
9 . 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、CO、NOx等进行研究具有重要意义。请回答下列问题:
(1)关于PM2.5的研究:
常温下用蒸馏水处理PM2.5样本制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5试样显___________ (填“酸性”、“碱性”或“中性”),其pH=___________ 。
(2)关于SO2的研究:
①为减少SO2的排放,常采取的措施之一是将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)=H2O(g) △H=—241.8kJ/mol
O2(g)=H2O(g) △H=—241.8kJ/mol
C(s)+ O2(g)=CO(g) △H=—110.5kJ/mol
O2(g)=CO(g) △H=—110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式___________ ;
②SO2是工业制硫酸的重要中间产物。通过下列反应:2SO2(g)+O2(g) 2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。
2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。
结合信息与下表数据,根据化学理论与生产实际综合分析,为了使二氧化硫尽可能转化为三氧化硫,应选择的生产条件是___________ 。在生产中,还可以通入过量空气,其目的是___________ 。某温度下不同压强下SO2的转化率(%):
③某人设想以如图所示装置用电化学原理将二氧化硫转化为硫酸:
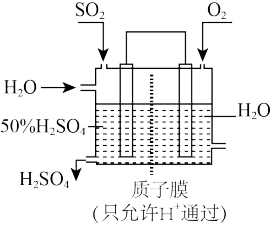
写出通入SO2的电极的电极反应式______ 。
(3)关于NOx和CO的研究:
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K=
2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K= ___________ (计算过程中可进行合理近似处理 ),汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是_______
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的△H>0,该设想能否实现?___________ (填“能”或“否”)。
(1)关于PM2.5的研究:
常温下用蒸馏水处理PM2.5样本制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl— |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)关于SO2的研究:
①为减少SO2的排放,常采取的措施之一是将煤转化为清洁气体燃料。
已知:H2(g)+
 O2(g)=H2O(g) △H=—241.8kJ/mol
O2(g)=H2O(g) △H=—241.8kJ/molC(s)+
 O2(g)=CO(g) △H=—110.5kJ/mol
O2(g)=CO(g) △H=—110.5kJ/mol写出焦炭与水蒸气反应的热化学方程式
②SO2是工业制硫酸的重要中间产物。通过下列反应:2SO2(g)+O2(g)
 2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。
2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。结合信息与下表数据,根据化学理论与生产实际综合分析,为了使二氧化硫尽可能转化为三氧化硫,应选择的生产条件是
| 1×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 转化率 | 97.5% | 99.2% | 99.6% | 99.7% |

写出通入SO2的电极的电极反应式
(3)关于NOx和CO的研究:
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K=
2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K= ②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的△H>0,该设想能否实现?
您最近一年使用:0次
解题方法
10 . 下列变化过程的焓变(△H)和熵变(△S)均大于零的是
| A.H2O(g)→H2O(l) | B.N2(g)+O2(g)=2NO(g) |
| C.2H2O2(l)=2H2O(l)+O2(g) | D.Ag+(aq)+Cl-(aq)=AgCl(s) |
您最近一年使用:0次



