名校
1 . 已知:
反应Ⅰ: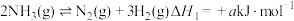
反应Ⅱ: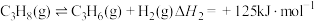
下列说法不正确 的是
| 化学键 |  |  |  |  |
键能/ | 946 | 436 | 391 | 416 |
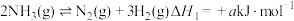
反应Ⅱ:
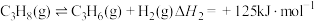
下列说法
A.通过反应Ⅰ计算: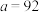 |
B.反应Ⅰ恒压时充入稀有气体: 分解率不变 分解率不变 |
| C.反应Ⅱ为气体分子数增加的反应:熵增加,在一定温度下可自发进行 |
D.通过反应Ⅱ可以计算生成1mol碳碳π键:放出能量 |
您最近一年使用:0次
名校
2 . 硫酸镍一般用于电镀印染媒染剂、金属着色剂等。电镀污泥中主要含有 、
、 、
、 、
、 、
、 和
和 等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:

已知:①焙烧时 和
和 ,分别转化为
,分别转化为 、
、 。
。
②几种金属离子开始沉淀和沉淀完全的 如表:
如表:
(1)镍具有优良的物理和化学特性。羰基法提纯粗镍涉及反应:
 。已知
。已知 (忽略
(忽略 、
、 随温度的变化),当
随温度的变化),当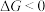 时,反应可以自发进行。若要提高反应中
时,反应可以自发进行。若要提高反应中 的产率且使反应自发进行,采取的反应条件为_______。
的产率且使反应自发进行,采取的反应条件为_______。
(2)“焙烧”时, 参与反应的化学方程式为
参与反应的化学方程式为_______ 。
(3)“滤液”的主要成分是含有少量重金属阳离子的 溶液,除杂装置如图2所示,
溶液,除杂装置如图2所示,
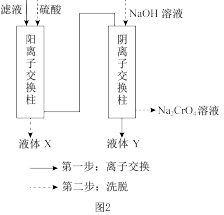
离子交换柱原理为: ;
;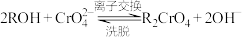
液体X的溶质主要是_______ (填化学式),液体Y是_______ (填名称)。
(4)“沉铁”时_______ (填“能”或“不能”)一并除去含铝杂质,理由是_______ 。
(5)下列金属的冶炼原理与本工艺流程中制Cu的方法相似的是_______(填标号)。
 、
、 、
、 、
、 、
、 和
和 等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
已知:①焙烧时
 和
和 ,分别转化为
,分别转化为 、
、 。
。②几种金属离子开始沉淀和沉淀完全的
 如表:
如表:| 金属离子 |  |  |  |  |
开始沉淀的 | 1.1 | 4.1 | 6.7 | 4.2 |
完全沉淀的 | 3.2 | 5.4 | 9.5 | 6.7 |

 。已知
。已知 (忽略
(忽略 、
、 随温度的变化),当
随温度的变化),当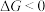 时,反应可以自发进行。若要提高反应中
时,反应可以自发进行。若要提高反应中 的产率且使反应自发进行,采取的反应条件为_______。
的产率且使反应自发进行,采取的反应条件为_______。| A.高温高压 | B.低温高压 | C.低温低压 | D.高温低压 |
 参与反应的化学方程式为
参与反应的化学方程式为(3)“滤液”的主要成分是含有少量重金属阳离子的
 溶液,除杂装置如图2所示,
溶液,除杂装置如图2所示,
离子交换柱原理为:
 ;
;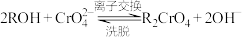
液体X的溶质主要是
(4)“沉铁”时
(5)下列金属的冶炼原理与本工艺流程中制Cu的方法相似的是_______(填标号)。
| A.加热氧化银制银 | B.四氯化钛中加镁冶炼钛 |
| C.焙烧辰砂(HgS)制汞 | D.电解硫酸锰制锰 |
您最近一年使用:0次
2022-12-12更新
|
123次组卷
|
2卷引用:湖南省岳阳教研联盟2022-2023学年高二上学期期中联考化学试题
名校
3 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为: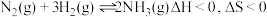 。
。
(1)下列关于工业合成氨的说法正确的是_______。
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______。
(3)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
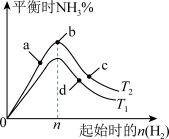
①图像中 和
和 的关系是:
的关系是:
_______  (填“>,<或=”)。
(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是:
的转化率最高的是:_______ 。
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是_______ 。
(4)恒温下,向一个4L的恒容密闭容器中充入 和
和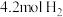 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测
①20min后,反应达平衡,氨气的浓度为 ,用
,用 表示的平均反应速率为
表示的平均反应速率为_______  。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
_______ [对于气相反应,用某组分B的平衡压强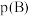 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如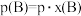 ,p为平衡总压强,
,p为平衡总压强,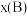 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入 和
和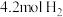 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度_______  (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
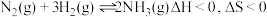 。
。(1)下列关于工业合成氨的说法正确的是_______。
A.因为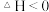 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
B.因为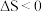 ,所以该反应一定不能自发进行 ,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.该反应在低温下能自发进行 |
A.容器内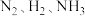 的浓度之比为1∶3∶2 的浓度之比为1∶3∶2 |
B. 百分含量保持不变 百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |

①图像中
 和
和 的关系是:
的关系是:
 (填“>,<或=”)。
(填“>,<或=”)。②a、b、c、d四点所处的平衡状态中,反应物
 的转化率最高的是:
的转化率最高的是:③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(4)恒温下,向一个4L的恒容密闭容器中充入
 和
和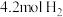 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测①20min后,反应达平衡,氨气的浓度为
 ,用
,用 表示的平均反应速率为
表示的平均反应速率为 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
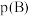 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如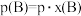 ,p为平衡总压强,
,p为平衡总压强,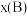 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②若维持容器体积不变,温度不变,向原平衡体系中再加入
 和
和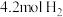 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度 (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
您最近一年使用:0次
2022-12-07更新
|
705次组卷
|
3卷引用:重庆市渝东六校共同体2022-2023学年高二上学期联合诊断考试化学试题
名校
4 . 利用工业废气CO2制甲醇的反应原理CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。
CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。
(1)上述反应的△H1_______ 0(填“>” 、“<” 或“=”),理由是_______ 。
(2)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______
CH3OH(g)+H2O(g)进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______

(3)在VL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生上述反应,请在下图画出达到平衡时CH3OH在混合气体中的体积分数随氢碳比递增的变化趋势_______ 。

(4)现向恒温恒压(0.1MPa)的密闭容器中充入1mol CO2,3mol H2和6mol He,上述反应达平衡时,测得CO2的转化率为20%,则该反应的Kp=_______ (精确到小数点后一位)MPa-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g) CO(g)+H2O(g) △H3=40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:
CO(g)+H2O(g) △H3=40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:_______ 。
 CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。
CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。(1)上述反应的△H1
(2)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______
CH3OH(g)+H2O(g)进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是_______
| A.T3对应的平衡常数小于T4对应的平衡常数 |
| B.根据图中曲线分析,催化剂Ⅰ的催化效果好 |
| C.b点v正可能等于v逆 |
| D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低 |

(4)现向恒温恒压(0.1MPa)的密闭容器中充入1mol CO2,3mol H2和6mol He,上述反应达平衡时,测得CO2的转化率为20%,则该反应的Kp=
(5)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:
CO(g)+H2O(g) △H3=40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:
您最近一年使用:0次
名校
解题方法
5 . TiN具有良好的导电和导热性,可用于高温结构材料和超导材料。可利用化学气相沉积技术来制备氮化钛。请回答下列问题:
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)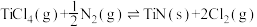
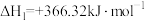
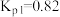
(ⅱ)
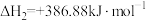
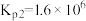
(ⅲ)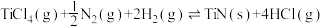
 = + 2.88 kJ/mol
= + 2.88 kJ/mol
利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是_______ 。
(2)在1200℃、130kPa反应条件下,将 、
、 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气体中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气体中 与
与 的分压相等,则
的分压相等,则 平衡转化率为
平衡转化率为_______ (保留三位有效数字),0~20min之间,以分压表示 的平均反应速率为
的平均反应速率为_______  。
。
(3)制备氮化钛的原料氨气的合成。将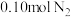 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
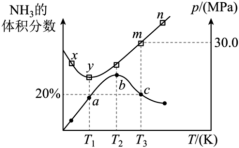
①对于该可逆反应过程,下列有关说法正确的是_______ (填序号)。
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度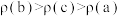
②x、y、m三点对应温度下的平衡常数由大到小的顺序为_______ 。
③当温度为 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数
_______  (列出计算式即可)。
(列出计算式即可)。
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)
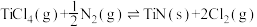
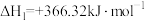
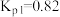
(ⅱ)

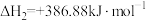
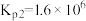
(ⅲ)
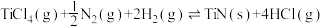
 = + 2.88 kJ/mol
= + 2.88 kJ/mol利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是
(2)在1200℃、130kPa反应条件下,将
 、
、 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气体中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气体中 与
与 的分压相等,则
的分压相等,则 平衡转化率为
平衡转化率为 的平均反应速率为
的平均反应速率为 。
。(3)制备氮化钛的原料氨气的合成。将
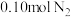 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
①对于该可逆反应过程,下列有关说法正确的是
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度
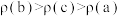
②x、y、m三点对应温度下的平衡常数由大到小的顺序为
③当温度为
 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2022-11-21更新
|
326次组卷
|
3卷引用:河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学试题
6 . 以下为放热反应的共有个
①放出热量的化学反应 ②吸收热量的化学反应 ③反应物的总能量大于生成物的总能量 ④反应物的总能量小于生成物的总能量 ⑤生成物分子键能大于反应物分子键能 ⑥生成物分子键能小于反应物分子键能 ⑦ ⑧
⑧ ⑨正反应活化能大于逆反应活化能的反应 ⑩正反应活化能小于逆反应活化能的反应 ⑪大多数化合反应 ⑫大多数分解反应 ⑬铝热反应 ⑭煤的气化 (水煤气反应) ⑮过氧化氢分解 ⑯
⑨正反应活化能大于逆反应活化能的反应 ⑩正反应活化能小于逆反应活化能的反应 ⑪大多数化合反应 ⑫大多数分解反应 ⑬铝热反应 ⑭煤的气化 (水煤气反应) ⑮过氧化氢分解 ⑯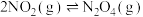 ⑰
⑰ 且任意温 度自发的反应 ⑱
且任意温 度自发的反应 ⑱ 且低温下自发的反应 ⑲
且低温下自发的反应 ⑲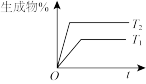 ⑳
⑳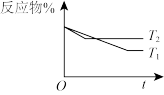
①放出热量的化学反应 ②吸收热量的化学反应 ③反应物的总能量大于生成物的总能量 ④反应物的总能量小于生成物的总能量 ⑤生成物分子键能大于反应物分子键能 ⑥生成物分子键能小于反应物分子键能 ⑦
 ⑧
⑧ ⑨正反应活化能大于逆反应活化能的反应 ⑩正反应活化能小于逆反应活化能的反应 ⑪大多数化合反应 ⑫大多数分解反应 ⑬铝热反应 ⑭煤的气化 (水煤气反应) ⑮过氧化氢分解 ⑯
⑨正反应活化能大于逆反应活化能的反应 ⑩正反应活化能小于逆反应活化能的反应 ⑪大多数化合反应 ⑫大多数分解反应 ⑬铝热反应 ⑭煤的气化 (水煤气反应) ⑮过氧化氢分解 ⑯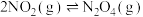 ⑰
⑰ 且任意温 度自发的反应 ⑱
且任意温 度自发的反应 ⑱ 且低温下自发的反应 ⑲
且低温下自发的反应 ⑲ ⑳
⑳
| A.10 | B.11 | C.12 | D.13 |
您最近一年使用:0次
2022-11-17更新
|
277次组卷
|
2卷引用:内蒙古第一机械制造(集团)有限公司第一中学2022-2023学年高二上学期11月线上期中考试化学试题
7 . 下列说法正确的是
A.向 溶液样品中加入硫酸酸化的 溶液样品中加入硫酸酸化的 溶液,紫色褪去,说明该样品中一定混有 溶液,紫色褪去,说明该样品中一定混有 |
B. 在一定条件下能自发进行,则该反应的 在一定条件下能自发进行,则该反应的 |
C. ,向 ,向 的 的 溶液中加水, 溶液中加水, 会增大 会增大 |
D.常温下,用饱和 溶液处理 溶液处理 ,可将 ,可将 转化为 转化为 ,因为该温度下 ,因为该温度下 |
您最近一年使用:0次
2022-11-11更新
|
583次组卷
|
4卷引用:辽宁省协作校2022-2023学年高二上学期期中考试化学试题
名校
解题方法
8 . 完成下列问题
(1)用“>”“<”或“=”填空:
①相同条件下,1mol S(s)与1molO2(g)的总能量_______ 1molSO2 (g)的能量。
②现有常温下甲、乙两种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,甲溶液中的c(OH—)_______ 乙溶液中的c(OH—),甲溶液中水电离出的c(OH—)_______ 乙溶液中水电离出的c(OH—)。
③现有常温下pH=1的盐酸溶液和醋酸溶液,均稀释1000倍后pH分别变为a和b,则a_______ b。
(2)在一定条件下,醋酸溶液中存在电离平衡: ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中
ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中 电离平衡向左移动的是
电离平衡向左移动的是_______ 。
a.加入少量0.10mol/L的稀盐酸 b.加热 c.加入醋酸钠固体 d.加入少量冰醋酸
(3)已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:HClO: ,
, :
: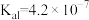 ,
,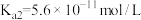 ;
; :
: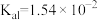 ,
,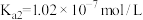 。则①HClO、②
。则①HClO、② 、③
、③ 、④
、④ 四种物质按酸性由强到弱排序(填序号)
四种物质按酸性由强到弱排序(填序号)_______ 。
(4)某温度下纯水中的c(H+)=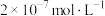 ,则此时溶液中的c(OH—)=
,则此时溶液中的c(OH—)=_______ ;若温度不变,滴入稀盐酸,使c(H+)= ,则此时溶液中由水电离产生的c(H+)=
,则此时溶液中由水电离产生的c(H+)=_______ 。
(5)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
① 爆炸:
爆炸: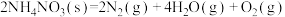
_______
②水煤气转化: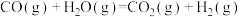
_______
③臭氧的生成: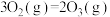
_______
A.熵增大 B.熵减小 C.熵变很小
(1)用“>”“<”或“=”填空:
①相同条件下,1mol S(s)与1molO2(g)的总能量
②现有常温下甲、乙两种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,甲溶液中的c(OH—)
③现有常温下pH=1的盐酸溶液和醋酸溶液,均稀释1000倍后pH分别变为a和b,则a
(2)在一定条件下,醋酸溶液中存在电离平衡:
 ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中
ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中 电离平衡向左移动的是
电离平衡向左移动的是a.加入少量0.10mol/L的稀盐酸 b.加热 c.加入醋酸钠固体 d.加入少量冰醋酸
(3)已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:HClO:
 ,
, :
: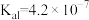 ,
,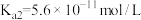 ;
; :
: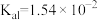 ,
,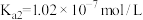 。则①HClO、②
。则①HClO、② 、③
、③ 、④
、④ 四种物质按酸性由强到弱排序(填序号)
四种物质按酸性由强到弱排序(填序号)(4)某温度下纯水中的c(H+)=
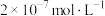 ,则此时溶液中的c(OH—)=
,则此时溶液中的c(OH—)= ,则此时溶液中由水电离产生的c(H+)=
,则此时溶液中由水电离产生的c(H+)=(5)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
①
 爆炸:
爆炸: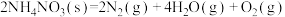
②水煤气转化:
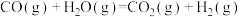
③臭氧的生成:
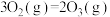
A.熵增大 B.熵减小 C.熵变很小
您最近一年使用:0次
名校
9 . 将二氧化碳加氢制甲醇可以实现碳减排。如果选取氢气或水作为氢源,可能设计出以下两个反应:
Ⅰ:
Ⅱ: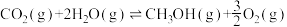
(1)通过计算判断哪个反应可能更适宜于甲醇的工业生产_______ 。
(2)若选择氢气作为氢源时,除了反应Ⅰ外,还可能发生副反应:
Ⅲ:
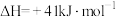
①为提高主反应Ⅰ中 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是_______ (填字母序号)。
a.升高温度 b.增大反应的压强 c.增大 浓度
浓度
②反应过程中,副反应生成的CO也可以与 反应生成甲醇,请写出该反应的热化学方程式:
反应生成甲醇,请写出该反应的热化学方程式:_______ 。
(3)下表是其他条件相同时,不同催化剂成分对甲醇产率及催化选择性的数据。
说明:wt%为质量百分数单位。
由上表数据,可以得到的结论是_______ (填字母序号)。
a.其它条件相同时,催化剂的组成会影响单位时间内所获得的产品质量
b.其它条件相同时,催化剂的组成会影响反应的限度
c.其它条件相同时,催化剂中 对甲醇选择性的影响大于
对甲醇选择性的影响大于
(4)综上所述,利用 合成甲醇,实现碳减排需要考虑的因素有
合成甲醇,实现碳减排需要考虑的因素有_______ 。
Ⅰ:

Ⅱ:
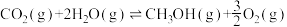
| 298K时反应 |  |  |
| Ⅰ | —49.0 | —177.2 |
| Ⅱ | +676.5 | —43.9 |
(2)若选择氢气作为氢源时,除了反应Ⅰ外,还可能发生副反应:
Ⅲ:

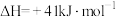
①为提高主反应Ⅰ中
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是a.升高温度 b.增大反应的压强 c.增大
 浓度
浓度②反应过程中,副反应生成的CO也可以与
 反应生成甲醇,请写出该反应的热化学方程式:
反应生成甲醇,请写出该反应的热化学方程式:(3)下表是其他条件相同时,不同催化剂成分对甲醇产率及催化选择性的数据。
| 组成/单位 催化剂 | CuO | ZnO |  |  | MnO |  产率 产率 | 选择性 |
| wt% | wt% | wt% | wt% | wt% |  | % | |
| 催化剂Ⅰ | 65.8 | 26.3 | 7.9 | 0 | 0 | 78 | 40 |
| 催化剂Ⅱ | 62.4 | 25 | 0 | 12.6 | 0 | 96 | 88 |
| 催化剂Ⅲ | 65.8 | 26.6 | 0. | 3.6 | 4 | 88 | 100 |
| 催化剂Ⅳ | 65.8 | 26.6 | 0 | 5.6 | 2 | 138 | 91 |
由上表数据,可以得到的结论是
a.其它条件相同时,催化剂的组成会影响单位时间内所获得的产品质量
b.其它条件相同时,催化剂的组成会影响反应的限度
c.其它条件相同时,催化剂中
 对甲醇选择性的影响大于
对甲醇选择性的影响大于
(4)综上所述,利用
 合成甲醇,实现碳减排需要考虑的因素有
合成甲醇,实现碳减排需要考虑的因素有
您最近一年使用:0次
名校
解题方法
10 . 某科研小组欲研究合成新型硝化剂反应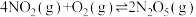 ,ΔH<0的反应。
,ΔH<0的反应。

(1)该反应的ΔS________ 0(填“ ”、“
”、“ ”或“
”或“ ”),在
”),在________ (高温或低温)条件下能自发进行。
(2)在一密闭容器内发生该反应,升高温度,平衡常数________ (填变大、变小或不变,下同),系统内气体的平均分子量________
(3)b,d两点对应的氧气的投入量相同,比较a、b、d点对应的平衡常数 、
、 、
、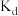 的大小
的大小________ (用 ,
, ,
, 连接)
连接)
(4)比较a、b、c三点所处的平衡状态中,反应物 的转化率最大的是
的转化率最大的是________ (填字母),理由是________ 。
(5)若容器体积为 ,二氧化氮与氧气的初始量都为
,二氧化氮与氧气的初始量都为 ,
, 的平衡转化率为50%,起始时
的平衡转化率为50%,起始时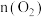 则此条件下
则此条件下 ,反应的平衡常数K=
,反应的平衡常数K=________ 。若保持温度不变,在某一时刻, ,此时平衡
,此时平衡________ (填向正反应方向、逆反应方向或不)移动。
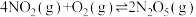 ,ΔH<0的反应。
,ΔH<0的反应。
(1)该反应的ΔS
 ”、“
”、“ ”或“
”或“ ”),在
”),在(2)在一密闭容器内发生该反应,升高温度,平衡常数
(3)b,d两点对应的氧气的投入量相同,比较a、b、d点对应的平衡常数
 、
、 、
、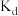 的大小
的大小 ,
, ,
, 连接)
连接)(4)比较a、b、c三点所处的平衡状态中,反应物
 的转化率最大的是
的转化率最大的是(5)若容器体积为
 ,二氧化氮与氧气的初始量都为
,二氧化氮与氧气的初始量都为 ,
, 的平衡转化率为50%,起始时
的平衡转化率为50%,起始时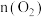 则此条件下
则此条件下 ,反应的平衡常数K=
,反应的平衡常数K= ,此时平衡
,此时平衡
您最近一年使用:0次



