1 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
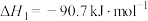

②
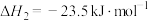

③
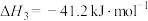

回答下列问题:
(1)反应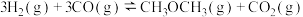 的
的
___________  ;该反应在
;该反应在___________ (填“低温”或“高温”)下能够自发进行,反应的平衡常数K=___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)将合成气以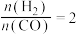 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应: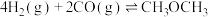

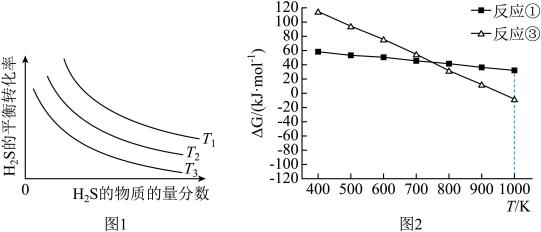
 ,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)
,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)___________ 。
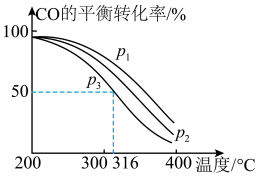
A.
B.
C.若在 和316℃时,起始时
和316℃时,起始时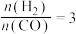 ,则平衡时,
,则平衡时,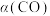 小于50%
小于50%
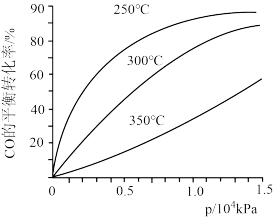
(3)CO合成甲醇时,在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、 kPa左右,选择此压强的理由是
kPa左右,选择此压强的理由是___________ 。
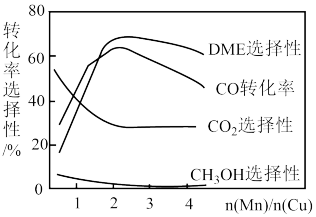
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和 制备二甲醚(DME)。观察下图,当
制备二甲醚(DME)。观察下图,当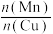 约为
约为___________ 时最有利于二甲醚的合成。
(5)高温时二甲醚蒸气发生分解反应: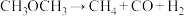 。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强
。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强 如下表:
如下表:
①该反应达到平衡状态时,二甲醚的转化率为___________ 。
②该反应的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
①


②


③

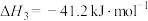

回答下列问题:
(1)反应
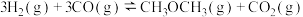 的
的
 ;该反应在
;该反应在 、
、 、
、 的式子表示)。
的式子表示)。(2)将合成气以
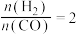 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应: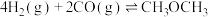

 ,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)
,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)
A.

B.
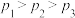
C.若在
 和316℃时,起始时
和316℃时,起始时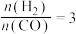 ,则平衡时,
,则平衡时,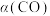 小于50%
小于50%(3)CO合成甲醇时,在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、
 kPa左右,选择此压强的理由是
kPa左右,选择此压强的理由是
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和
 制备二甲醚(DME)。观察下图,当
制备二甲醚(DME)。观察下图,当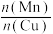 约为
约为
(5)高温时二甲醚蒸气发生分解反应:
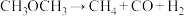 。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强
。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强 如下表:
如下表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
 /kPa /kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
②该反应的平衡常数

您最近一年使用:0次
名校
解题方法
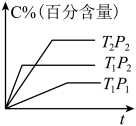
2 . 以下图像对应的叙述正确的是
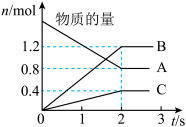 | 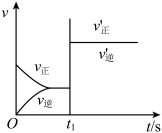 | 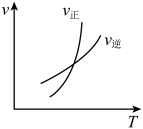 |  |
 | 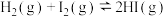 |   |   |
| 甲 | 乙 | 丙 | 丁 |
| A.图丁:该正向反应在任何温度下都能自发进行 |
| B.图丙:对图中反应升高温度,该反应平衡常数减小 |
C.图乙: 时刻改变的条件只能是加入催化剂 时刻改变的条件只能是加入催化剂 |
D.图甲: 的平衡转化率为 的平衡转化率为 |
您最近一年使用:0次
2023-10-27更新
|
575次组卷
|
2卷引用:河南省南阳市第一中学校2023-2024学年高二上学期第二次月考化学试题
名校
3 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片。
Ⅰ.已知25℃和101kPa下:
①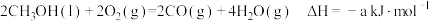
②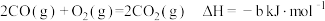
③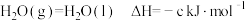
(1)则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
Ⅱ. 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入
在一定条件下反应可制得合成气,在1L密闭容器中分别通入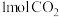 和
和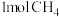 ,发生反应:
,发生反应: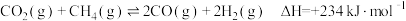 。
。
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)下列能判断 达到平衡状态的是___________(填序号)。
达到平衡状态的是___________(填序号)。
Ⅲ.已知 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: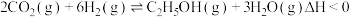 ,设m为起始时的投料比,即
,设m为起始时的投料比,即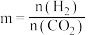 。
。
(4)图中投料比相同,温度从高到低的顺序为___________ 。
(5)图2 、
、 、
、 从大到小的顺序为
从大到小的顺序为___________ 。

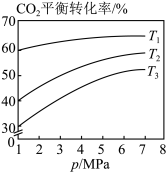
(6)下图表示在总压为5MPa的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系,则曲线d代表的物质为
时,平衡状态时各物质的物质的量分数与温度的关系,则曲线d代表的物质为___________ (填化学式)。
Ⅳ.工业上可用丙烯加成法制备1,2—二氯丙烷( ),主要副产物为3—氯丙烯(
),主要副产物为3—氯丙烯( ),反应原理为:
),反应原理为:
①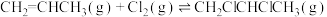
②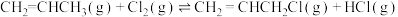
一定温度下,向恒容密闭容器中充入等物质的量的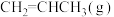 和
和 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:
(7)用单位时间内气体分压的变化表示反应①的反应速率,即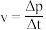 ,则前120min内平均反应速率
,则前120min内平均反应速率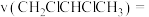
___________ 。
(8)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数
___________  (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
Ⅰ.已知25℃和101kPa下:
①
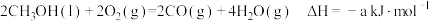
②
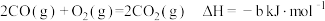
③
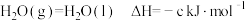
(1)则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为Ⅱ.
 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入
在一定条件下反应可制得合成气,在1L密闭容器中分别通入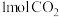 和
和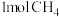 ,发生反应:
,发生反应: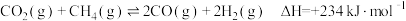 。
。(2)该反应在
(3)下列能判断
 达到平衡状态的是___________(填序号)。
达到平衡状态的是___________(填序号)。| A.一定温度下,容积固定的容器中,密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
Ⅲ.已知
 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: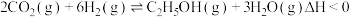 ,设m为起始时的投料比,即
,设m为起始时的投料比,即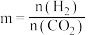 。
。(4)图中投料比相同,温度从高到低的顺序为

(5)图2
 、
、 、
、 从大到小的顺序为
从大到小的顺序为
(6)下图表示在总压为5MPa的恒压条件下,且
 时,平衡状态时各物质的物质的量分数与温度的关系,则曲线d代表的物质为
时,平衡状态时各物质的物质的量分数与温度的关系,则曲线d代表的物质为
Ⅳ.工业上可用丙烯加成法制备1,2—二氯丙烷(
 ),主要副产物为3—氯丙烯(
),主要副产物为3—氯丙烯( ),反应原理为:
),反应原理为:①
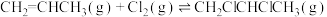
②
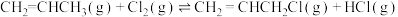
一定温度下,向恒容密闭容器中充入等物质的量的
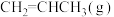 和
和 发生反应,容器内气体的压强随时间的变化如表所示:
发生反应,容器内气体的压强随时间的变化如表所示:| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
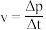 ,则前120min内平均反应速率
,则前120min内平均反应速率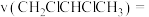
(8)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数

 (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
名校
解题方法
4 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为:

(1)下列关于工业合成氨的说法正确的是___________。
(2)一定温度下,在密闭容器中充入 和
和 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的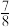 ,则
,则 的转化率为
的转化率为___________ 。
(3)工业上合成氨的部分工艺流程如图:
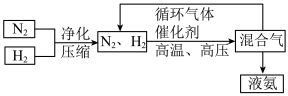
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:
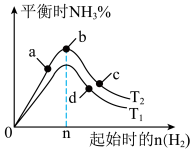
图象中 和
和 的关系是:
的关系是:
___________  (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是___________ (填字母)。
(5)恒温下,往一个 的密闭容器中充入
的密闭容器中充入 和
和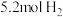 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:
此条件下该反应的化学平衡常数
___________ ;若维持容器体积不变,温度不变,往原平衡体系中加入 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向___________ 反应方向移动(填“正”或“逆”)。

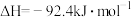

(1)下列关于工业合成氨的说法正确的是___________。
A.因为 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
| B.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行 |
| C.合成氨反应选择在400~500℃进行的重要原因是此温度下氨的产率最高 |
| D.生产中在考虑动力和设备材料承受能力的前提下,压强越大越好 |
(2)一定温度下,在密闭容器中充入
 和
和 并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的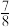 ,则
,则 的转化率为
的转化率为(3)工业上合成氨的部分工艺流程如图:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响,实验结果如图所示(图中T表示温度)。则:

图象中
 和
和 的关系是:
的关系是:
 (填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物
(填“>、<或=”,下同);a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是
的转化率最高的是(5)恒温下,往一个
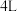 的密闭容器中充入
的密闭容器中充入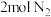 和
和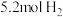 ,反应过程中对
,反应过程中对 的浓度进行检测,得到的数据如表所示:
的浓度进行检测,得到的数据如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
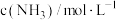 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

 、
、 和
和 各
各 ,化学平衡将向
,化学平衡将向
您最近一年使用:0次
5 . 在恒温恒容的密闭容器中发生 △H<0,T℃时,平衡常数为K,下列说法正确的是
△H<0,T℃时,平衡常数为K,下列说法正确的是
 △H<0,T℃时,平衡常数为K,下列说法正确的是
△H<0,T℃时,平衡常数为K,下列说法正确的是| A.该反应在任何温度下都可自发进行 |
B.T℃时,若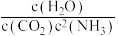 <K时,则V正<V逆 <K时,则V正<V逆 |
| C.若容器内气体压强保持不变,该可逆反应达到化学平衡状态 |
| D.选择高效催化剂可以提高活化分子百分数,提高CO(NH2)2平衡产率 |
您最近一年使用:0次
2023-08-14更新
|
694次组卷
|
4卷引用:四川省双流棠湖中学2023-2024学年高二上学期11月期中化学试题
6 .  的转化一直是全球研究的热点,其中将
的转化一直是全球研究的热点,其中将 和
和 合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25℃,
合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25℃, 下测定):
下测定):
Ⅰ.
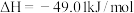
Ⅱ.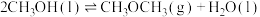
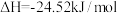
Ⅲ.
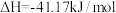
(1)工业上用 和
和 合成二甲醚的热化学方程式为:
合成二甲醚的热化学方程式为:_______ 。
(2)根据题目信息,写出反应Ⅲ的平衡常数表达式_______ ,该反应在_______ (填高温、低温或任何温度下)可以自发进行。
①密闭容器中加入相同物质的量的CO和 发生反应Ⅲ,在某一温度下,在不同催化剂的作用下,测得
发生反应Ⅲ,在某一温度下,在不同催化剂的作用下,测得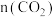 随时间变化情况如图所示。
随时间变化情况如图所示。
下列说法正确的是_______ 。
A.曲线A对应的反应,前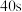 的平均速率
的平均速率
B.曲线A对应的反应速率先增大后减小
C.由图可知,三种条件下反应的活化能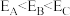
D.由图可知,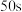 之前三个反应都未达到平衡状态
之前三个反应都未达到平衡状态
②在三个相同容器A、B、C中,各起始反应物浓度相同,在不同温度下,经过相同时间后测得容器中的CO物质的量与温度的关系如图,请解释曲线中CO的物质的量先减小后增大的原因_______ 。

(3)一定量的 在一密闭容器中发生反应Ⅱ,容器内
在一密闭容器中发生反应Ⅱ,容器内 的浓度随时间的变化曲线如图。在
的浓度随时间的变化曲线如图。在 时刻把容器体积扩大为原来的2倍,
时刻把容器体积扩大为原来的2倍, 时刻达到新平衡,请画出
时刻达到新平衡,请画出 到
到 时
时 的浓度变化曲线
的浓度变化曲线_______ 。

(4)用 和
和 在酸性环境中电解法可制得
在酸性环境中电解法可制得 ,试写出该反应阴极的电极反应式
,试写出该反应阴极的电极反应式_______ 。
 的转化一直是全球研究的热点,其中将
的转化一直是全球研究的热点,其中将 和
和 合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25℃,
合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25℃, 下测定):
下测定):Ⅰ.

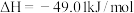
Ⅱ.
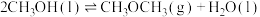
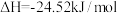
Ⅲ.

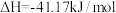
(1)工业上用
 和
和 合成二甲醚的热化学方程式为:
合成二甲醚的热化学方程式为:(2)根据题目信息,写出反应Ⅲ的平衡常数表达式
①密闭容器中加入相同物质的量的CO和
 发生反应Ⅲ,在某一温度下,在不同催化剂的作用下,测得
发生反应Ⅲ,在某一温度下,在不同催化剂的作用下,测得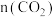 随时间变化情况如图所示。
随时间变化情况如图所示。
下列说法正确的是
A.曲线A对应的反应,前
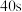 的平均速率
的平均速率
B.曲线A对应的反应速率先增大后减小
C.由图可知,三种条件下反应的活化能
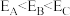
D.由图可知,
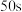 之前三个反应都未达到平衡状态
之前三个反应都未达到平衡状态②在三个相同容器A、B、C中,各起始反应物浓度相同,在不同温度下,经过相同时间后测得容器中的CO物质的量与温度的关系如图,请解释曲线中CO的物质的量先减小后增大的原因

(3)一定量的
 在一密闭容器中发生反应Ⅱ,容器内
在一密闭容器中发生反应Ⅱ,容器内 的浓度随时间的变化曲线如图。在
的浓度随时间的变化曲线如图。在 时刻把容器体积扩大为原来的2倍,
时刻把容器体积扩大为原来的2倍, 时刻达到新平衡,请画出
时刻达到新平衡,请画出 到
到 时
时 的浓度变化曲线
的浓度变化曲线
(4)用
 和
和 在酸性环境中电解法可制得
在酸性环境中电解法可制得 ,试写出该反应阴极的电极反应式
,试写出该反应阴极的电极反应式
您最近一年使用:0次
7 . 党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
I.工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯:
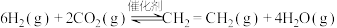

已知:
①
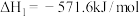
②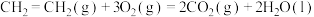
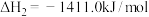
③
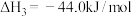
(1)
________ ,该反应能够自发进行的条件是________ (填“低温”、“高温”或“任何温度”)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于平衡状态的是________(填标号)。
通入原料气,能判断该反应处于平衡状态的是________(填标号)。
(3)向密闭容器按投料比 通入原料气,不同温度对
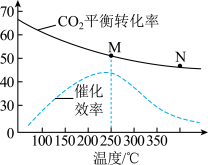
通入原料气,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)
的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)________ P(N),原因是:________ 。
II. 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:
①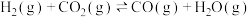

②

恒压条件下, 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
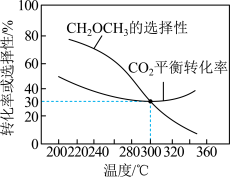
(4)300℃时,通入 、
、 各0.5mol,平衡时
各0.5mol,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
________ (保留2位有效数字)。
(5)温度高于300℃, 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是________ 。
III.电化学法也可还原二氧化碳制乙烯,原理如图所示。
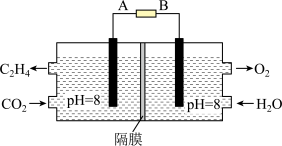
(6)该电池的阴极电极反应式为:________ 。
I.工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: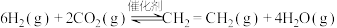

已知:
①

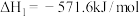
②
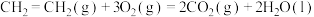
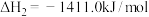
③

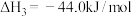
(1)

(2)恒温恒容下,向密闭容器按投料比
 通入原料气,能判断该反应处于平衡状态的是________(填标号)。
通入原料气,能判断该反应处于平衡状态的是________(填标号)。A. |
| B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 |
D.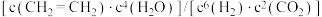 保持不变 保持不变 |
 通入原料气,不同温度对
通入原料气,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)
的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)
II.
 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:①
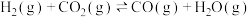

②


恒压条件下,
 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
的平衡转化率和的选择性随温度变化如图所示。已知:的选择性

(4)300℃时,通入
 、
、 各0.5mol,平衡时
各0.5mol,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
(5)温度高于300℃,
 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是III.电化学法也可还原二氧化碳制乙烯,原理如图所示。

(6)该电池的阴极电极反应式为:
您最近一年使用:0次
2023-08-08更新
|
489次组卷
|
2卷引用:辽宁省部分学校2023-2024高二上学期期末考试化学试卷
解题方法
8 . 完成下列问题。
(1)一定温度下,体积为 的密闭容器中,
的密闭容器中, 、
、 间发生反应。各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
间发生反应。各物质的物质的量随时间变化的关系如图所示。请回答下列问题:

①该反应的化学方程式可表示为___________ 。在0到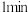 中内用
中内用 表示该反应的速率是
表示该反应的速率是___________ ,该反应达最大限度时 的转化率
的转化率___________ 。
②若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中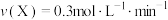 ,乙中
,乙中 ,则
,则___________ 中反应更快。
(2)已知在 、
、 下,
下,
 ,
,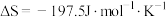 ,已知
,已知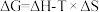 ,若
,若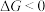 ,反应能够自发进行。请你判断该反应在室温下能否自发进行?简要写出推断的依据
,反应能够自发进行。请你判断该反应在室温下能否自发进行?简要写出推断的依据___________ 。
(1)一定温度下,体积为
 的密闭容器中,
的密闭容器中, 、
、 间发生反应。各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
间发生反应。各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
①该反应的化学方程式可表示为
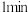 中内用
中内用 表示该反应的速率是
表示该反应的速率是 的转化率
的转化率②若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中
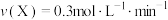 ,乙中
,乙中 ,则
,则(2)已知在
 、
、 下,
下,
 ,
,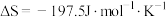 ,已知
,已知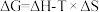 ,若
,若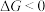 ,反应能够自发进行。请你判断该反应在室温下能否自发进行?简要写出推断的依据
,反应能够自发进行。请你判断该反应在室温下能否自发进行?简要写出推断的依据
您最近一年使用:0次
名校
9 . 油气开采、石油化工、煤化工等行业产生的废气普遍含有硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①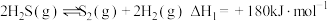
②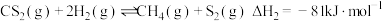
则反应③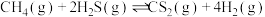 的
的
_________________  ;下列叙述能说明反应③达到平衡状态的是
;下列叙述能说明反应③达到平衡状态的是_________________ (填标号)。
a.断裂 的同时生成
的同时生成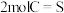
B.恒温恒压条件下,混合气体的平均摩尔质量不再变化
C.恒温恒容条件下,混合气体的密度不再变化
D.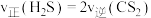
(2)对于上述反应①,在不同温度、压强为 、进料
、进料 的物质的量分数为
的物质的量分数为 (其余为
(其余为 )的条件下,
)的条件下, 的平衡转化率如图1所示。
的平衡转化率如图1所示。 和
和 的大小关系为
的大小关系为_________________ 。
(3)上述反应①和③的 随温度的变化如图2所示,已知
随温度的变化如图2所示,已知 (
( 为常数,
为常数, 为温度,
为温度, 为平衡常数),则在
为平衡常数),则在 时,反应的自发趋势:①
时,反应的自发趋势:①_________________ ③(选填“>”“<”或“=”)。在 、
、 条件下,
条件下,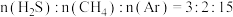 的混合气发生反应,达到平衡时
的混合气发生反应,达到平衡时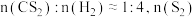 接近于0,其原因是
接近于0,其原因是__________________________________ 。
(4)在恒温恒压 条件下,
条件下,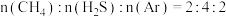 的混合气仅发生反应③,达到平衡时,
的混合气仅发生反应③,达到平衡时, 的分压与
的分压与 的分压相同。则
的分压相同。则 的转化率为
的转化率为_________________ ,反应③的
_________________ 。
(1)已知下列反应的热化学方程式:
①
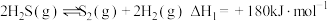
②
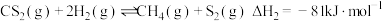
则反应③
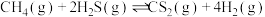 的
的
 ;下列叙述能说明反应③达到平衡状态的是
;下列叙述能说明反应③达到平衡状态的是a.断裂
 的同时生成
的同时生成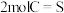
B.恒温恒压条件下,混合气体的平均摩尔质量不再变化
C.恒温恒容条件下,混合气体的密度不再变化
D.
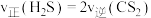
(2)对于上述反应①,在不同温度、压强为
 、进料
、进料 的物质的量分数为
的物质的量分数为 (其余为
(其余为 )的条件下,
)的条件下, 的平衡转化率如图1所示。
的平衡转化率如图1所示。 和
和 的大小关系为
的大小关系为
(3)上述反应①和③的
 随温度的变化如图2所示,已知
随温度的变化如图2所示,已知 (
( 为常数,
为常数, 为温度,
为温度, 为平衡常数),则在
为平衡常数),则在 时,反应的自发趋势:①
时,反应的自发趋势:① 、
、 条件下,
条件下,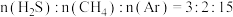 的混合气发生反应,达到平衡时
的混合气发生反应,达到平衡时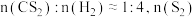 接近于0,其原因是
接近于0,其原因是(4)在恒温恒压
 条件下,
条件下,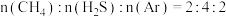 的混合气仅发生反应③,达到平衡时,
的混合气仅发生反应③,达到平衡时, 的分压与
的分压与 的分压相同。则
的分压相同。则 的转化率为
的转化率为
您最近一年使用:0次
10 . 在一定条件下,向某 恒容密闭容器中充入
恒容密闭容器中充入 、
、 ,发生反应
,发生反应 ,测得反应
,测得反应 时,不同温度下氢气的转化率如图所示。[已知:该反应的速率方程
时,不同温度下氢气的转化率如图所示。[已知:该反应的速率方程 、
、 ,
, 、
、 只与温度有关]
只与温度有关]
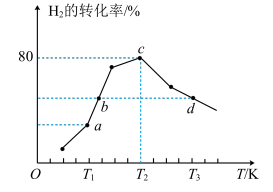
下列说法错误的是
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 ,发生反应
,发生反应 ,测得反应
,测得反应 时,不同温度下氢气的转化率如图所示。[已知:该反应的速率方程
时,不同温度下氢气的转化率如图所示。[已知:该反应的速率方程 、
、 ,
, 、
、 只与温度有关]
只与温度有关]
下列说法错误的是
A.图中a、b、c三点对应的 由大到小的顺序为 由大到小的顺序为 |
| B.该反应在低温下可自发进行 |
C. 温度下,起始时容器内的压强为 温度下,起始时容器内的压强为 , ,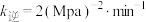 ,则该温度下 ,则该温度下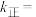 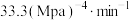 |
| D.升高温度或增大压强,都可以提高反应物的平衡转化率 |
您最近一年使用:0次



