名校
解题方法
1 . 甲醇是重要的化工原料之一,也可用作燃料,利用合成气(主要成分为CO、 和
和 )可以合成甲醇,涉及的反应如下:
)可以合成甲醇,涉及的反应如下:
反应i:

反应ii:
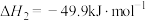
反应iii:

(1)在某催化剂作用下,反应i的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
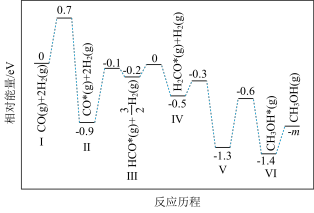
①反应i在________ (填“较低”或“较高”)温度下才能自发进行。
②结合反应历程,写出反应i中生成甲醇的决速步骤的反应方程式:________ 。
(2)将一定量的 和
和 充入密闭容器中并加入合适的催化剂,只发生反应ii和iii。一定条件下,测得
充入密闭容器中并加入合适的催化剂,只发生反应ii和iii。一定条件下,测得 的平衡转化率、
的平衡转化率、 的选择性
的选择性 和CO的选择性
和CO的选择性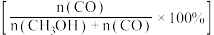 随压强的变化曲线如图所示。
随压强的变化曲线如图所示。

①图中表示 的平衡转化率的曲线是
的平衡转化率的曲线是________ (填“m”、“n”或“p”下同) 的选择性曲线是
的选择性曲线是________ CO的选择性曲线是________ 。
②有利于提高提高甲醇选择性的条件是________ 。
A.低温高压 B.低温低压 C.高温高压 D.高温低压
(3)有研究认为,在某催化剂作用下反应ii先后通过反应iii、i来实现。保持温度T不变,向一2L恒容密闭容器中充入 和
和 ,在该催化剂作用下发生反应,经5min达到平衡,测得
,在该催化剂作用下发生反应,经5min达到平衡,测得 的物质的量为3mol,起始及达平衡时容器的总压强比为3:2,则从开始到平衡用
的物质的量为3mol,起始及达平衡时容器的总压强比为3:2,则从开始到平衡用 表示的平均反应速率为
表示的平均反应速率为________  。
。
 和
和 )可以合成甲醇,涉及的反应如下:
)可以合成甲醇,涉及的反应如下:反应i:


反应ii:

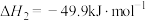
反应iii:


(1)在某催化剂作用下,反应i的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
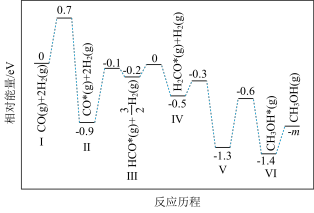
①反应i在
②结合反应历程,写出反应i中生成甲醇的决速步骤的反应方程式:
(2)将一定量的
 和
和 充入密闭容器中并加入合适的催化剂,只发生反应ii和iii。一定条件下,测得
充入密闭容器中并加入合适的催化剂,只发生反应ii和iii。一定条件下,测得 的平衡转化率、
的平衡转化率、 的选择性
的选择性 和CO的选择性
和CO的选择性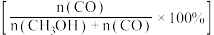 随压强的变化曲线如图所示。
随压强的变化曲线如图所示。
①图中表示
 的平衡转化率的曲线是
的平衡转化率的曲线是 的选择性曲线是
的选择性曲线是②有利于提高提高甲醇选择性的条件是
A.低温高压 B.低温低压 C.高温高压 D.高温低压
(3)有研究认为,在某催化剂作用下反应ii先后通过反应iii、i来实现。保持温度T不变,向一2L恒容密闭容器中充入
 和
和 ,在该催化剂作用下发生反应,经5min达到平衡,测得
,在该催化剂作用下发生反应,经5min达到平衡,测得 的物质的量为3mol,起始及达平衡时容器的总压强比为3:2,则从开始到平衡用
的物质的量为3mol,起始及达平衡时容器的总压强比为3:2,则从开始到平衡用 表示的平均反应速率为
表示的平均反应速率为 。
。
您最近一年使用:0次
名校
解题方法
2 . 通过化学的方法实现 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径,由
减排途径,由 和
和 制备
制备 (二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:
(二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:
a.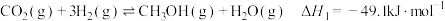
b.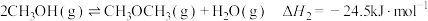
c.
已知: ,如:
,如: 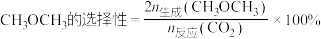 。
。
回答下列问题:
(1)写出 与
与 转化为
转化为 和
和 (反应d)的热化学方程式
(反应d)的热化学方程式______________________ 。
(2)反应a达到平衡时,若缩小体积增大压强,则 变
变____________ (填“大”或“小”)。
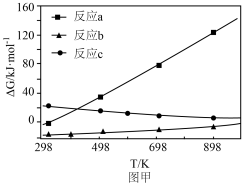
(3)反应a、b、c的吉布斯自由能随温度变化如图甲所示,298K时,能自发进行的反应有___________ ;反应c为熵______________ (填“增”或“减”)反应。
(4)向体积为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 ,若仅考点上述反应,平衡时
,若仅考点上述反应,平衡时 和
和 的选择性及
的选择性及 的转化率随温度的变化如图乙实线所示。
的转化率随温度的变化如图乙实线所示。
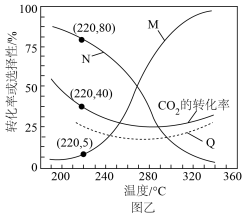
①图中曲线____________ (填“N”或“M”)表示 的选择性。
的选择性。
②平衡时 的转化率随温度的变化
的转化率随温度的变化____________ (填“可能”或“不可能”)如图中虚线Q所示。
③温度高于270℃,随着温度的升高, 的平衡转化率如图所示变化的原因是
的平衡转化率如图所示变化的原因是___________________ 。
④计算反应 在220℃下的平衡常数为
在220℃下的平衡常数为______________ (结果保留三位有效数字)。
 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径,由
减排途径,由 和
和 制备
制备 (二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:
(二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:a.
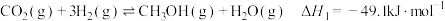
b.
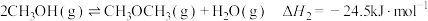
c.

已知:
 ,如:
,如: 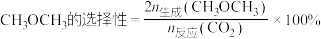 。
。回答下列问题:
(1)写出
 与
与 转化为
转化为 和
和 (反应d)的热化学方程式
(反应d)的热化学方程式(2)反应a达到平衡时,若缩小体积增大压强,则
 变
变(3)反应a、b、c的吉布斯自由能随温度变化如图甲所示,298K时,能自发进行的反应有

(4)向体积为
 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 ,若仅考点上述反应,平衡时
,若仅考点上述反应,平衡时 和
和 的选择性及
的选择性及 的转化率随温度的变化如图乙实线所示。
的转化率随温度的变化如图乙实线所示。
①图中曲线
 的选择性。
的选择性。②平衡时
 的转化率随温度的变化
的转化率随温度的变化③温度高于270℃,随着温度的升高,
 的平衡转化率如图所示变化的原因是
的平衡转化率如图所示变化的原因是④计算反应
 在220℃下的平衡常数为
在220℃下的平衡常数为
您最近一年使用:0次
2023-12-12更新
|
197次组卷
|
2卷引用:重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题
名校
解题方法
3 . 将0.20mol NO和0.20mol CO混合气体充入容积为1.0L的恒容密闭容器中,分别在 和
和 温度下发生反应:
温度下发生反应: 。反应过程中容器内
。反应过程中容器内 的物质的量随时间变化关系如图所示,下列说法正确的是
的物质的量随时间变化关系如图所示,下列说法正确的是

 和
和 温度下发生反应:
温度下发生反应: 。反应过程中容器内
。反应过程中容器内 的物质的量随时间变化关系如图所示,下列说法正确的是
的物质的量随时间变化关系如图所示,下列说法正确的是
A. 的 的 |
B.温度 时,前12分钟 时,前12分钟 的平均反应速率 的平均反应速率 |
C.温度 时,该反应的平衡常数 时,该反应的平衡常数 |
D.温度 时,若起始向容器中通入0.10mol NO、0.30mol CO、0.10mol 时,若起始向容器中通入0.10mol NO、0.30mol CO、0.10mol 和0.10mol 和0.10mol ,反应向正方向进行 ,反应向正方向进行 |
您最近一年使用:0次
2023-12-09更新
|
193次组卷
|
2卷引用:广东省广州市广雅集团2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
4 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为: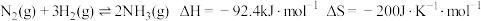 。回答下列问题:
。回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)工业常采用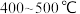 。针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂。使用
。针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂。使用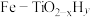 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为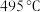 时,
时, 的温度为
的温度为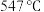 ,而
,而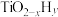 的温度为
的温度为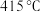 )。
)。
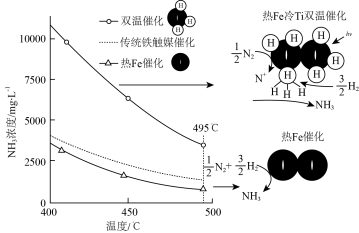
下列说法正确的是___________
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(3)某合成氨速率方程为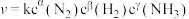 ,根据表中数据,
,根据表中数据,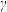 =
=___________ 。
(4)工业合成氨基本合成过程如下
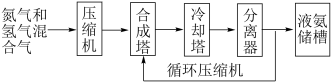
分离器中的过程对整个工业合成氨的意义是___________
(5)氯化银可以溶于氨水,反应原理为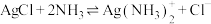 。
。
已知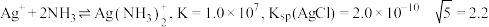 ,
,
常温时,用 某浓度氨水(溶质视为
某浓度氨水(溶质视为 )完全溶解
)完全溶解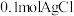 ,所需氨水浓度至少为
,所需氨水浓度至少为_______ 
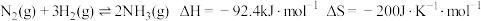 。回答下列问题:
。回答下列问题:(1)合成氨反应在常温下
(2)工业常采用
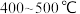 。针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂。使用
。针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂。使用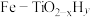 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为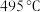 时,
时, 的温度为
的温度为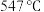 ,而
,而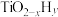 的温度为
的温度为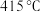 )。
)。
下列说法正确的是
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(3)某合成氨速率方程为
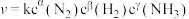 ,根据表中数据,
,根据表中数据,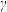 =
=| 实验 | c(N2) | c(H2) | c(NH3) | v/mol·L—1.s—1 |
| 1 | m | n | P | q |
| 2 | 2m | n | P | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | P | 2.828q |
(4)工业合成氨基本合成过程如下

分离器中的过程对整个工业合成氨的意义是
(5)氯化银可以溶于氨水,反应原理为
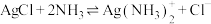 。
。已知
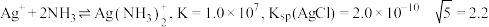 ,
,常温时,用
 某浓度氨水(溶质视为
某浓度氨水(溶质视为 )完全溶解
)完全溶解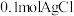 ,所需氨水浓度至少为
,所需氨水浓度至少为
您最近一年使用:0次
2023-12-06更新
|
95次组卷
|
2卷引用:黑龙江省大庆实验中学2023-2024学年高二上学期期中考试化学试题
5 . 二氧化碳加氢制甲烷和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2 CH4(g)+2H2O(g) △H1(298K)
CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g) CO(g)+H2O(g) △H2(298K)
CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g) CO2(g)+CH4(g) △H3(298K)
CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
(1)有利于反应①自发进行的条件是_______ (填“高温”或“低温”);根据表中数据计算反应②的焓变△H2(298K)=_______ kJ·mol-1。
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=_______ mol·L-1·min-1(用含a、b、V的代数式表示,下同),此时H2O(g)的浓度为_______ mol·L-1,反应II的平衡常数为_______ (列出计算式)。
II.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的逆反应CO(g)+3H2 CH4(g)+H2O(g)。合成总反应在起始物
CH4(g)+H2O(g)。合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
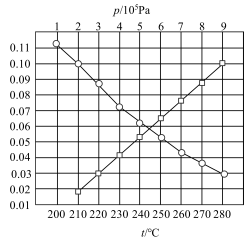
①当CO的平衡转化率为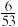 时,反应条件可能是
时,反应条件可能是_______ 。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是_______ 。
I.CO2加氢选择合成甲烷的主要反应如下:
①CO2(g)+4H2
 CH4(g)+2H2O(g) △H1(298K)
CH4(g)+2H2O(g) △H1(298K)②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2(298K)
CO(g)+H2O(g) △H2(298K)③2CO(g)+2H2(g)
 CO2(g)+CH4(g) △H3(298K)
CO2(g)+CH4(g) △H3(298K)在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
| 物质 | H2(g) | O2(g) | CO(g) | CO2(g) | H2O(g) | CH4(g) |
| 标准摩尔生成焓(kJ·mol-1) | 0 | 0 | -110.5 | -393.5 | -241.8 | -74.81 |
(1)有利于反应①自发进行的条件是
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和4molH2发生上述反应,反应20min容器内反应达到平衡时,容器中CH4为amol,CO为bmol,以H2表示的0~20min内平均反应速率v(H2)=
II.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的逆反应CO(g)+3H2
 CH4(g)+H2O(g)。合成总反应在起始物
CH4(g)+H2O(g)。合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
=3时,在不同条件下达到平衡,设体系中CH4的物质的量分数为x(CH4),在t=250℃下的x(CH4)-p、在p=5×105Pa下的x(CH4)-t如图所示。
①当CO的平衡转化率为
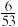 时,反应条件可能是
时,反应条件可能是②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是
您最近一年使用:0次
名校
解题方法
6 . 下列说法正确的是
| A.在铁棒上镀铜时,阳极不一定要用Cu做电极 |
B.反应 在室温下可自发进行,则该反应的 在室温下可自发进行,则该反应的 |
C.中和热测定实验中,应把稀硫酸缓慢并分次倒入 溶液中并搅拌 溶液中并搅拌 |
D.相同条件下,等pH的 溶液和 溶液和 溶液,后者导电能力更强 溶液,后者导电能力更强 |
您最近一年使用:0次
2023-11-23更新
|
260次组卷
|
3卷引用:山东省青岛第二中学2023-2024学年高二上学期期中考试化学试卷
解题方法
7 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分,写出该反应的热化学方程式___________ 。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=—112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=—234kJ/mol
(2)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol•L-1•min-1。
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示:
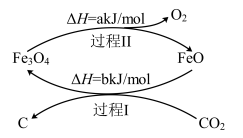
①在转化过程中起催化作用的物质是___________ 。
②写出总反应的化学方程式___________ 。
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应分两步进行:
CO(NH2)2(l)+H2O(l),该反应分两步进行:
①2NH3(g)+CO2(g) NH4COONH2(s)
NH4COONH2(s)
②NH4COONH2(s) =CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白:
①已知该反应可以自发进行,则△H___________ 0(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
=x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为___________ 。

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体物质的量变为起始时气体物质的量的 时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=_______ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分,写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=—112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=—234kJ/mol
(2)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示:

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l),该反应分两步进行:
CO(NH2)2(l)+H2O(l),该反应分两步进行:①2NH3(g)+CO2(g)
 NH4COONH2(s)
NH4COONH2(s)②NH4COONH2(s) =CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白:
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
=x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体物质的量变为起始时气体物质的量的
 时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
您最近一年使用:0次
名校
8 . 已知合成氨反应: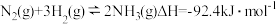 ,反应速率方程为
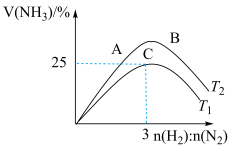
,反应速率方程为 (k为常数,随温度的升高而增大)。下图表示在恒压密闭容器中,不同温度下,达到平衡时
(k为常数,随温度的升高而增大)。下图表示在恒压密闭容器中,不同温度下,达到平衡时 的体积百分数与投料比
的体积百分数与投料比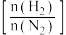 的关系。有关说法错误的是
的关系。有关说法错误的是
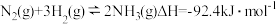 ,反应速率方程为
,反应速率方程为 (k为常数,随温度的升高而增大)。下图表示在恒压密闭容器中,不同温度下,达到平衡时
(k为常数,随温度的升高而增大)。下图表示在恒压密闭容器中,不同温度下,达到平衡时 的体积百分数与投料比
的体积百分数与投料比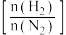 的关系。有关说法错误的是
的关系。有关说法错误的是
| A.该反应低温可自发 |
B.其他条件不变,减小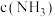 可使合成氨速率加快 可使合成氨速率加快 |
C.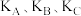 的大小关系为 的大小关系为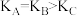 |
D.C点时 的平衡转化率为 的平衡转化率为 |
您最近一年使用:0次
解题方法
9 . CO2的资源化利用是实现碳中和的重要途径。
Ⅰ.热化学法处理CO2
CO2加氢制CH3OH的反应为: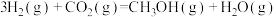
(1)该反应能自发进行的主要原因是___________ 。
(2)该反应的正反应速率可表示为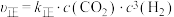 ,逆反应速率可表示为
,逆反应速率可表示为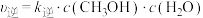 ,其中
,其中 、
、 为速率常数。下图中能够代表
为速率常数。下图中能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”“
”“ ”或“
”或“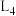 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

(3)实际合成反应时,也会有CH3COCH3等生成。在恒压条件下,H2、CO2的体积比为 反应时,在催化剂作用下反应相同时间所测得的CH3OH选择性(CH3OH选择性
反应时,在催化剂作用下反应相同时间所测得的CH3OH选择性(CH3OH选择性 )和产率随温度的变化如图所示:
)和产率随温度的变化如图所示:
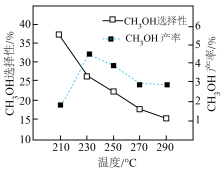
①合成CH3OH最适宜的温度为___________ ;
②在210℃~230℃范围内随着温度的升高,CH3OH的产率迅速升高的原因是___________ 。
Ⅱ.电化学法处理CO2的资源化利用是实现碳中和的重要途径
一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的资源化利用是实现碳中和的重要途径装置示意图如图所示。
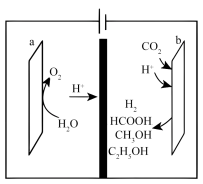
(4)b电极生成HCOOH的电极反应式为___________ 。
(5)科研小组利用13CO2的资源化利用是实现碳中和的重要途径代替原有的CO2的资源化利用是实现碳中和的重要途径进行研究,其目的是___________ 。
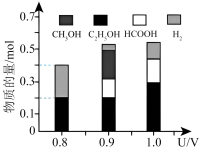
(6)控制其他条件相同,将一定量的CO2的资源化利用是实现碳中和的重要途径通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图所示。控制电压为0.8V,电解时转移的电子的物质的量为___________ mol。
Ⅰ.热化学法处理CO2
CO2加氢制CH3OH的反应为:
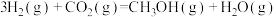
(1)该反应能自发进行的主要原因是
(2)该反应的正反应速率可表示为
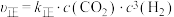 ,逆反应速率可表示为
,逆反应速率可表示为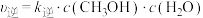 ,其中
,其中 、
、 为速率常数。下图中能够代表
为速率常数。下图中能够代表 的曲线为
的曲线为 ”“
”“ ”“
”“ ”或“
”或“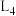 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)实际合成反应时,也会有CH3COCH3等生成。在恒压条件下,H2、CO2的体积比为
 反应时,在催化剂作用下反应相同时间所测得的CH3OH选择性(CH3OH选择性
反应时,在催化剂作用下反应相同时间所测得的CH3OH选择性(CH3OH选择性 )和产率随温度的变化如图所示:
)和产率随温度的变化如图所示:
①合成CH3OH最适宜的温度为
②在210℃~230℃范围内随着温度的升高,CH3OH的产率迅速升高的原因是
Ⅱ.电化学法处理CO2的资源化利用是实现碳中和的重要途径
一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的资源化利用是实现碳中和的重要途径装置示意图如图所示。

(4)b电极生成HCOOH的电极反应式为
(5)科研小组利用13CO2的资源化利用是实现碳中和的重要途径代替原有的CO2的资源化利用是实现碳中和的重要途径进行研究,其目的是
(6)控制其他条件相同,将一定量的CO2的资源化利用是实现碳中和的重要途径通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图所示。控制电压为0.8V,电解时转移的电子的物质的量为

您最近一年使用:0次
名校
解题方法
10 . 在298K和100kPa压力下,已知金刚石和石墨的熵、燃烧热和密度分别为:
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是
| 物质 | S/(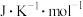 ) ) |  /( /( ) ) |  /( /(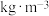 ) ) |
| C(金刚石) | 2.4 | -395.40 | 3513 |
| C(石墨) | 5.7 | -393.51 | 2260 |
A.该反应的 , , |
| B.金刚石比石墨稳定 |
C.由公式 可知,该反应 可知,该反应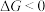 |
| D.超高压条件下,石墨有可能变为金刚石 |
您最近一年使用:0次
2023-11-11更新
|
289次组卷
|
2卷引用:西南大学附属中学校2023-2024学年高二上学期期中考试化学试题



