名校
1 . 汽车尾气净化反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.8 kJ/mol,ΔS=-197.5J/(mol·K)。为了探究其转化效率,某小组利用传感器测定一定温度下投入
N2(g)+2CO2(g) ΔH=-746.8 kJ/mol,ΔS=-197.5J/(mol·K)。为了探究其转化效率,某小组利用传感器测定一定温度下投入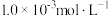 NO、
NO、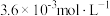 CO的物质的量浓度与时间关系如图所示:
CO的物质的量浓度与时间关系如图所示:
 N2(g)+2CO2(g) ΔH=-746.8 kJ/mol,ΔS=-197.5J/(mol·K)。为了探究其转化效率,某小组利用传感器测定一定温度下投入
N2(g)+2CO2(g) ΔH=-746.8 kJ/mol,ΔS=-197.5J/(mol·K)。为了探究其转化效率,某小组利用传感器测定一定温度下投入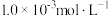 NO、
NO、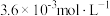 CO的物质的量浓度与时间关系如图所示:
CO的物质的量浓度与时间关系如图所示:
| A.上述正反应在较高温度下能自发进行 |
| B.b→c段反应速率v(NO)=0.1 mol/(L·s) |
| C.单位时间内消耗NO和消耗CO2浓度相等时达到平衡状态 |
| D.该温度下,上述反应的平衡常数K=500 |
您最近一年使用:0次
2024-03-18更新
|
568次组卷
|
4卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期3月月考化学试题
江西省宜春市宜丰中学2023-2024学年高二下学期3月月考化学试题河北省2023-2024学年高三下学期3月省级联测化学试题(已下线)题型7 化学反应速率与化学平衡 水溶液中的离子反应与平衡(25题)-2024年高考化学常考点必杀300题(新高考通用)湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
2 . 为了实现“碳中和”,研发 的利用技术成为热点。
的利用技术成为热点。
反应I:
反应Ⅱ:
请回答:
(1)反应I能够自发进行的条件是__________ 。
(2)向 的恒容密闭容器中充入
的恒容密闭容器中充入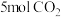 和
和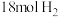 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量 与温度
与温度 的关系如下图所示。
的关系如下图所示。
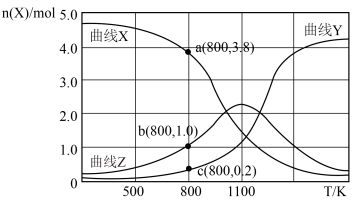
①写出曲线Y表示的含碳元素物质的化学式__________ 。
② 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
__________ [对于气相反应,用某组分 的平衡压强
的平衡压强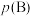 代替物质的量浓度
代替物质的量浓度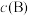 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如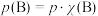 ,
, 为平衡总压强,
为平衡总压强,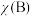 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。
(3)可用 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: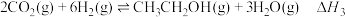 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、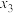 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示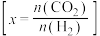 :
:

①上述反应的活化能 (正)
(正)__________  (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
② 、
、 、
、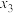 由大到小的顺序是
由大到小的顺序是__________ 。
③从平衡角度分析,随温度升高,不同投料比时 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因__________ 。
(4)科学家提出由 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中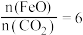 ,则
,则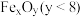 的化学式为
的化学式为__________ 。

(5)水系可逆 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:

①放电时复合膜中向 极移动的离子是
极移动的离子是__________ 。
②充电时多孔 纳米片电极的电极反应式为
纳米片电极的电极反应式为__________ 。
 的利用技术成为热点。
的利用技术成为热点。反应I:

反应Ⅱ:

请回答:
(1)反应I能够自发进行的条件是
(2)向
 的恒容密闭容器中充入
的恒容密闭容器中充入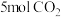 和
和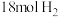 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量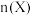 与温度
与温度 的关系如下图所示。
的关系如下图所示。
①写出曲线Y表示的含碳元素物质的化学式
②
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
 的平衡压强
的平衡压强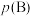 代替物质的量浓度
代替物质的量浓度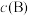 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如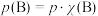 ,
, 为平衡总压强,
为平衡总压强,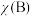 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。(3)可用
 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: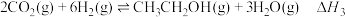 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、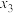 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示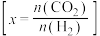 :
:
①上述反应的活化能
 (正)
(正) (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②
 、
、 、
、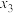 由大到小的顺序是
由大到小的顺序是③从平衡角度分析,随温度升高,不同投料比时
 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因(4)科学家提出由
 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中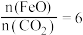 ,则
,则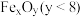 的化学式为
的化学式为
(5)水系可逆
 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:
①放电时复合膜中向
 极移动的离子是
极移动的离子是②充电时多孔
 纳米片电极的电极反应式为
纳米片电极的电极反应式为
您最近一年使用:0次
解题方法
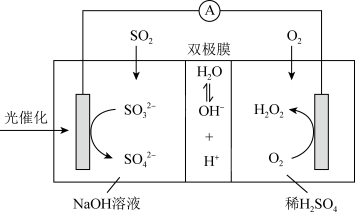
3 . 我国科研人员设计将脱除 的反应与制备
的反应与制备 相结合的协同转化装置如图。在电场作用下,双极膜中间层的
相结合的协同转化装置如图。在电场作用下,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移。已知:①单独制备
,并向两极迁移。已知:①单独制备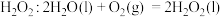 ,不能自发进行;②单独脱除
,不能自发进行;②单独脱除 :
: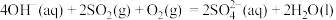 能自发进行。下列说法
能自发进行。下列说法不正确 的是
 的反应与制备
的反应与制备 相结合的协同转化装置如图。在电场作用下,双极膜中间层的
相结合的协同转化装置如图。在电场作用下,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移。已知:①单独制备
,并向两极迁移。已知:①单独制备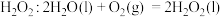 ,不能自发进行;②单独脱除
,不能自发进行;②单独脱除 :
: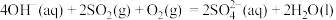 能自发进行。下列说法
能自发进行。下列说法
A.②单独脱除 反应的 反应的 |
B.协同转化工作时, 透过双极膜向左侧移动 透过双极膜向左侧移动 |
C.正极的电极反应式: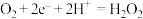 |
D.协同转化总反应: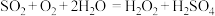 |
您最近一年使用:0次
4 . 随着温室效应越来越严重,降低空气中二氧化碳含量成为研究热点,回答下列问题。
将二氧化碳转化为甲醇是目前重要的碳中和方法,体系中发生如下反应:
主反应:①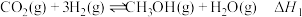
副反应:②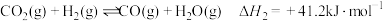
已知: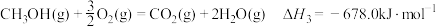

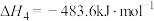
(1)反应①的
___________ (用含 、
、 的代数式表示),该反应在
的代数式表示),该反应在___________ (填“高温”“低温”或“任何温度下”)下有利于自发进行。
(2)密闭容器中通入CO2和H2仅发生反应①,仅改变以下一个条件,能提高H2平衡转化率的措施有___________(填正确答案的编号)。
(3)某温度下,1L恒容密闭容器中加入1molCO2(g)和3molH2(g),发生反应①和反应②,平衡时CO2的转化率为α,CO(g)的物质的量为bmol,计算反应①的平衡常数K=___________ (用含有α、b的计算式表示)。
(4)副反应②在Cu催化时,反应历程如下(*表示吸附在催化剂表面),请写出步骤iv的方程式。
i: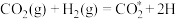
ii: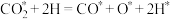
iii:
iv:___________
v: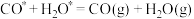
(5)选择不同的温度和催化剂(a、b、c)都对甲醇产率有影响,根据下图,最佳反应条件为___________ 。
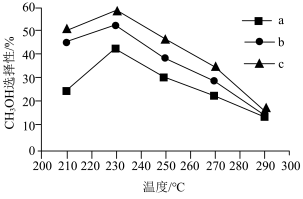
(6)电解还原二氧化碳也能实现碳中和,图2为电解还原CO2制备CO,同时获得两种副产物的装置:
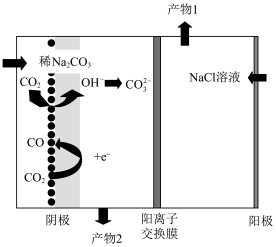
①请写出阳极的电极反应式:___________ 。
②产物2为___________ 。
将二氧化碳转化为甲醇是目前重要的碳中和方法,体系中发生如下反应:
主反应:①
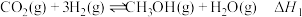
副反应:②
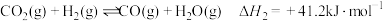
已知:
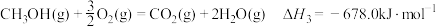

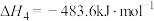
(1)反应①的

 、
、 的代数式表示),该反应在
的代数式表示),该反应在(2)密闭容器中通入CO2和H2仅发生反应①,仅改变以下一个条件,能提高H2平衡转化率的措施有___________(填正确答案的编号)。
| A.恒温恒容时增加CO2(g)用量 | B.恒温恒压下通入惰性气体 |
| C.升高温度 | D.加入催化剂 |
(3)某温度下,1L恒容密闭容器中加入1molCO2(g)和3molH2(g),发生反应①和反应②,平衡时CO2的转化率为α,CO(g)的物质的量为bmol,计算反应①的平衡常数K=
(4)副反应②在Cu催化时,反应历程如下(*表示吸附在催化剂表面),请写出步骤iv的方程式。
i:
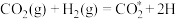
ii:
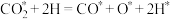
iii:

iv:
v:
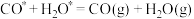
(5)选择不同的温度和催化剂(a、b、c)都对甲醇产率有影响,根据下图,最佳反应条件为

(6)电解还原二氧化碳也能实现碳中和,图2为电解还原CO2制备CO,同时获得两种副产物的装置:

①请写出阳极的电极反应式:
②产物2为
您最近一年使用:0次
名校
解题方法
5 . 我国的能源消费结构以燃煤为主,将煤气化可减少环境污染。
(1)将煤与水蒸气在恒容密闭容器中反应,可制合成气。制备过程中的主要反应(a)、(b)的 (
( 为以分压表示的平衡常数)与温度T的关系如图所示。回答下列问题:
为以分压表示的平衡常数)与温度T的关系如图所示。回答下列问题:
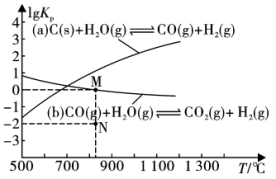
①下列能说明反应(a)
 已达到平衡状态的是
已达到平衡状态的是___________ (填字母)。
A. B.混合气体的总压强不再变化
B.混合气体的总压强不再变化
C. 不再变化 D.混合气体的密度不再变化
不再变化 D.混合气体的密度不再变化
②在容积为1L的密闭容器中充入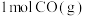 、
、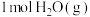 只发生反应(b),反应5 min到达图中M点,请计算0~5 min内,平均反应速率
只发生反应(b),反应5 min到达图中M点,请计算0~5 min内,平均反应速率
___________  ;已知反应速率
;已知反应速率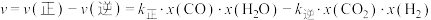 ,
, 、
、 分别为正、逆反应速率常数,x为物质的量分数,N处的
分别为正、逆反应速率常数,x为物质的量分数,N处的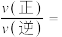
___________ 。
(2)一种新型煤气化燃烧集成制氢发生的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.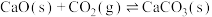

Ⅳ.
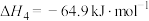
副反应:
Ⅴ.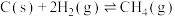
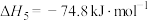
Ⅵ.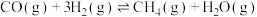
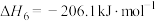
已知反应Ⅰ、Ⅱ的平衡常数 ,
, 随温度的变化如图1、图2所示。
随温度的变化如图1、图2所示。
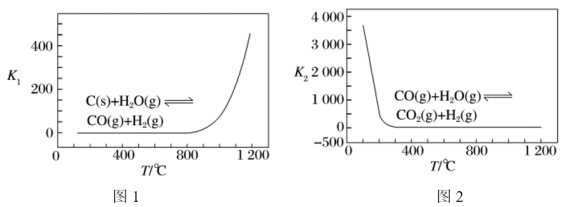
①由反应Ⅴ和反应Ⅵ可知,
___________  ;反应Ⅰ的
;反应Ⅰ的
___________ (填“>”或“<”)0。
②温度小于800℃时, ,原因是
,原因是___________ 。
③为提高反应Ⅱ中CO的转化率,可采取的措施是___________ (写一条)。
④ 时,向密闭容器中充入
时,向密闭容器中充入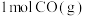 和
和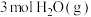 ,只发生反应Ⅱ,此时该反应的平衡常数
,只发生反应Ⅱ,此时该反应的平衡常数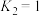 ,CO的平衡转化率为
,CO的平衡转化率为___________ 。
⑤从环境保护角度分析,该制氢工艺中设计反应Ⅲ的优点是___________ 。
(1)将煤与水蒸气在恒容密闭容器中反应,可制合成气。制备过程中的主要反应(a)、(b)的
 (
( 为以分压表示的平衡常数)与温度T的关系如图所示。回答下列问题:
为以分压表示的平衡常数)与温度T的关系如图所示。回答下列问题:
①下列能说明反应(a)

 已达到平衡状态的是
已达到平衡状态的是A.
 B.混合气体的总压强不再变化
B.混合气体的总压强不再变化C.
 不再变化 D.混合气体的密度不再变化
不再变化 D.混合气体的密度不再变化②在容积为1L的密闭容器中充入
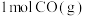 、
、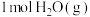 只发生反应(b),反应5 min到达图中M点,请计算0~5 min内,平均反应速率
只发生反应(b),反应5 min到达图中M点,请计算0~5 min内,平均反应速率
 ;已知反应速率
;已知反应速率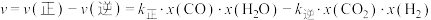 ,
, 、
、 分别为正、逆反应速率常数,x为物质的量分数,N处的
分别为正、逆反应速率常数,x为物质的量分数,N处的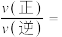
(2)一种新型煤气化燃烧集成制氢发生的主要反应如下:
Ⅰ.


Ⅱ.


Ⅲ.
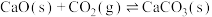

Ⅳ.

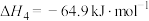
副反应:
Ⅴ.
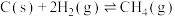
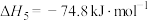
Ⅵ.
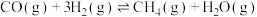
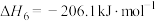
已知反应Ⅰ、Ⅱ的平衡常数
 ,
, 随温度的变化如图1、图2所示。
随温度的变化如图1、图2所示。
①由反应Ⅴ和反应Ⅵ可知,

 ;反应Ⅰ的
;反应Ⅰ的
②温度小于800℃时,
 ,原因是
,原因是③为提高反应Ⅱ中CO的转化率,可采取的措施是
④
 时,向密闭容器中充入
时,向密闭容器中充入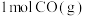 和
和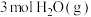 ,只发生反应Ⅱ,此时该反应的平衡常数
,只发生反应Ⅱ,此时该反应的平衡常数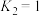 ,CO的平衡转化率为
,CO的平衡转化率为⑤从环境保护角度分析,该制氢工艺中设计反应Ⅲ的优点是
您最近一年使用:0次
6 . 利用 催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
反应I:

反应Ⅱ: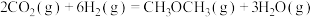

请回答:
(1)反应I的平衡常数表达式为
__________ ;反应Ⅱ发生自发反应的条件是__________ 。
(2)在一定温度和恒容条件下,可以作为判断上述两个反应均达到平衡状态的依据是__________。
(3)在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)

①对于反应I,图中A点时,
__________  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
②可能有利于提高 平衡产率的措施有
平衡产率的措施有__________ 。
A.缩小容器的体积 B.升高反应的温度
C.选择更合适于反应Ⅱ的催化剂 D.适当调整 和
和 起始量的比例
起始量的比例
③图中温度高于300℃, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是__________ 。
 催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:
催化加氢合成二甲醚,其过程中同时发生以下两个主要反应:反应I:


反应Ⅱ:
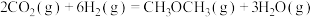

请回答:
(1)反应I的平衡常数表达式为

(2)在一定温度和恒容条件下,可以作为判断上述两个反应均达到平衡状态的依据是__________。
| A.体系内的压强保持不变 | B.两个反应的平衡常数不变 |
C. | D.反应体系中各物质的浓度不变 |
(3)在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
的选择性随温度的变化如下图。(选择性的通俗理解:当两个反应同时发生时,选择更有利于哪个反应进行)
①对于反应I,图中A点时,

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②可能有利于提高
 平衡产率的措施有
平衡产率的措施有A.缩小容器的体积 B.升高反应的温度
C.选择更合适于反应Ⅱ的催化剂 D.适当调整
 和
和 起始量的比例
起始量的比例③图中温度高于300℃,
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是
您最近一年使用:0次
7 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
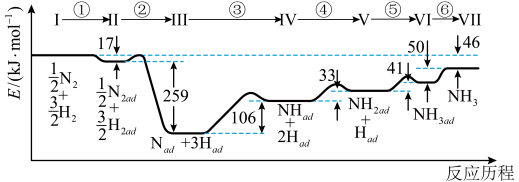
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
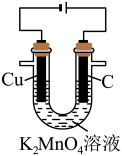
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
153次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
解题方法
8 . 氢能源是最具应用前景的能源之一,甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法,其涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: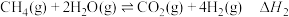
反应Ⅲ:
回答下列问题:
(1)
___________  ,反应Ⅱ能在
,反应Ⅱ能在___________ (填“高温”或“低温”)的条件下自发进行。
(2)某温度下,按照投料比 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为___________ (填分数);实际生产中反应物投料比小于反应的化学计量数之比,目的是___________ 。
(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因___________ 。
(4)在T℃、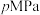 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和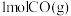 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为___________  ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)调整CO和 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:

A、B、C、D、E中温度最高的点是___________ 。
反应Ⅰ:

反应Ⅱ:
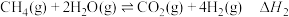
反应Ⅲ:

回答下列问题:
(1)

 ,反应Ⅱ能在
,反应Ⅱ能在(2)某温度下,按照投料比
 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高
 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因(4)在T℃、
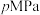 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和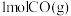 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为 ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
 物质的量分数)。
物质的量分数)。(5)调整CO和
 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
A、B、C、D、E中温度最高的点是
您最近一年使用:0次
名校
解题方法
9 . 工业上 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:
反应Ⅰ:
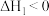
反应Ⅱ:

回答下列问题:
(1)已知: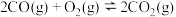
 ,则反应
,则反应

________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)关于反应Ⅰ,下列说法正确的有___________(填标号)。
(3)向恒压(p)密闭装置中充入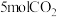 和
和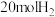 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量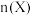 随温度
随温度 变化关系如图所示。
变化关系如图所示。

①曲线 对应物质为
对应物质为____ (填化学式)。
② 达平衡时,反应Ⅰ的平衡常数Kp=
达平衡时,反应Ⅰ的平衡常数Kp=____ (列计算式即可)。
③结合图像分析,达平衡时装置中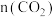 随温度升高的变化趋势为
随温度升高的变化趋势为____ (填标号)。
A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是____ 。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
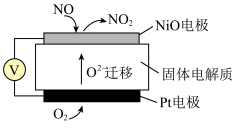
①Pt电极上发生的是______ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:________ 。
 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:反应Ⅰ:

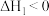
反应Ⅱ:


回答下列问题:
(1)已知:
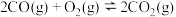
 ,则反应
,则反应

 、
、 、
、 的代数式表示)。
的代数式表示)。(2)关于反应Ⅰ,下列说法正确的有___________(填标号)。
| A.反应物的键能之和高于生成物的键能之和 |
| B.低温条件有利于该反应自发进行 |
| C.混合气体的平均摩尔质量不再改变,说明反应已达平衡 |
D.恒容条件下,充入更多的 能提高单位体积活化分子的百分数 能提高单位体积活化分子的百分数 |
(3)向恒压(p)密闭装置中充入
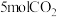 和
和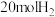 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量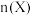 随温度
随温度 变化关系如图所示。
变化关系如图所示。
①曲线
 对应物质为
对应物质为②
 达平衡时,反应Ⅰ的平衡常数Kp=
达平衡时,反应Ⅰ的平衡常数Kp=③结合图像分析,达平衡时装置中
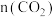 随温度升高的变化趋势为
随温度升高的变化趋势为A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备
 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
名校
解题方法
10 . 工业上,利用异丙醇制备丙烯。已知:
①
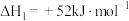
②

③

已知几种共价键键能如下表所示:
下列叙述正确的是
①

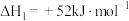
②


③


已知几种共价键键能如下表所示:
| 共价键 |  |  |  |  |  |  |
键能/( ) ) | 413 | 347 |  | 799 | 467 | 498 |
| A.反应①和②在任何温度下都能自发进行 |
B.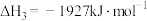 |
C. 的键能为 的键能为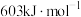 |
| D.在恒温恒容容器进行反应①②③,平衡时总压减小 |
您最近一年使用:0次



